模板法結合溶劑熱法制備SnO2多孔球體
薛寒明,邵光杰,2,張柳麗,許曉娟
(1.燕山大學環境與化學工程學院,河北秦皇島 066004;2.亞穩材料制備技術與科學國家重點實驗室,河北秦皇島 066004)
體積變化引起電極的“粉化”或“團聚”,造成比容量衰減、循環穩定性下降[1],制約了SnO2負極材料的應用。在改善SnO2循環性能方面,人們將注意力放在超細納米材料或有特殊空間形態材料的制備上,合成了一維結構的納米線[2]、納米棒[3]、納米管[4],以及二維結構的納米薄膜[5]等。
本文作者采用模板法結合溶劑熱法,利用葡萄糖脫水碳化和SnCl4水解,合成零維(在三維空間上均處于納米尺度)[6]球形SnO2納米顆粒,并使納米單元集合形成幾何結構完整的三維多孔球體。制備具有納米尺度的多孔結構材料,有望在整體上改善SnO2的電化學性能,提高容量保持率。
1 實驗
1.1 材料的制備
將20 mmol葡萄糖(天津產,AR)和8 mmol SnCl4(成都產,AR)溶解到20 ml水和50 ml乙醇(天津產,AR)的混合液中,形成無色透明溶液,在高壓反應釜(威海產)中、180℃下恒溫反應24 h,冷卻至室溫。將黑褐色沉積物用水和乙醇洗滌數次,再在50℃下干燥12 h,得到SnO2/C前驅體;再將前驅體放入SG2-3-10型坩堝電阻爐(天津產)中,在空氣中、550℃下焙燒5 h,得到淡黃色SnO2粉體。
1.2 物理性能分析
用D/Max-2500/pc型X射線衍射儀(日本產)分析物相,CuKα,λ=0.154 06 nm,管壓 40 kV、管流 100 mA,掃描速度為 5(°)/min;用S-4800型場發射掃描電子顯微鏡(FESEM,日本產)觀察粉末的形貌,加速電壓為15 kV;用NOVA 4000e型比表面及孔徑分析儀(美國產)對材料進行分析,氮氣為吸附氣體。
1.3 扣式電池的組裝和電化學性能測試
將制備的活性物質SnO2、乙炔黑(上海產,電池級)和聚偏氟乙烯(上海產,電池級)按質量比 80∶10∶10,在N-甲基-2-吡咯烷酮(天津產,AR)中混合,涂覆于經120℃烘干的、0.010 mm厚的銅箔(天津產,電池級)上,在120℃下真空(真空度為-0.09 MPa)干燥12 h,冷卻后輥壓至 0.012 mm厚,裁剪成φ=14 mm的圓形電極片(含5~6 mg活性物質)。以上述極片為工作電極,金屬鋰片(秦皇島產,電池級)為對電極和參比電極,1 mol/L LiPF6/EC+DMC(體積比1∶1,天津產,電池級)為電解液,Celgard 2500膜(日本產)為隔膜,在充滿氬氣的手套箱中組裝CR2025型扣式電池。
用電池測試系統(武漢)進行充放電性能測試,電壓為0.005~2.000 V。
2 結果與討論
2.1 物理性能分析
圖1為SnO2/C前驅體和SnO2的XRD圖。
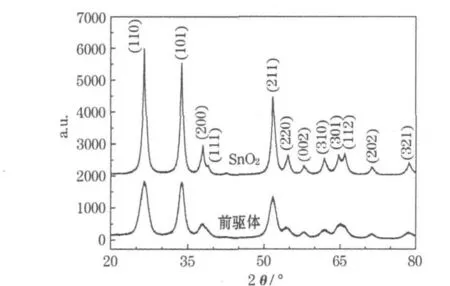
圖1 SnO2/C前驅體和SnO2的XRD圖Fig.1 XRD patterns of SnO2/C precursor and SnO2
將制備的SnO2/C前驅體的XRD圖與標準卡(41-1445)對比,確定存在金紅石型SnO2。峰形彌散,表明結晶度較差;半峰寬較寬,說明晶粒的粒徑較小。由謝樂公式,計算出(110)晶面的粒徑約為5.1 nm,沒有碳的衍射峰,表明碳為無定形態。制備的SnO2衍射峰的位置、強度及晶胞參數(a=b=0.474 0 nm,c=0.318 7 nm)與標準卡的數據基本對應,且峰形較尖銳,無雜質峰,表明材料為純凈的四方晶系金紅石型,空間點群為P42/mnm。由謝樂公式,計算出(110)晶面的粒徑約為10 nm,焙燒后,晶粒增長,晶形趨于完整。
圖2為SnO2/C前驅體和SnO2的FE-SEM圖。

圖2 SnO2/C前驅體和SnO2的FE-SEM圖Fig.2 Field emission-scanning electron microscope(FE-SEM)photographs of SnO2/C precursor and SnO2
圖2a中微小的白色點為SnO2納米顆粒,SnO2吸附在無定形碳的連續相中,晶粒細小且發育不完整;從圖2b、c可知,在空氣中焙燒后,SnO2形成幾何結構完整的三維多孔球體,球形度較好,粒度集中于 1~2 μ m,球體表面粗糙,球體之間有獨立空間;從圖2d可知,聚集形成球體的SnO2球形納米顆粒,均勻光滑,粒徑約為15 nm,顆粒之間有一定的間隙,且團聚不明顯。在溶劑熱反應中,SnCl4的水解和葡萄糖的脫水碳化同時發生,由于葡萄糖過量,水解在脫水碳化的小環境中發生。無定形碳表面存在—OH和CO 親水基團,易將Sn4+吸附在表面,形成吸附著SnO2的無定形碳連續相。在空氣中焙燒,無定形碳以CO2的形式釋放,釋放時的壓力迫使SnO2顆粒聚集,同時SnO2顆粒結晶長大,失去碳的支撐,趨向于自由體積的減小,形成穩定的三維多孔球體結構。無定形碳作為模板,對控制產物球體結構的形成起關鍵作用。
對SnO2材料進行比表面及孔徑分析,結果見圖3。
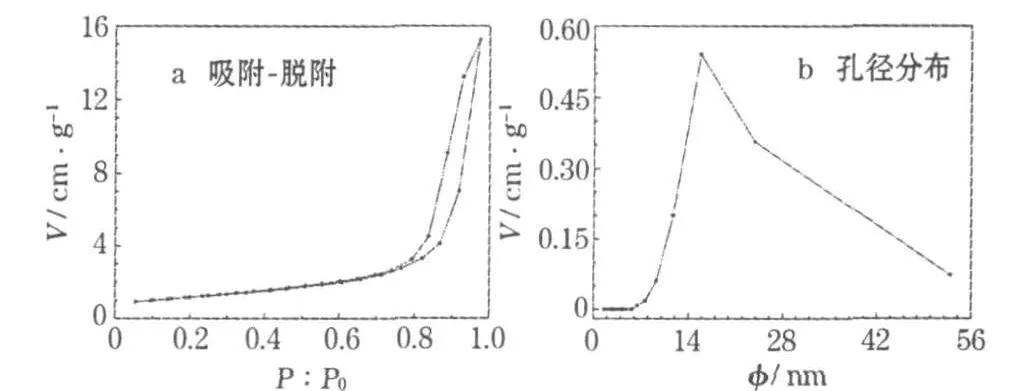
圖3 SnO2的氮氣吸附-脫附等溫線和孔徑分布曲線Fig.3 Nitrogen adsorption and desorption isotherms and poresize distribution curve of SnO2
從圖3可進一步確定球體的多孔結構。球體的比表面積為36.41 m2/g,平均BJH孔徑和孔容分別為15.8 nm和0.211 cm3/g。吸附等溫線存在吸附滯后,呈現Ⅳ型等溫線的特征,表明球體為中孔結構,孔徑范圍約為10~45 nm。
2.2 電化學性能分析
Li/SnO2電池和SnO2材料的0.1 C充放電性能見圖 4。
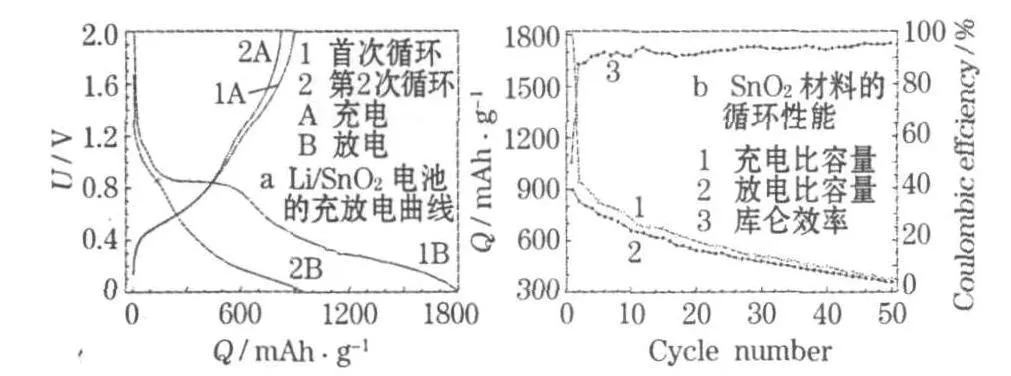
圖4 0.1 C時Li/SnO2電池的充放電曲線和SnO2材料的循環性能Fig.4 Charge-discharge curves of Li/SnO2battery and cycle performance of SnO2material at 0.1 C
從圖4a可知:Li/SnO2電池的首次放電電壓迅速下降,在0.85 V左右相應出現一個放電特征平臺。此平臺在第2次循環時不再出現,對應Li與SnO2中的O形成Li2O和電解質分解在電極表面形成固體電解質相界面(SEI)膜消耗的Li;0.45 V處的平臺是Sn實質嵌鋰的特征平臺,但不明顯。I.A.Courtney等[7]認為:在放電過程中,錫與鋰形成了多種合金,是可逆容量的主要來源,正是這一平臺使SnO2成為高效的儲鋰材料。在首次充電曲線上,0.45 V左右有一個平臺,對應去合金化,即Li+從電極材料中脫出的過程。生成的Sn分散在Li2O中,Li2O為Sn顆粒的均勻分散提供了良好的矩陣,可部分緩沖合金形成和分解時的體積變化。此平臺的長短對應脫鋰的多少。在1.3 V左右的一個小平臺,由Li2O中少量 Li+脫出造成,說明Li2O有部分可逆[8]。
從圖4b可知:材料的首次充電比容量達1 796.7 mAh/g,原因是SnO2的還原和SEI膜的形成消耗Li+,首次放電比容量為896.1 mAh/g,超過理論值 782 mAh/g。球體的中孔結構和一些晶格缺陷也能儲存一些Li+,但不一定會脫出,造成首次庫侖效率較低(49.87%)。從第4次循環開始,庫侖效率保持在90%以上,說明材料的可逆性良好;第50次循環時,材料的放電比容量為 356.3 mAh/g,容量保持率為39.76%。SnO2納米顆粒本身的比表面積較大,三維球體的多孔結構及球體之間的獨立結構也可提供間隙空間,使Li+有效地嵌脫,并在一定程度上緩解嵌脫鋰時的體積變化,優化SnO2顆粒與導電劑的接觸,形成更有效的導電網絡,增大SnO2與電解液的接觸面積,縮短Li+的擴散路徑。導體SnO2還原成金屬Sn及形成Li-Sn合金,也增大了電子傳導性。
SnO2材料在不同倍率下的循環性能見圖5。
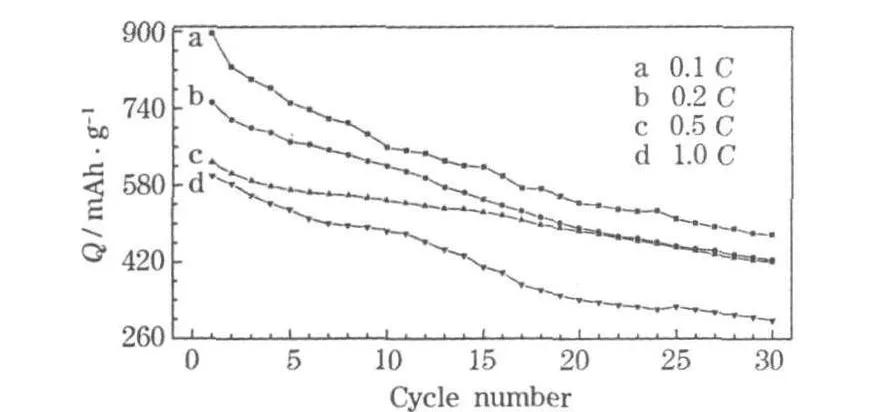
圖5 SnO2材料在不同倍率下的循環性能Fig.5 Cycle performance of SnO2 material at differentrates
從圖5可知:材料在較大的充放電電流時,仍有較高的比容量和較穩定的循環性能,原因是SnO2的多孔結構決定了材料具有較好的倍率性能。當電流為0.5 C時,經過30次循環,容量保持率為66.98%;當電流為1.0 C時,經過30次循環,容量保持率為49.72%。電流越小,電化學反應越接近于平衡條件,充放電比容量越大,但循環性能并未得到改善,原因是合金化-去合金化過程中,嵌入或脫出電極的Li+越多,產生的膨脹-壓縮應力就越增大,造成極片的粉化,容量保持率相應降低。電流較大時,液相中Li+擴散速度很快,大量的 Li+快速到達極片表面,電極中Li+由外向內的擴散傳輸速度遠小于表面Li+的供給速度,造成電極反應還未平衡時,兩極之間的電勢已經平衡,導致充放電比容量降低。
3 結論
采用模板法結合溶劑熱法,利用葡萄糖脫水碳化和SnCl4水解,制備由零維球形SnO2納米顆粒集合形成的幾何結構完整的三維多孔球體。材料的比表面積為36.41 m2/g,平均BJH孔徑和孔容分別為15.8 nm和0.211 cm3/g。制備方法工藝簡單,產物形狀可控、顆粒尺寸均勻。多孔球體結構使材料具有優良的可逆性和倍率性能,0.1 C首次充、放電比容量分別為1 796.7 mAh/g和896.1 mAh/g,超過理論比容量,從第4次循環開始,庫侖效率均保持在90%以上;電流為0.5 C時,第30次循環的容量保持率為66.98%。
[1]QI Zhi(齊智),WU Feng(吳鋒).SnO2超細粉的制備與嵌鋰性能[J].Battery Bimonthly(電池),2005,35(4):268-269.
[2]Zhao N H,Yang L C,Zhang P,et al.Polycrystalline SnO2nanowires coated with amorphous carbon nanotube as anode material for lithium ion batteries[J].Mater Lett,2010,64(8):972-975.
[3]Liu J P,Li Y Y,Huang X T,et al.Direct growth of SnO2nanorod array electrodes for lithium-ion batteries[J].J Mater Chem,2009,19(13):1 859-1 864.
[4]Wang Y,Zeng H C,Lee J Y.Highly reversible lithium storage in porous SnO2nanotubes with coaxially grown carbon nanotube overlayers[J].Adv Mater,2006,18(5):645-649.
[5]Zhang Y L,Liu Y,Liu M L.Nanostructured columnar tin oxide thin film electrode for lithium ion batteries[J].Chem Mater,2006,18(19):4 643-4 646.
[6]WANG Bing(王冰).一維SnO2納米材料的制備、結構及應用研究[D].Guangzhou(廣州):Sun Yat-Sen University(中山大學),2007.
[7]Courtney I A,Dahn J R.Electrochemical and in situ X-ray diffraction studies of the reaction of lithium with tin oxide composites[J].J Electrochem Soc,1997,144(6):2 045-2 052.
[8]Xue M Z,Fu Z W.The reinvestigation on electrochemical reaction mechanism of stannic oxide thin film with lithium[J].Electrochem Solid-State Lett,2006,9(10):A468-A470.

