一種新型IIa類細菌素的克隆表達和活性鑒定
謝燕,陳海琴,張秋香,田豐偉,陳永泉,張灝,陳衛
江南大學食品學院,無錫 214122
一種新型IIa類細菌素的克隆表達和活性鑒定
謝燕,陳海琴,張秋香,田豐偉,陳永泉,張灝,陳衛
江南大學食品學院,無錫 214122
NB-C1為一種潛在的IIa類細菌素基因,為實現其在大腸桿菌中的高效可溶表達,首先構建了NB-C1蛋白與綠色熒光蛋白 (GFP) 的融合表達載體 pIVEX 2.4d-GFP-NB-C1,然后將構建的表達載體轉化大腸桿菌 BL21(DE3) pLysS,經誘導表達后,重組蛋白GFP-NB-C1以可溶的形式存在于細胞內。經Ni-NTA親和層析柱分離純化后,重組融合蛋白的純度大于95%,產量達36.1 mg/L。抑菌試驗表明,純化后的重組蛋白對單核細胞增生李斯特氏菌具有明顯的抑制作用。
IIa類細菌素,融合表達,蛋白質純化,活性鑒定
采用傳統的菌種篩選法尋找新的細菌素,存在乳酸菌出發菌株細菌素產量低,分離純化困難等問題[3]。我國有豐富的乳酸菌資源,隨著乳酸菌基因組序列報道的日趨增多,利用基因搜索工具尋找新的細菌素已成為一條快速有效的途徑。根據細菌素氨基酸的保守序列及其結構基因上下游的特征編碼基因,如調節基因、轉運基因、免疫基因等的特征,利用生物信息學工具設計 IIa類細菌素基因的搜索比對腳本,在已測序乳酸菌基因組數據庫中搜索潛在的IIa類細菌素基因,然后通過比對分析,排除錯誤基因和已報道的乳酸菌細菌素基因,從而確定新的細菌素基因。目前已從乳酸菌基因組中鑒定出多種細菌素基因[4-6]。Diep等[7]從一株戊糖片球菌中得到一條新的類片球菌素基因,在沙克乳桿菌中表達并獲得較高的產量和活性。國外已有關于細菌素異源表達的研究[8-10],其重組表達宿主以大腸桿菌居多,其中不乏理想的研究成果[11-14]。利用基因搜索工具篩選細菌素基因并結合基因工程重組表達,定能加強新型高效乳酸菌細菌素的開發和應用,這對食品安全和保藏具有重要意義。
IIa類細菌素通常含有37~48個氨基酸殘基,并且擁有相似的序列,如表1所示,N端具有共同的YGNGVXaaC保守序列 (Xaa為出現頻率高的殘基),保守區含有2個半胱氨酸殘基,可形成1個二硫鍵,研究表明此二硫鍵對抑制李斯特氏菌是必需的[15];序列的 C端只有 34%~80.5%的相似性。本研究中的NB-C1基因通過生物信息學方法從乳酸菌基因組數據庫中篩選得到,與IIa類乳酸菌細菌素同源性較高,人工合成其成熟肽的全基因序列,并命名為NB-C1 (GenBank Accession No. HQ 015716)。NB-C1的成熟肽序列含有42個氨基酸殘基,序列為KYYGNGVHCGKKTCYVDWGQATASIGKIIVNGW TQHGPWAHR。其N端保守區序列為YGNGVHC,且N端含有2個半胱氨酸,可形成1個二硫鍵,C端序列則與已知的 IIa類細菌素同源性較差。根據NB-C1氨基酸組成的特點,可推斷其很可能為一種潛在的新型 IIa類細菌素基因。在抗菌肽重組表達研究中,為避免其對宿主的毒性作用,多采用融合表達方式[11-14,16-17]。我們曾將 NB-C1基因進行直接表達,但未能檢測到目的蛋白及其活性,推測該細菌素對宿主可能具有一定的毒性作用,另外目的蛋白為約5 kDa的小肽,易被內源蛋白酶降解[18-19],穩定性較差,故本文嘗試融合表達。本文以綠色熒光蛋白 (GFP) 作為融合載體蛋白,在大腸桿菌中進行融合表達并獲得足夠的活性重組蛋白GFP-NB-C1。這為 NB-C1生物學性質的進一步研究提供了物質基礎,以及為新型 IIa類細菌素的發掘和研究提供了一種新的路徑和方法。

表1 Ⅱa類乳酸菌細菌素的氨基酸序列分析[2]Table 1 Sequence alignment of class Ⅱ a bacteriocins[2]
1 材料與方法
1.1 菌株和質粒
T載體 pGM-T購自天根生化有限科技 (北京)公司;表達載體pIVEX 2.4d購自Roche公司;質粒pEGFP-C1由本實驗室提供;表達菌株 Escherichia coli BL21(DE3) pLysS購自Stratagene公司;抑菌試驗的指示菌單核細胞增生李斯特氏菌 Listeria monocytogenes,由江南大學食品學院姚衛蓉實驗室提供。
1.2 主要試劑和儀器
DNA 聚合酶和 T4 DNA連接酶購自寶生物工程 (大連) 有限公司;限制性內切酶購自NEB公司;GeneRuler DNA Leader Mix Maker購自Fermentas公司;低分子量標準蛋白Marker購自國藥集團化學試劑有限公司;三 (羥甲基) 氨基甲烷 (Tris)、N-[三(羥甲基) 甲基]甘氨酸 (Tricine)、質粒抽提試劑盒、氨芐青霉素以及氯霉素均購自上海生工生物工程有限公司;膠回收試劑盒購自北京索來寶科技有限公司;PCR儀購自Gene Technologies有限公司;電泳儀和凝膠成像系統購自BIO-RAD公司;引物由上海博尚公司合成;DNA測序由北京華大基因有限公司完成。
1.3 方法
常規分子生物學操作參照《分子克隆手冊》[20]進行。
1.3.1 NB-C1的全基因合成
根據NB-C1基因序列設計寡核苷酸鏈,合成多條具有互補序列的引物 (表 2),然后通過重疊延伸PCR 技術反應合成其全基因序列 (GenBank Accession No. HQ 015716)。將NB-C1的成熟片段與pGM-T載體連接,構建克隆載體pGMT-NB-C1。

表2 NB-C1全基因合成的寡核苷酸片段引物Table 2 Primers of NB-C1 oligonucleotides for gene synthesis
1.3.2 融合表達載體的構建
根據pIVEX 2.4d質粒多克隆區的酶切位點進行引物設計,GFP和NB-C1的融合順序為GFP-NB-C1,其N端為質粒自帶的6×His標簽編碼序列。
以測序正確的pGMT-NB-C1為模板,利用表3中引物P1和P2進行PCR擴增,產物回收、純化后進行 NcoⅠ/XmaⅠ雙酶切,酶切產物連接至經同樣酶切的pIVEX 2.4d載體,構建重組表達載體pIVEX 2.4d-NB-C1。同樣,以pEGFP-C1為模板,利用P3和P4引物擴增GFP片段,經過NotⅠ/NcoⅠ酶切和連接反應,構建重組載體pIVEX 2.4d-GFP-NB-C1,轉化E. coli DH5α感受態細胞,篩選陽性克隆,并進行PCR鑒定和酶切鑒定。將基因測序正確的重組質粒pIVEX 2.4d-GFP-NB-C1轉化表達宿主E. coli BL21(DE3)pLysS,構建重組菌 BL21(DE3)pLysS/ pIVEX2.4d-GFP-NB-C1。

表3 NB-C1基因PCR擴增引物列表Table 3 PCR primers of NB-C1
1.3.3 重組蛋白的誘導表達和SDS-PAGE檢測
將重組菌株 BL21(DE3)pLysS/pIVEX2.4d-GFPNB-C1劃線培養,挑取單菌落接種于 LB (Luria-Bertani) 培養基中 (含100 mg/L氨芐青霉素和34 mg/L氯霉素),37 ℃振蕩培養至OD600為0.6,加入IPTG至終濃度0.8 mmol/L,20 ℃、200 r/min誘導培養20 h。離心收集菌體并重懸于PBS緩沖液中 (0.1 mol/L,pH 8.0),在冰浴下進行超聲破碎,離心得上清和沉淀。將全細胞、上清和沉淀樣品進行SDS-PAGE檢測,同時以質粒pIVEX2.4d轉化的BL21(DE3)pLysS/pIVEX2.4d誘導表達產物作為空白對照。
1.3.4 融合蛋白GFP-NB-C1的純化及鑒定
收集破碎上清液,通過0.45 μm濾膜過濾后,上樣于5 mL的Ni-NTA親和層析凝膠柱,首先采用10倍柱體積的清洗緩沖液 (20 mmol/L PBS,500 mmol/L NaCl,20 mmol/L咪唑,pH 8.0) 洗滌凝膠柱,再用洗脫緩沖液 (20 mmol/L PBS,500 mmol/L NaCl,150~300 mmol/L咪唑,pH 8.0) 梯度洗脫并收集,樣品進行SDS-PAGE檢測和Bradford法測定蛋白質濃度。
1.3.5 融合蛋白GFP-NB-C1的抑菌活性測定
采用固體平板擴散法測定融合蛋白GFP-NB-C1對單核細胞增生李斯特氏菌的抑菌活性。向培養皿中倒入約15 mL含有1.5%瓊脂的FB (Fraser Broth Base) 培養基 (加有 1% 50 mg/mL檸檬酸鐵銨溶液),將在FB液體培養基生長至對數中期的敏感菌按1%轉接至5 mL 0.5%瓊脂溶液中,迅速混勻,均勻鋪在已凝固的平板培養基上,制備雙層固體培養基,待凝固后小心放置5個牛津杯,然后分別加入100 μL PBS (pH 8.0) (陰性對照),以及不同濃度的GFP-NB-C1 (40、60、80、100 mg/L) 純化樣品。培養皿于4 ℃放置6 h后轉移至37 ℃培養箱,培養12 h后觀察抑菌圈情況。
2 結果
2.1 融合表達載體的構建和表達
將重組質粒 pIVEX 2.4d-GFP-NB-C1分別用NcoⅠ/XmaⅠ和 NotⅠ/NcoⅠ雙酶切鑒定,得到150 bp和750 bp的目的條帶,與預期結果一致 (圖1)。DNA測序結果證明融合目標片段序列正確。重組菌BL21(DE3) pLysS/pIVEX2.4d-GFP-NB-C1進行IPTG誘導表達,表達產物進行SDS-PAGE分析,結果表明,在約32 kDa處有一條明顯的目標蛋白條帶 (圖 2)。SDS-PAGE分析細胞破碎的上清和沉淀,表明 GFP-NB-C1融合蛋白主要以胞內可溶形式存在。
2.2 重組融合蛋白GFP-NB-C1的純化和鑒定
SDS-PAGE分析蛋白質純化樣品,結果顯示,目的條帶大小為約32 kDa (圖3)。Quantity one軟件分析表明其純度大于 95%。以 BSA為標準樣品,Bradford法測定蛋白質濃度,結果表明經過一步純化后,最終可獲得36.1 mg/L純化的GFP-NB-C1融合蛋白。

圖1 質粒pIVEX 2.4d-GFP-NB-C1圖示 (A) 及酶切鑒定電泳圖 (B)Fig. 1 Schematic map of the recombinant plasmid pIVEX 2.4d-GFP-NB-C1 (A) and restriction analysis of the recombinant plasmid pIVEX 2.4d-GFP-NB-C1 (B). M: DNA marker; 1: pIVEX 2.4d-GFP-NB-C1 digested with Nco I/Xma I; 2: pIVEX 2.4d-GFP-NB-C1 digested with Not I/Nco I.

圖2 GFP-NB-C1融合蛋白表達產物的SDS-PAGE分析Fig. 2 SDS-PAGE analysis of the fusion protein GFP-NB-C1. M: protein marker; 1: negative control; 2: whole proteins of cell lysate; 3: soluble fraction of cell lysate; 4: insoluble fraction of cell lysate.
2.3 重組融合蛋白GFP-NB-C1的活性鑒定
使用固體平板擴散法測定融合蛋白GFP-NB-C1對單核細胞增生李斯特氏菌的抑菌活性,結果如圖4A所示,培養皿上出現明顯的抑菌圈,表明GFP-NB-C1對敏感菌L. monocytogenes具有明顯的抑制作用,并且抑菌圈直徑與融合蛋白濃度具有一定的線性關系,如圖4B。

圖3 純化后融合蛋白的SDS-PAGE分析Fig. 3 SDS-PAGE analysis of the purified GFP-NB-C1 fusion protein. M: protein marker; 1: purified GFP-NB-C1.
3 討論
近年來雖然諸多學者通過融合方式表達了抗菌肽,但由于大多以包涵體形式存在[13,21],不利于后續的活性檢測等工作。本文以 GFP為融合載體蛋白,在大腸桿菌中實現了重組蛋白的高效可溶表達,并且GFP的使用有助于對重組蛋白表達和純化過程的實時監測。為了使融合蛋白以可溶的形式表達,本研究對表達條件進行了優化,最終確定表達條件為誘導前OD600為0.6,IPTG終濃度為0.8 mmol/L,20 ℃低溫誘導20 h,目的蛋白以胞內可溶形式表達,避免了包涵體形成。
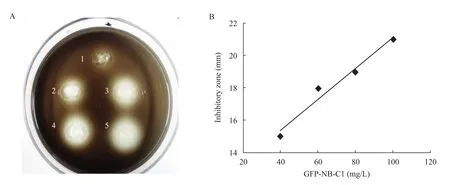
圖4 不同濃度GFP-NB-C1融合蛋白對單核細胞增生李斯特菌的抑菌圈直徑 (A) 及GFP-NB-C1濃度與抑菌圈直徑曲線 (B)Fig. 4 Inhibitory zone evaluation of GFP-NB-C1 fusion protein at different concentration on the growth of L. monocytogenes (A) and the concentration-inhibitory zone curve (B). 1: negative control; 2: 40 mg/L GFP-NB-C1; 3: 60 mg/L GFP-NB-C1; 4: 80 mg/L GFP-NB-C1; 5: 100 mg/L GFP-NB-C1.
表達載體pIVEX 2.4d具有6個His組成的標簽,所以重組蛋白可以通過Ni-NTA親和層析凝膠柱純化。為得到較純的目的蛋白,洗脫時采用150~300 mmol/L咪唑梯度洗脫,當洗脫液中咪唑濃度為250 mmol/L和300 mmol/L時,目的蛋白被洗脫下,SDS-PAGE分析顯示為單一條帶。本研究中純化條件溫和,步驟簡單,這均有利于蛋白活性的保持,并大大簡化了純化過程和降低了純化難度,純化后樣品可直接用于活性檢測。圖 4表明目的蛋白對指示菌形成了明顯的抑菌圈,而在其邊界外還具有一層界限模糊的外圈,這可能是因為少量抑菌物質向平皿內部擴散后對邊界周圍的菌具有一定的抑制作用而形成,抑菌圈直徑按照具有清晰邊界的內圈進行計算。抑菌實驗表明融合蛋白GFP-NB-C1對單核細胞增生李斯特氏菌具有較好的抑菌活性,說明經GFP融合后NB-C1保留了生物活性。
本文成功構建并表達了可溶性融合蛋白GFP-NB-C1,經一步純化,可獲得36.1 mg/L純度大于95%的融合蛋白,為其生物學性質進行進一步的探討奠定了基礎。另外本研究建立了一條 IIa類細菌素從基因搜索、重組表達到獲得活性蛋白的通路,這對新型細菌素的挖掘和研究提供了新的思路和借鑒。
[1] Jack RW, Tagg JR, Ray B. Bacteriocins of gram-positive bacteria. Microbiol Rev, 1995, 59(2): 171?200.
[2] Ennahar S, Sashihara T, Sonomoto K, et a1. Class IIa bacteriocins: biosynthesis, structure and activity. FEMS Microbiol Rev, 2000, 24(1): 85?106.
[3] Muriana PM, Klaenhammer TR. Purification and partial characterization of lactacin F, a bacteriocin produced by Lacobacillus acidophilus 11088. Appl Environ Microbiol, 1991, 57(1): 114?121.
[4] Hoskins J, Alborn Jr WE, Arnold J, et a1. Genome of the baeterium Streptococcus pneumoniaestrain R6. J Bacteriol, 2001, 183(19): 5709?5717.
[5] Saizieu AD, Gardes C, Flint N, et a1. Mieroarray-based identification of a novel Streptococcus pneumoniaeregulon controlled by an autoinduced peptide. Bacteriol, 2000, 182(17): 4696?4703.
[6] Nes IF, Johnsborg O. Exploration of antimicrobial potential in LAB by genomics. Curr Opin Biotechnol, 2004, 15(2): 100?104.
[7] Diep DB, Godager LD, Brede D, et al. Data mining and characterization of a novel pediocin-like bacteriocin system from the genome of Pediococcus pentosaceus ATCC 25745. Microbiology, 2006, 152: 1649?1659.
[8] Axelsson L, Katle T, Mslett MB, et al. A system for heterologous expression of bacteriocins in Lactobacillus sake. FEMS Microbiol Lett, 1998, l68(1): 137?143.
[9] Biet F, Berjeaud JM, Worobo RW, et a1. Heterologous expression of the baeteriocin mesentericin Y105 using the dedicated transport system and the general secretion pathway. Microbiology, 1998, 144(10): 2845?2854.
[10] Kawai Y, Arakawa K, Itoh A, et a1. Heterologous expression of gasserlcin A, a bacteriocin produced by Lactobacillus gasseri LA39. Anim Sci J, 2003, 74(1): 45?51.
[11] Moon GS, Pyun YR, Kim WJ. Expression and purification of a fusion-typed pediocin PA-1 in Escherichia coli and recovery of biologically active pediocin PA-1. Int J Food Microbiol, 2006, 108(1): 136?140.
[12] Beaulieu L, Tolkatchev D, Jetté JF, et a1. Production of active pediocin PA-1 in Escherichia coli using a thioredoxin gene fusion expression approach: cloning, expression, purification, and characterization. Can J Microbiol, 2007, 53(11): 1246?1258.
[13] Lu HR, Li GD, Wu HY, et al. Fusion expression of antimicrobial peptide GK1 in Escherichia coli. Chin J Biotech, 2008, 24(1): 21?26.陸海榮, 李國棟, 吳宏宇, 等. 抗菌肽GK1在大腸桿菌中的融合表達. 生物工程學報, 2008, 24(1): 21?26.
[14] Chen HQ, Fan LM, Xu ZN, et al. Efficient production of soluble human beta-defensin-3-4 fusion proteins in Escherichia coli cell-free system. Process Biochem, 2007, 42(3): 423?428.
[15] Drider D, Fimland G, Héchard Y, et al. The continuing story of class IIa bacteriocins. Microbiol Mol Biol Rev, 2006, 70(2): 564?582.
[16] Klocke M, Mundt K, Idler F, et a1. Heterologous expression of enterocin A, a bacteriocin from Enterococcus faecium, fused to a cellulose-binding domain in Escherichia coli results in a functional protein with inhibitory activity against Listeria. Appl Microbiol Biot, 2005, 67(4): 532?538.
[17] Chen HQ, Xu ZN, Xu NZ, et a1. Efficient production of a soluble fusion protein containing human beta-defensin-2 in E. coli cell-free system. J Biotechnol, 2005, 115(3): 307?315.
[18] Valore EV, Ganz T. Laboratory production of antimicrobial peptides in native conformation. Methods Mol Biol, 1997(78): 115?131.
[19] Piers KL, Brown MH, Hancock REW. Recombinant DNA procedures for producing small antimicrobial cationic peptides in bacteria. Gene, 1993, 134(1): 7?13.
[20] Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. 3rd ed. Beijing: Cold Spring Harbor Laboratory Press, 2001.
[21] Barrell PJ, Liew OW, Conner AJ. Expressing an antibacterial protein in bacteria for raising antibodies. Protein Expr Purif, 2004, 33(1): 153?159.
Expression and characterization of a new class IIa bacteriocin
Yan Xie, Haiqin Chen, Qiuxiang Zhang, Fengwei Tian, Yongquan Chen, Hao Zhang, and Wei Chen
School of Food Science and Technology, Jiangnan University, Wuxi 214122, China
NB-C1 gene is a potential class IIa bacteriocin gene. To obtain its soluble expression, NB-C1 was fused with the green fluorescent protein (GFP) gene and a recombinant expression vector pIVEX 2.4d-GFP-NB-C1 was constructed, which was transformed into Escherichia coli BL21(DE3) pLysS. The expressed fusion protein GFP-NB-C1 was purified by Ni-NTA affinity chromatography and the bioactivity was examined using Listeria monocytogenes as the indicator bacteria. The results showed that the expressed fusion protein GFP-NB-C1 was soluble and the final concentration of the purified fusion protein was 36.1 mg/L E. coli culture and had the purity above 95%. The antimicrobial assay of GFP-NB-C1 was analyzed and showed its high activity against Listeria monocytogenes.
class IIa bacteriocin, fusion expression, protein purification, activity identification
細菌素 (Bacteriocin) 是某些細菌產生的具有抗菌活性的多肽、蛋白質或蛋白質復合物,一般只對親緣關系較近的細菌有毒害作用。產生菌對其產生的細菌素具自身免疫性[1]。很多微生物均可產生細菌素,其中乳酸菌細菌素研究得最為深入。IIa類細菌素是乳酸菌細菌素的一個亞類,為抗李斯特氏菌的多肽。近年來世界范圍內發生多起由單核細胞增生李斯特氏菌引起的中毒事件,具有很大的危害性,預防和控制食品中的李斯特氏菌則成為了人們關注的熱點,而IIa類細菌素對李斯特氏菌具有特異的抗菌活性,并且還具有安全性、酶穩定性、熱穩定性、免疫性等優點[2],因此在食品領域具有很好的應用前景。但目前僅有幾個細菌素在食品和生物藥物領域中得到應用,因此從乳酸菌天然資源中挖掘更多高效的細菌素已成為研究熱點。
September 6, 2010; Accepted: January 26, 2011
Supported by: National Natural Science Foundation of China (Nos. 20706023, 20836003).
Wei Chen. Tel/Fax: +86-510-85912155; E-mail: weichen@jiangnan.edu.cn
國家自然科學基金 (Nos. 20706023, 20836003) 資助。

