重組枯草芽胞桿菌不對稱還原產d-偽麻黃堿
彭艷紅,張梁,丁重陽,王正祥,石貴陽
1 江南大學 工業生物技術教育部重點實驗室,無錫 214122
2 江南大學生物工程學院 生物資源與生物能源研究中心,無錫 214122
麻黃堿 (Ephedrine),化學名為1-苯基-2-甲胺基丙醇,是一種從天然植物麻黃草中分離而得到的芳香族氨基醇衍生物,其立體異構體 l-麻黃堿和 d-偽麻黃堿,分別主要用作支氣管擴張劑和解充血劑,具有較強的藥理作用,廣泛應用于臨床醫療中[1-3]。工業生產中,麻黃堿主要來源于麻黃植物直接提取和化學合成,但這兩種方法分別由于存在原料來源有限、生產成本高和異構體分離困難、環境污染等問題而限制了其發展[4]。利用生物轉化法制備光學純的手性化合物具有反應條件溫和,產物單一,立體選擇性、區域選擇性和化學選擇性較高,并能完成一些化學合成難以進行的反應等優點,是大規模生產手性化合物的理想途徑之一,具有巨大發展潛力[5]。
本研究室前期成功篩選得到一株能夠利用 1-苯基-2-甲氨基丙酮 (1-phenyl-1-keto-2-methylamino propanone,簡稱MAK) 為底物專一性轉化生成d-偽麻黃堿的菌株摩氏摩根菌 Morganella morganii CMCC(B)49208[1],從中分離純化出調控此生物轉化過程的羰基還原酶 (MLDH),并利用基因工程手段使其在大腸桿菌Escherichia coli中進行了高效的表達。但是由于羰基還原酶在催化生物轉化反應時需要一定量的輔酶作為電子傳遞體,該酶在轉化MAK為d-偽麻黃堿的過程中需要輔酶NADH來提供還原力[6-7],如若通過外加輔酶提供則成本會大大增加,這極大地制約了其在工業上的應用。而通過大腸桿菌在同一質粒上共表達羰基還原酶基因mldh和葡萄糖脫氫酶基因gdh,由于本身MLDH酶活力不高且再生的輔酶不足等原因,導致最終產物產量并不高[8]。
枯草芽胞桿菌Bacillus subtilis是目前研究較為詳盡的外源基因表達宿主,其葡萄糖脫氫酶 (Glucose dehydrogenase,GDH) 可以氧化葡萄糖生成葡萄糖酸同時生成還原型的輔酶NADH (NADPH)[9-10]。利用酶耦聯法可以解決生物轉化制備麻黃堿的過程中輔酶的再生問題。目前,國內外對利用 B. subtilis生物轉化生產d-偽麻黃堿的研究很少,未見相關報道。本研究通過構建枯草芽胞桿菌游離表達質粒pHY300plk-PrpsD-mldh-TrpsD 轉化入 B. subtilis Wb600 (蛋白酶缺陷型菌株) 中使得羰基還原酶能夠在枯草芽胞桿菌中表達并通過細胞內的GDH完成輔酶的再生,而避免外源性的加入,同時對重組菌專一性轉化產d-偽麻黃堿進行了初步探討。
1 材料與方法
1.1 材料
1.1.1 菌株和質粒
大腸桿菌E. coli JM109、B. subtilis Wb600、大腸-枯草桿菌穿梭載體 pHY300plk由江南大學工業微生物資源和信息中心 (CICIM-CU) 提供;pET28a-mldh 由本研究室構建并保存;質粒pHY300plk-PrpsD-TrpsD、pHY300plk-PrpsD-mldh-TrpsD及菌株B. subtilis Wb600 (pHY300plk-PrpsD-mldh-TrpsD) 為本研究中構建。
1.1.2 培養基
LB培養基:蛋白胨10 g/L,酵母提取物5 g/L,氯化鈉10 g/L,pH 7.0~7.2;制備固體培養基時另加入1.5%瓊脂粉;121 ℃滅菌20 min。用于大腸桿菌和枯草芽胞桿菌的培養,必要時,使用前加入氨芐青霉素 (Amp) 至終濃度100 mg/L用于重組大腸桿菌的篩選,加入四環素 (Tet) 至終濃度15 mg/L用于重組枯草芽胞桿菌的篩選。
1.1.3 工具酶和試劑
溶菌酶、核糖核酸酶、蛋白酶K、Taq DNA聚合酶、pfu DNA聚合酶、dNTPs、T4 DNA連接酶、NADH、限制性內切酶 (XbaⅠ、KpnⅠ、BamHⅠ等)、堿性磷酸酶 (CIAP) 均購于上海生工生物工程技術服務有限公司;PCR產物純化試劑盒、質粒 DNA小量制備試劑盒、DNA Marker λ PstⅠ購于博大泰克;膠回收試劑盒購于碧云天生物公司;四環素鹽酸鹽 (Tetracycline HCl) 購于北京拜爾迪生物技術有限公司;l-麻黃堿 (E) 和 d-偽麻黃堿 (PE) 化學對照品購于中國藥品生物制品鑒定所;1-苯基-2-甲氨基丙酮 (MAK) 為本研究室合成;其他試劑藥品皆為國產或進口的分析純和生化試劑。
1.2 方法
1.2.1 B. subtilis Wb600染色體DNA的提取
提取方法見文獻[11-12],略有修改。
1.2.2 常規分子生物學基因操作
DNA片段膠回收、PCR產物純化用相應的試劑盒進行。質粒DNA提取、DNA的酶切、連接、大腸桿菌感受態細胞的制備和轉化等常規分子操作參見文獻[11-12]。
1.2.3 基因的PCR擴增
根據GenBank上的枯草芽胞桿菌168菌株 (登錄號:NC_000964.3) rpsD基因的啟動子和終止子的基因序列,設計引物 PrpsD_F和 PrpsD_R,TrpsD_F和 TrpsD_R,引物序列見表1,由上海生工生物工程有限公司合成。

表1 文中所用引物及其序列Table 1 Primers and oligonucleotides used in this study
PCR反應條件:95 ℃預變性5 min;94 ℃變性1 min,60 ℃退火1 min,72 ℃延伸1 min,30個循環;72 ℃延伸10 min,冷卻至4 ℃,結束反應。PCR產物經純化后進行瓊脂糖凝膠電泳鑒定。
1.2.4 載體pHY300plk-PrpsD-TrpsD的構建
BamHⅠ酶切質粒 pHY300plk,純化后在 pfu DNA聚合酶作用下72 ℃延伸10 min,補平其上的BamHⅠ位點,得到載體pHY300plk-BamHⅠ(-)。SalⅠ、BamHⅠ酶切PrpsD片段,BamHⅠ、BglⅡ酶切 TrpsD 片段后與經 SalⅠ、BglⅡ酶切的pHY300plk-BamHⅠ(-) 質粒連接轉化感受態細胞E. coli JM109,利用氨芐青霉素抗性篩選出重組子酶切驗證。
1.2.5 游離表達載體pHY300plk-PrpsD-mldh-TrpsD的構建
BamHⅠ酶切質粒pET28a-mldh后回收mldh片段,與經 BamHⅠ酶切的 pHY300plk-PrpsD-TrpsD連接轉化E. coli JM109,利用Amp抗性篩選出重組子酶切驗證。同時,以陽性質粒為模板PCR擴增后檢測。另測定PrpsD-mldh-TrpsD基因序列,以確保PCR擴增序列的準確性,序列測定由北京六合華大基因科技股份有限公司完成。
1.2.6 重組菌B. subtilis Wb600(pHY300plk-PrpsD-mldh-TrpsD) 的構建
提取質粒 pHY300plk-PrpsD-mldh-TrpsD,參考文獻[13]所述方法制備枯草桿菌化學感受態并轉化B. subtilis Wb600,利用Tet (15 mg/L) 抗性篩選重組子,提取陽性轉化子質粒,以之前構建好的質粒pHY300plk-PrpsD-mldh-TrpsD為對照,分別酶切后進行瓊脂糖凝膠電泳檢測。
1.2.7 細胞裂解液的制備
挑取陽性重組枯草芽胞桿菌轉化子單菌落,接入含有Tet (15 mg/L) 的LB液體培養基,37 ℃、200 r/min培養12 h。次日,按接入培養基體積3%的接種量轉接至含有Tet (15 mg/L) 的LB液體培養基,37 ℃、200 r/min培養12 h。離心收集菌體,用磷酸緩沖液 (0.2 mol/L KH2PO4-Na2HPO4緩沖液(pH 7.5),以下出現磷酸緩沖液如未加說明均指該磷酸鈉鉀緩沖液) 洗滌 1~2次,離心后再用適量的預冷的磷酸緩沖液重懸菌體。超聲波破碎10 min (工作1 s停4 s),保持菌液始終處于低溫 (0 ℃~4 ℃)。破壁后高速離心,上清液即為細胞裂解物,用于SDS-PAGE和生物轉化反應檢測。
1.2.8 重組菌B. subtilis Wb600(pHY300plk-PrpsD-mldh-TrpsD) 的鑒定
挑取經 1.2.6所示方法酶切驗證的陽性重組枯草芽胞桿菌轉化子接種于LB液體培養基,按1.2.7的方法制備細胞裂解液,SDS-PAGE檢測,電泳的方法和操作見文獻[14]。同時,取重組菌菌體破碎液進行生物轉化反應。反應體系為:50 μg MAK,50 μmol葡萄糖,1 μmol NADH和適量酶液共1 mL,30 ℃轉化24 h。10 000 r/min離心10 min后,取上清液用于高效液相色譜法 (HPLC) 和超高效液相色譜-質譜聯用法 (UPLC-MS) 檢測。
高效液相色譜法 (HPLC)[6]檢測條件:Hanbon Lichrospher C18柱;檢測波長210 nm;流速1 mL/min;柱溫40 ℃。流動相為:甲醇∶0.02 mol/L KH2PO4∶乙酸∶三乙胺=4 ∶ 96 ∶ 0.2 ∶ 0.13 (V:V:V:V)。超高效液相色譜-質譜聯用法 (UPLC- MS) 檢測條件:(A)色譜條件 色譜儀:Waters ACQUITY UPLC;檢測器:Waters ACQUITY PDA;分析柱:ACQUITY UPLC BEH HILIC (2.1 mm×100 mm,1.7 μm);流動相A:乙腈;流動相B:20 mmol/L醋酸銨水溶液;檢測波長:200~600 nm;柱溫:30 ℃;流速:0.30 mL/min;總分析時間:15 min;進樣體積:1.0 μL。(B) 質譜條件 質譜系統:Waters SYNAPT MS檢測儀;軟件:Waters Masslynx V4.1質譜工作站;離子源:ESI電離源;電離模式:ESI+;毛細管電壓:3.5 kV;錐孔電壓:20 V;離子源溫度:100 ℃;脫溶劑氣溫度:250 ℃;脫溶劑氣流量:500 L/h;錐孔氣流量:50 L/h;碰撞能量:6 eV;探測器電壓:1 600 V;掃描m/z范圍:50~500 Da;選擇離子:m/z 164、m/z 166。
1.2.9 重組菌B. subtilis Wb600 (pHY300plk-PrpsD-mldh-TrpsD) 全細胞不對稱還原反應
取適量培養一定時間的重組菌濕菌體加入適量MAK及葡萄糖,用pH 7.5的磷酸緩沖液補足至1 mL,30 ℃轉化24 h。10 000 r/min離心10 min,取上清用于HPLC檢測。HPLC檢測條件同1.2.8。
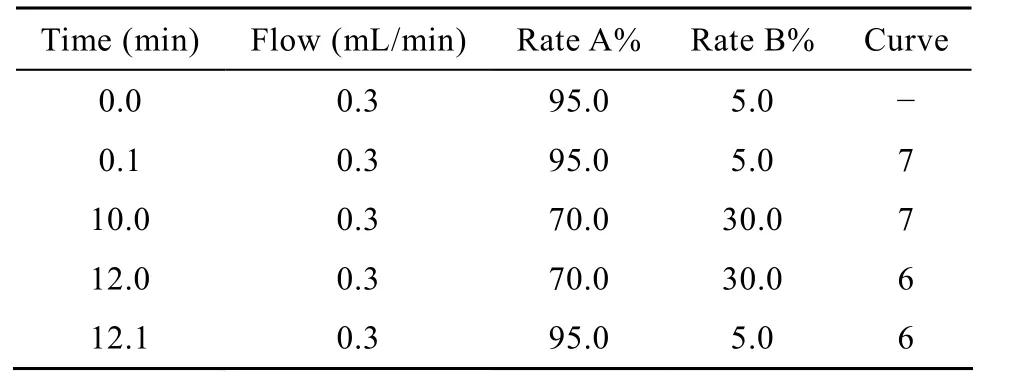
表2 液相色譜流動相梯度洗脫表Table 2 UPLC gradient table
2 結果與分析
2.1 載體pHY300plk-PrpsD-TrpsD的構建
提取陽性菌落的質粒DNA,進行SalⅠ、BglⅡ雙酶切,電泳檢測結果顯示,酶切后出現 4.9 kb、820 bp兩條帶,4.9 kb正是載體 (pHY300plk) 的大小,而820 bp為目的連接片段 (PrpsD-TrpsD) 的大小,說明該質粒已同時插入PrpsD和TrpsD片段,為重組質粒pHY300plk-PrpsD-TrpsD。
2.2 游離表達載體pHY300plk-PrpsD-mldh-TrpsD的構建
提取陽性菌落的質粒DNA進行酶切,電泳結果如圖1A所示,BamHⅠ酶切后出現兩條帶,分別為5.7 kb和1.1 kb,5.7 kb是載體pHY300plk-PrpsDTrpsD的大小,而1.1 kb為目的片段 (mldh) 的大小,說明片段 mldh已插入質粒中;SalⅠ、BglⅡ雙酶切后出現兩條帶,分別為4.9 kb和1.9 kb,4.9 kb為載體 pHY300plk的大小,1.9 kb為片段 PrpsD-mldh-TrpsD的大小,也說明在該陽性菌落的質粒中已插入mldh片段。同時,以陽性菌落的質粒DNA為模板,PrpsD_F和TrpsD_R為上下游引物,進行PCR擴增,電泳檢測結果如圖1B所示,PCR產物為 1.9 kb,這進一步證明質粒 pHY300plk-PrpsDTrpsD中已插入mldh片段。
由于采用單酶切進行連接,需進行正反接驗證,查閱基因序列,片段上酶切位點均有限制,因此通過測定 PrpsD-mldh-TrpsD基因序列間接驗證 mldh片段連接的正確與否。提取質粒pHY300plk-PrpsD-mldh-TrpsD,測定該質粒上PrpsD-mldh-TrpsD基因片段的核酸序列,序列測定結果顯示該 PrpsD和TrpsD序列與已報道的枯草芽胞桿菌168菌株rpsD基因的啟動子和終止子的基因序列一致,同時mldh片段的連接為正向,說明該質粒已成功地正確連接上PrpsD、mldh和TrpsD片段。
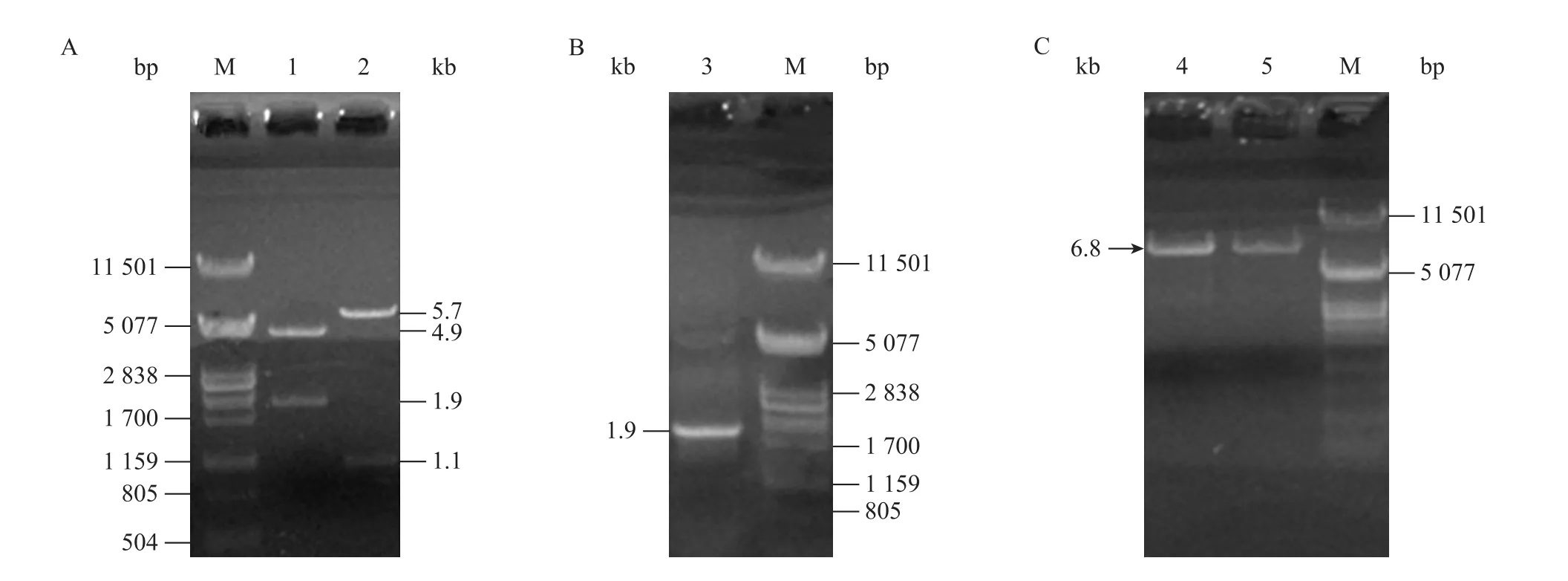
圖1 重組質粒pHY300plk-PrpsD-mldh-TrpsD的瓊脂糖凝膠電泳檢測Fig. 1 Detection of recombinant plasmid pHY300plk-PrpsD-mldh-TrpsD by agarose gel electrophoresis. (A) Restriction enzyme analysis of plasmid pHY300plk-PrpsD-mldh-TrpsD. (B) PCR analysis of plasmid pHY300plk-PrpsD-mldh-TrpsD. (C) Restriction enzyme analysis of plasmid pHY300plk-PrpsD-mldh-TrpsD from recombinant B. subtilis Wb600. M: λ/Pst I DNA marker; 1: pHY300plk-PrpsD-mldh-TrpsD/Sal I/Bgl II; 2: pHY300plk-PrpsD-mldh-TrpsD/BamH I; 3: PCR amplification of PrpsD-mldh-TrpsD from plasmid pHY300plk-PrpsD-mldh-TrpsD; 4: pHY300plk-PrpsD-mldh-TrpsD/Sal I; 5: plasmid from recombinant B. subtilis/Sal I.
2.3 重組菌B. subtilis Wb600(pHY300plk-PrpsD-mldh-TrpsD) 的鑒定
2.3.1 質粒的檢測
提取陽性菌落的質粒DNA,SalⅠ酶切后電泳檢測,結果如圖1C所示,枯草芽胞桿菌重組子中含有與原轉化所用質粒大小一致的質粒,初步認為該陽性重組子中已轉入重組質粒 pHY300plk-PrpsD-mldh-TrpsD。
2.3.2 SDS-PAGE檢測
取重組菌菌體破碎液進行SDS-PAGE分析,結果如圖2所示,重組菌B. subtilis Wb600 (pHY300plk-PrpsD-mldh-TrpsD) 細胞中有相對分子質量約為42.5 kDa的蛋白得以表達。根據本研究室前期文獻
[7]報道羰基還原酶的相對分子質量為42.5 kDa,這說明重組枯草芽胞桿菌能表達羰基還原酶。

圖2 枯草芽胞桿菌Wb600及其重組菌SDS-PAGE檢測Fig. 2 Detection of B. subtilis Wb600 and its recombinant strain by SDS-PAGE. 1: cell crude extract of B. subtilis Wb600; 2: cell crude extract of B. subtilis Wb600 (pHY300plk); 3: cell crude extract of B. subtilis Wb600 (pHY300plk-PrpsD-mldh-TrpsD); M: standard protein molecular weight marker.
2.3.3 生物轉化反應及檢測
取重組菌菌體破碎液進行生物轉化反應,反應結束后取上清液進行HPLC和UPLC-MS檢測產物。HPLC檢測結果如圖 3所示,從圖中可以看出,在重組菌轉化液色譜圖中有保留時間分別為29.23 min和31.43 min的峰,對照標樣圖譜,這兩個峰分別對應MAK和d-偽麻黃堿,初步判斷重組菌的生物轉化液中含有d-偽麻黃堿。而33.8 min的峰在添加與不添加MAK的轉化反應液中都會產生,該物質并非轉化反應的副產物,而可能是細胞本身產生的某種物質。對其進行 UPLC-MS分析,初步得出其分子量為227.2,但仍未能確定是何種物質,有待進一步的研究。
為進一步確定轉化產物,采用超高效液相色譜-質譜聯用法(UPLC-MS)對轉化液進行分析,測定轉化產物的分子量,結果如圖4所示。其中圖A、B、C分別為MAK、l-麻黃堿和d-偽麻黃堿標準溶液的選擇離子色譜-質譜圖。從MAK、l-麻黃堿和d-偽麻黃堿的選擇離子色譜-質譜圖中,可以得到各自的母離子[M+H]+分別為164、166和166;同時在選擇各自的特征離子 (146、148和148) 下,色譜圖相應位置處分別有最大響應值,保留時間分別為3.56 min、7.85 min、7.98 min。通過標準溶液的液相色譜保留時間和質譜圖可以用來確定轉化液中的物質。圖 D為重組菌轉化液的選擇離子色譜-質譜圖。從圖中可以看出,在同時選擇特征離子146和148下,重組菌轉化液中在保留時間分別為3.52 min和7.96 min處有最大響應值,對照標樣圖譜,這兩個峰分別對應MAK和d-偽麻黃堿的峰,同時根據這兩個峰的質譜圖可知其對應的分子量分別為 163(164-1) 和165(166-1),即為MAK和麻黃堿的分子量大小,因而可以判斷重組菌的轉化液中含有d-偽麻黃堿。
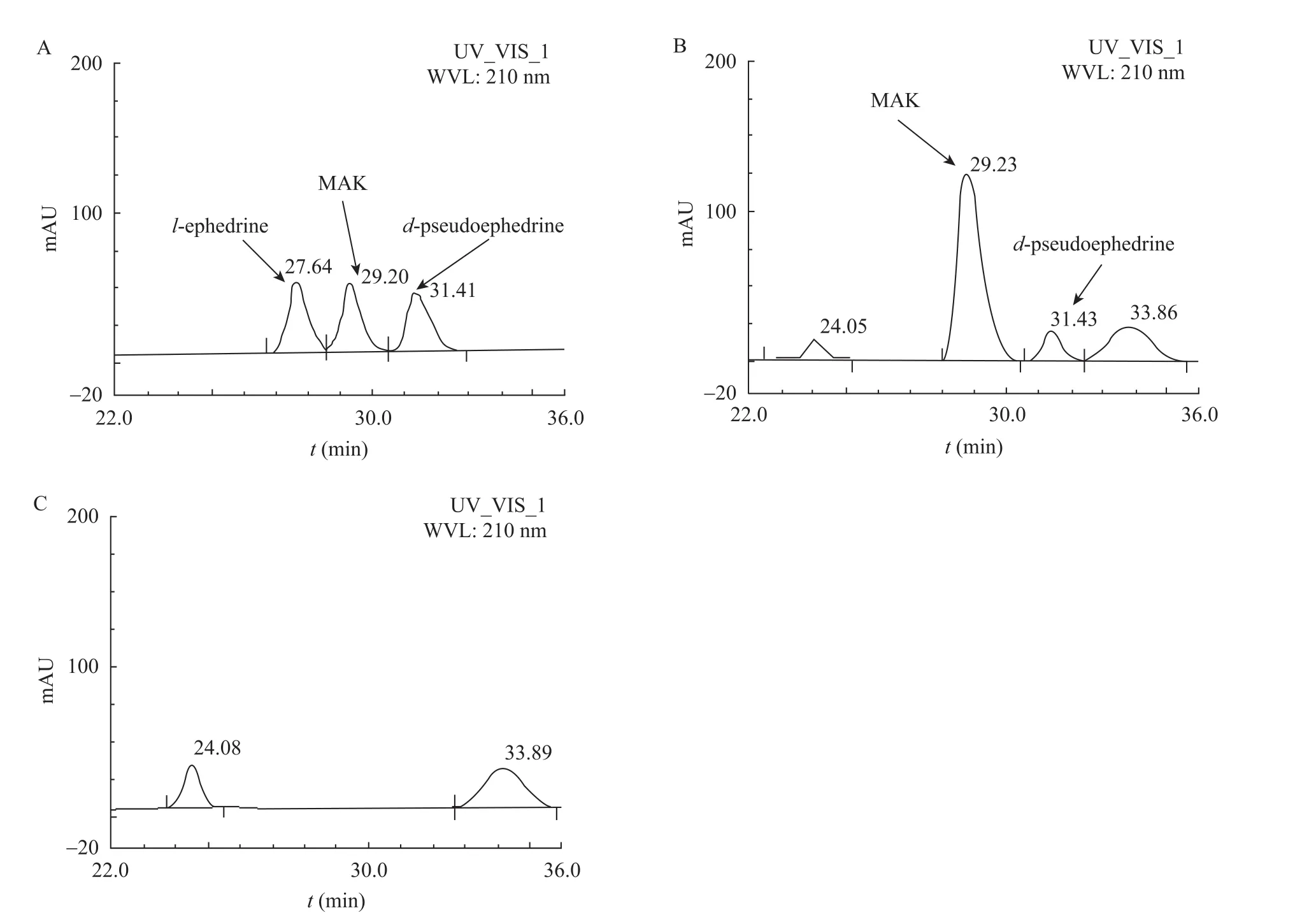
圖3 標樣和重組菌轉化液的HPLC圖譜Fig. 3 HPLC chromatogram of the transformation products and the standard sample. (A) HPLC chromatogram of the standard sample (l-ephedrine, MAK and d-pseudoephedrine). (B) HPLC chromatogram of the transformation products in the presence of MAK from recombinant B. subtilis. (C) HPLC chromatogram of the transformation products in the absence of MAK from recombinant B. subtilis.

圖4 標樣和重組菌轉化液的選擇離子色譜-質譜圖Fig. 4 Selected ion chromatogram and mass spectrometry of the transformation products from recombinant B. subtilis and the standard sample. (A) Selected ion chromatogram (m/z146) and mass spectrometry of MAK. (B) Selected ion chromatogram (m/z148) and mass spectrometry of l-ephedrine. (C) Selected ion chromatogram (m/z148) and mass spectrometry of d-pseudoephedrine. (D) Selected ion chromatogram (m/z146+148) and mass spectrometry of the transformation products from recombinant B. subtilis.
2.4 重組菌B. subtilis Wb600(pHY300plk-PrpsD-mldh-TrpsD) 全細胞不對稱還原反應
2.4.1 菌體用量對重組菌全細胞生物轉化的影響
分別取培養時間為12 h的不同量重組菌濕菌體,加入9 mg 葡萄糖和0.05 mg的MAK轉化反應,HPLC分析測定,結果如圖5所示。增加菌體用量,產物的產量會有不同程度的增長,其中以菌體量從0.1 g增加到0.2 g時增長幅度最大,而當菌體量大于0.2 g時,產物產量趨于穩定,這與本研究室前期研究結果相一致[6],故選擇0.2 g作為后續轉化反應的菌體加入量。

圖5 菌體用量對全細胞生物轉化的影響Fig. 5 Effect of the amount of cell on whole-cell biotransformation.
2.4.2 葡萄糖濃度對重組菌全細胞生物轉化的影響
取0.2 g培養時間為12 h的重組菌濕菌體,加入 0.05 mg MAK和不同量的葡萄糖轉化反應,HPLC分析測定,結果如圖6所示。在糖濃度為18 g/L時產物的產量最高。當糖濃度低于 18 g/L時,產物的量隨糖濃度的升高而增加;而當糖濃度超過18 g/L后,由于高濃度的葡萄糖抑制GDH的酶活,輔酶NADH生成較少,最終導致隨著糖濃度的繼續增高產物產量反而降低。
2.4.3 底物MAK濃度對重組菌全細胞生物轉化的影響
取0.2 g培養時間為12 h的重組菌濕菌體,加入 18 mg的葡萄糖和不同量的 MAK轉化反應,HPLC分析測定,結果如圖7所示。底物MAK在加入濃度為 0.4 g/L時產物的產量最高。當 MAK濃度低于0.4 g/L時,隨著底物濃度的增加隨之增加;而當MAK濃度高于0.4 g/L時,由于在高濃度MAK下存在底物抑制作用,酶活降低,產物產量隨著底物濃度的增加反而降低。

圖6 葡萄糖濃度對全細胞生物轉化的影響Fig. 6 Effect of the concentration of glucose on whole-cell biotransformation.

圖7 底物MAK濃度對全細胞生物轉化的影響Fig. 7 Effect of the concentration of MAK on whole-cell biotransformation.
2.4.4 培養時間對重組菌全細胞生物轉化的影響
取 0.2 g不同培養時間的重組菌濕菌體,加入18 mg的葡萄糖和0.4 mg的MAK轉化反應,HPLC分析測定,結果如圖 8所示。不同培養時間下,培養12 h其轉化生成d-偽麻黃堿的產量最高。不同時間收集的菌體,細胞所處的生長周期不同,因而外源基因的表達量不同,進而影響到產物的產量。培養時間不夠外源基因得不到充分表達,產物產量低;過長的培養時間則會導致細胞衰亡并產生大量毒素和次生產物導致酶活力下降而限制產量。

圖8 細胞培養時間對全細胞生物轉化的影響Fig. 8 Effect of culture time on whole-cell biotransformation.
2.4.5 較優條件下重組菌全細胞生物轉化
取0.2 g培養時間為12 h的重組菌濕菌體,加入18 mg的葡萄糖和0.4 mg的MAK轉化反應,HPLC分析測定d-偽麻黃堿的產量為97.5 mg/L,底物摩爾轉化率為24.1%。
3 討論
近些年,麻黃堿和偽麻黃堿不僅用于多種藥物制劑,在國外還用于營養食品補充劑、減肥劑等,應用領域廣泛,市場活躍。利用生物轉化同時酶耦聯再生輔酶的方法制備麻黃堿是大規模生產麻黃堿的理想途徑之一,具有巨大發展潛力。枯草芽胞桿菌作為目前原核表達系統中較理想的宿主,生理、生化、遺傳及分子生物學研究背景良好,與大腸桿菌表達系統相比具有以下特點:非致病性;密碼子偏好型不明顯,轉錄翻譯機制清楚[15];雖表達水平低,但避免了蛋白質的錯誤折疊或不完全合成和易形成包涵體的缺點[16]。近年來,隨著分子生物學和基因工程的發展,枯草芽胞桿菌作為基因工程表達系統發展迅速,并展現出良好的應用前景。
本文首次報道了利用 B. subtilis生物轉化生產d-偽麻黃堿,重組B. subtilis在葡萄糖存在的情況下能夠催化底物MAK轉化生成d-偽麻黃堿。研究選擇B. subtilis Wb600作為宿主,利用強啟動子PrpsD和終止子TrpsD實現mldh在枯草芽胞桿菌中的高效表達,同時通過細胞內GDH解決輔酶的再生問題。對重組菌進行全細胞轉化反應實驗,產物產量最高為97.5 mg/L,底物摩爾轉化率為24.1%,成功實現了目標酶的生物轉化功能,避免了昂貴的輔酶外源性的加入,大大降低了產物的制備成本。
本研究室前期研究中,利用 M. morganii催化MAK生產d-偽麻黃堿,通過外加輔酶,由于輔酶提供充足,最終產物產量為85.2 mg/L,摩爾轉化率達84.4%[6];而利用共表達mldh和gdh的重組大腸桿菌不對稱還原產 d-偽麻黃堿,雖然實現了輔酶在細胞內的再生,但由于本身MLDH酶活力不高且再生的輔酶未能完全替代外加輔酶的作用,結果最終產物產量和摩爾轉化率均不是很高,分別為 58 mg/L和 57.6%[8];相比之下,本研究中產物產量稍有提高,但底物摩爾轉化率較低。從文中葡萄糖濃度對轉化的影響可知,在一定濃度范圍內產物的量隨糖濃度的升高而增加,但增長幅度并不大,初步判斷可能是由于轉化反應過程中GDH酶活力不高,雖增加葡萄糖濃度,但輔酶仍提供不足,導致最終產物產量相差不大。此外,相比外加輔酶,通過葡萄糖脫氫酶實現輔酶的再生,其在氧化葡萄糖生成輔酶的同時也存在葡萄糖酸的產生,而葡萄糖酸的產生會影響反應體系的 pH,導致反應未能在較適的 pH條件下進行,最終影響產物的產量。本研究雖然實現了mldh基因在枯草芽胞桿菌中的高效表達,在不外加輔酶的情況下可以轉化生產麻黃堿,但仍未能較好地解決轉化過程中輔酶的需求問題,后續可以進一步考察增加GDH拷貝數或更改MLDH與GDH兩者之間的比例關系從而提高產物的產量;或通過篩選自身GDH酶活力較高的野生型菌株,以其為宿主表達羰基還原酶基因實現產物的高產。這些研究對于工業應用重組枯草芽胞桿菌生物轉化生產 d-偽麻黃堿具有重要意義。
REFERENCES
[1] Zhang L, Ding ZY, Shi GY. Asymmetric biosynthesis of (1S,2S)-ephedrine by Morganella morganii CMCC(B) 49208. Afr J Biotechnol, 2009, 8(4): 694?698.
[2] Krizevski R, Bar E, Shalit O, et al. Composition and stereochemistry of ephedrine alkaloids accumulation in Ephedra sinica Stapf. Phytochemistry, 2010, 71(8/9): 895?903.
[3] Rothman RB, Vu N, Partilla JS, et al. In vitro characterization of ephedrine related stereoisomers at biogenic amine transporters and the receptorome reveals selective actions as norepinephrine transporter substrates. J Pharmacol Exp Ther, 2003, 307(1): 138?145.
[4] Chen P, Wang JH. Discussion about reformation of ephedrine production technology. Environ Protect Xinjiang, 2002, 24(3): 25?27.陳平, 王江紅. 麻黃堿生產工藝改進分析. 新疆環境保護, 2002, 24(3): 25?27.
[5] Yoshihiko Y. Application of biotransformation in the chiral industry: oxido-reductases reaction. Biosci Ind, 2005, 63(5): 308?311.
[6] Dong SJ, Shi GY, Lu Y, et al. Microbial transformation for d-pseudo-ephedrine by Morganella morganii. J Wuxi Univ Light Ind, 2004, 23(2): 5?7.董世建, 石貴陽, 盧燕, 等. 微生物轉化法生產 d-偽麻黃堿. 無錫輕工大學學報, 2004, 23(2): 5?7.
[7] Zhang PH, Zhang L, Lu Y, et al. Purification and characterization of carbonyl enantioselective reductase from Morganella morganii J-8. Chin J Biotech, 2007, 23(2): 268?272.張鵬華, 張梁, 盧燕, 等. Morganella morganii J-8羰基不對稱還原酶的分離純化及性質研究. 生物工程學報, 2007, 23(2): 268?272.
[8] Yuwen WG. Study on asymmetric carbonyl reduction of prochiral aromatic ketone to d-pseudoephedrine by co-expression recombinant Escherichia coli [D]. Wuxi: Jiangnan University, 2009.宇文偉剛. 共表達型重組大腸桿菌不對稱還原產d-偽麻黃堿的研究[D]. 無錫: 江南大學, 2009.
[9] Yun H, Choi HL, Fadnavis NW, et al. Stereospecific synthesis of (R)-2-hydroxy carboxylic acids using recombinant E. coli BL21 overexpressing YiaE from Escherichia coli K12 and glucose dehydrogenase from Bacillus subtilis. Biotechnol Progr, 2005, 21(2): 366?371.
[10] Xu ZN, Jing KJ, Liu Y, et al. High level expression of recombinant glucose dehydrogenase and its application in NADPH regeneration. J Ind Microbiol Biotechnol, 2007, 34(1): 83?90.
[11] Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York: Cold Spring Harbor Laboratory Press, 1989: 20?25.
[12] Ausubel FM, Brent R, Kingston RE, et al. Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology. New York: John Wiley and Sons Inc, 2002: 56?80.
[13] Heng C, Chen ZJ, Du LX, et al. Expression and secretion of an acid-stable α-amylase gene in Bacillus subtilis by SacB promoter and signal peptide. Biotechnol Lett, 2005, 27(21): 1731?1737.
[14] Wang JZ, Fan M. Protein Technical Manual. Beijing: Science Press, 2001: 77?101.汪家政, 范明. 蛋白質技術手冊. 北京: 科學出版社, 2001: 77?101.
[15] Le ATT, Schumann W. A novel cold-inducible expression system for Bacillus subtilis. Protein Expr Purif, 2007, 53(2): 264?269.
[16] Zweers JC, Barák I, Becher D, et al. Towards the development of Bacillus subtilis as a cell factory for membrane proteins and protein complexes. Microb Cell Fact, 2008, 7: 10?29.

