術前體質量指數對肝細胞性肝癌患者預后的影響
張 勇,李德春,戴賽民,郭子健,過建工,周 鵬,周俊晶
(1.蘇州大學附屬無錫第四醫院肝膽外科,江蘇無錫,214062;2.蘇州大學附屬第一醫院普外科,江蘇蘇州,215006)
肝細胞肝癌是我國常見的惡性腫瘤之一,手術切除仍是首選的治療方法,但由于肝癌的惡性程度較高,即便能實施手術切除的患者,目前總的5年生存率仍然較低。體質量指數作為一個能反映蛋白質能量型營養不良及肥胖的可靠指標,對惡性腫瘤治療的影響正越來越引起人們的關注。研究表明,體質量指數的異常與多種惡性腫瘤的進展相關,包括乳腺癌、肺癌、直腸癌、膀胱癌、腎癌、子宮內膜癌等[1-7]。肝癌術前體質量指數與肝癌預后的關系目前尚不清楚,為此,作者回顧性分析了本院腫瘤外科1998~2005年實施的105例肝細胞性肝癌切除患者的臨床資料和其術前BMI的關系。現報告如下。
1 資料與方法
1998~2005年本院腫瘤外科收治并手術的肝細胞性肝癌患者105例,所有病例診斷均經病理檢查證實。患者男女比例為2.09∶1,平均年齡及中位年齡均為52歲。根據世界衛生組織西太平洋地區肥胖特別工作組制定的亞洲成人標準分組,16例患者屬于低體質量組,43例患者屬于正常體質量組,35例患者屬于超重組,11例患者屬于肥胖組。和正常體質量組相比較,AFP、腫瘤的大小和病理分期在各組之間的差異都有統計學意義;年齡、性別、Child-Pugh分期在各組之間的差異無統計學意義。見表1。
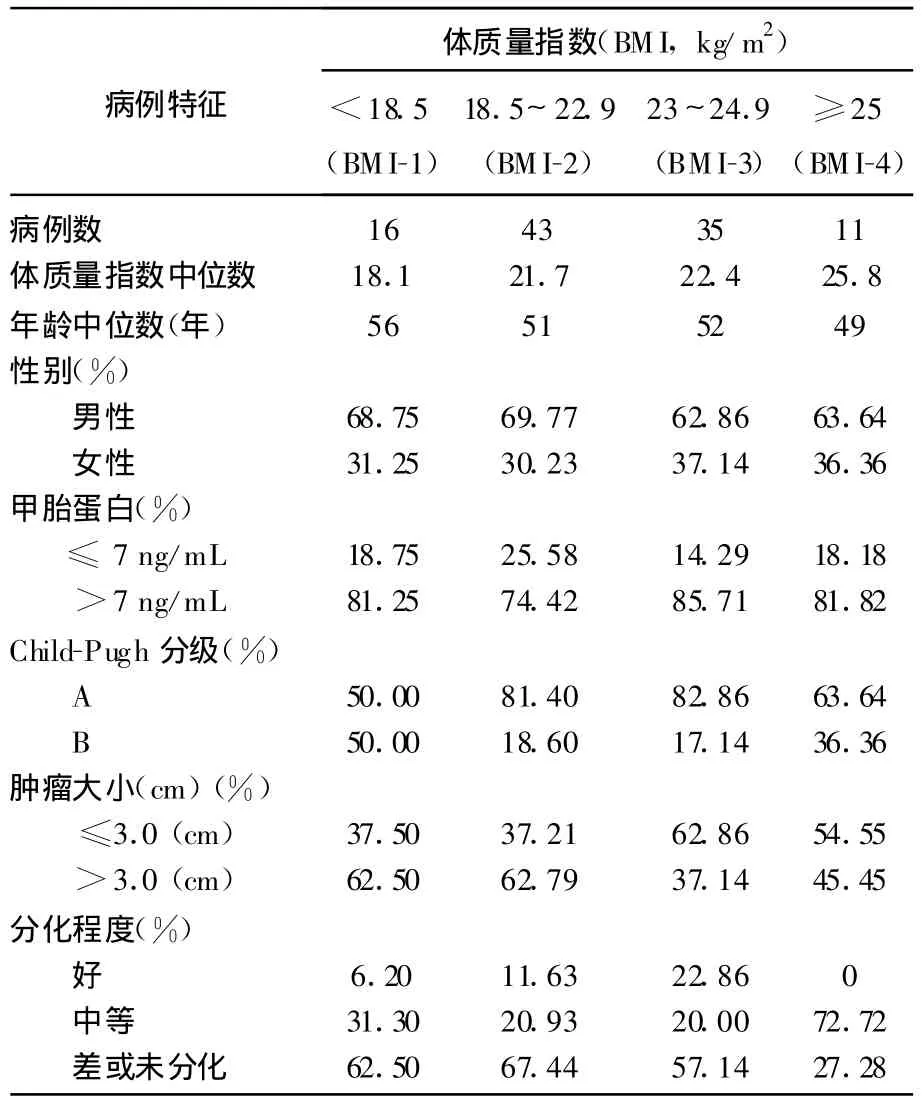
表1 不同體質量指數的肝細胞肝癌患者的臨床特征
1.1 手術方法
所有病例均行肝葉、肝段或肝不規則切除。
1.2 分組方法
根據世界衛生組織西太平洋地區肥胖特別工作組制定的亞洲成人標準,BMI 18.5~22.9 kg/m2為正常,<18.5 kg/m2為低體質量,23.0~24.9kg/m2為超重,≥25 kg/m2為肥胖。
1.4 研究觀察終點及隨訪情況
本研究采用以下幾個終點為研究終點:①總生存時間(OS):指觀察到的生存時間,即指隨訪開始日期至死亡日期或末次隨訪日期;②無復發轉移(肝內或肝外)生存時間:觀察到的肝內或肝外無復發轉移的生存時間。
本研究隨訪開始時間以肝切手術后的時間為起點。隨訪采用電話,門診復查兩種方式,隨訪時間跨度為10~77個月。平均47個月,3年隨訪率為100%,5年隨訪率為98%。
2 結 果
2.1 不同BMI組患者的總生存、無肝內復發轉移生存和無肝外轉移生存的相對危險度
所有病例資料根據其BMI分成4組,進行生存分析(各組患者的總生存、無復發轉移生存的危險度分析結果見表2。以低體質量組作為對照組,計算另外3組患者的總生存率、無復發轉移生存在各組中的相對危險度。結果顯示:正常組、超體質量組和肥胖組的相對危險度均小于1。
2.2 預后影響因素的單因素分析結果
低體質量組總生存率低于正常體質量組和超重組、肥胖組,其差異均有統計學意義(均P<0.0001)。正常體質量組和超重組、肥胖組之間總生存率比較無差異(P值分別為0.834,0.242)。超重組和肥胖組之間總生存率比較差異無顯著性(P=0.224)。

表2 不同體質量指數組的總體生存率、無復發和轉移的生存率分析
按照觀察到的無復發轉移(肝內或肝外)的存活時間進行無復發轉移(肝內或肝外)生存分析,可見低體質量組患者的無復發轉移(肝內或肝外)生存率低于正常體質量組(P<0.000 1),超重組(P<0.000 1)和肥胖組(P=0.002),正常體質量組和超重組、肥胖組之間無復發轉移(肝內或肝外)生存率比較無差異(P值分別為0.922,0.973)。超重組和肥胖組之間無復發轉移(肝內或肝外)生存率比較也無差異(P=0.688)。
2.3 預后影響因素的多因素分析結果
病例資料的多因素分析結果表明(表3),AFP(P=0.048)、腫瘤大小(P=0.040)、腫瘤病理分期(P<0.001)、BMI分組(P=0.044)可作為顯著的獨立的肝癌預后因素。

表3 影響肝癌術后總體生存的多因素分析
3 討 論
原發性肝癌切除后的預后受到諸如AFP濃度,腫瘤大小,腫瘤數目和是否合并肝硬化等因素的影響[8]。研究表明,作為一個能反映蛋白質能量型營養不良及肥胖的可靠指標,體質量指數的異常與多種惡性腫瘤的進展相關,包括乳腺癌、肺癌、直腸癌、膀胱癌、腎癌、子宮內膜癌等。Larsson等報道,多中心的研究數據表明在西方國家,體質量指數的增加和肝癌的發生上升有關[9-10]。而Batty等對亞太地區群組研究的數據分析認為,在中國、日本,數據表明體質量指數上升與肝癌的發生減少有關[11]。目前BMI與原發性肝癌術后預后的關系尚不清楚。
Kaplan-Meier法單因素生存分析的結果顯示,低體質量組的總體生存率低于正常體質量組和超重組、肥胖組。而正常體質量組和超重組、肥胖組之間的差異則并不明顯。同樣,在無復發或轉移生存分析中,低體質量組的無無復發或轉移生存率低于正常體質量組和超重組、肥胖組,而后3組之間的差異則并不明顯。由此,作者認為,低體質量患者的總體生存率和無復發或轉移生存率均低于正常體質量組和超重組、肥胖組,隨著營養狀況的好轉,免疫狀況改善,體質量指數達到正常組之上后,其對肝癌切除術后預后的影響就無顯著意義了。
為了進一步分析AFP、腫瘤的大小和病理分期在各組中對結果的影響,作者采用了Cox比例風險模型進行了多因素預后分析。結果顯示,在總體生存和無復發或轉移生存中,體質量指數都可以作為一個獨立的預后影響因素存在。低體質量指數表明存在蛋白能量型營養不良,有利于一些腫瘤的發生和進展,而提高蛋白質的供給可以改善營養狀況,提高機體的免疫力,有助于腫瘤術后的恢復。
[1] Dietz A T,Newcomb P A,M arcus P M,et al.The association of body size and large bowel cancer risk in Wisconsin(U-nited States)women[J].Cancer Causes Control,1995,6(4):30.
[2] Kune G A,Kune S,Watson L F.Body weight and physical activity as predictors of colorectal cancer risk[J].Nutr Cancer,1990,13(6):9.
[3] West D W,Slattery M L,Robison L M,et al.Dietary intake and colon cancer:Sex and anatomic site-specific associations[J].Am J Epidemiol,1989,130(2):883.
[4] Lacey J V,Leitzmann M,Brinton L A,et al.Weight,Height,and Body Mass Index and Risk for Ovarian Cancerin a Cohort Study.Ann Epidemiol[J].2006,16:869.
[5] Wina T,Ritchieb A J,Wellsb F C,et al.The incidence and impact of low body mass index on patients with operable lung cancer[J].Clinical Nutrition,2007,26:440.
[6] Ecke T H,Schlechte H H,Gunia S,et al.Body mass index(BM I)and mutations of tumor suppressor gene p53(TP53)in patients with urinary bladder cancer[J].Urol Oncology,2008,26:470.
[7] Sawada N,Inoue M,Sasazuki S,et al.Body Mass Index and Subsequent Risk of Kidney Cancer:A Prospective Cohort Study in Japan[J].Ann Epidemiol,2010,20:466.
[8] 嚴律南.肝臟外科.北京:人民衛生出版社,2002:480.
[9] Larsson S C,Wolk A.Overweight,obesity and risk of liver cancer:a metaanalysis of cohort studies[J].Br J Cancer,2007,97:1005.
[10] Batty G D,Shipley M J,Kivimaki M,et al.Obesity and overweight in relation to liver disease mortality in men:38 year follow-up of the original Whitehall study[J].Int J Obes,2008,32:1741.
[11] Batty G D,Barzi F,Huxley R,et al.Obesity and liver cancer mortality in Asia:T he Asia Pacific Cohort Studies Collaboration[J].Cancer Epidemiol,2009,33:469.

