連翹酯苷對順鉑耳毒性防護作用的實驗研究
黃世勇 陶澤璋 肖伯奎
順鉑具有腎毒性、耳毒性、神經毒性和骨髓抑制等多種毒副作用[1],劑量越大,其引發毒副作用的風險也就越大,使其應用受到一定的限制。臨床資料表明,大劑量順鉑可致雙耳進行性感音神經性聾,這是影響該藥使用乃至停藥的一個重要因素[2]。因此,在保留順鉑抗腫瘤作用的同時,如何降低其耳毒性,是臨床上一個亟待解決的課題。近年來有關順鉑的自由基致聾機制逐漸引起較多的關注,如何找到高效的抗自由基物質,是當前研究的一個熱點。連翹酯苷是從中草藥連翹中提取的一種單體物質,為連翹的主要活性成分,具有顯著的清除氧自由基、抗氧化功效[3]。本研究在順鉑引發豚鼠內耳損傷模型的基礎上,觀察連翹酯苷對順鉑耳毒性的防護作用,并初步探討其作用機制,試圖為臨床應用提供實驗依據。
1 材料與方法
1.1實驗藥物主要試劑及儀器 順鉑注射劑為齊魯制藥有限公司生產,批號:910022208,10毫克/支;連翹酯苷凍干粉由天津一方科技有限公司提供,含量>98%,為淡黃色粉末狀物質,批號100225,保存于4 ℃冰箱中,臨用前配制;超氧化物歧化酶活性試劑盒及丙二醛試劑盒購自南京建成生物工程研究所。實驗器材:解剖顯微鏡(OLYMPUS SZS1);MEM-3202型誘發電位儀(日本光電公司生產) ;配備單反數碼相機顯微攝影裝置的OLYMPUS E330研究級顯微鏡。
1.2實驗動物分組及處理 成年健康豚鼠42只,雌雄不限,250~350 g,均經電耳鏡檢查排除外耳道炎及中耳炎,耳廓反射靈敏。分籠適應性喂養1 周后隨機分為3組,空白組(10只):腹腔注射生理鹽水8.0 ml·kg-1·d-1,連續8天;順鉑組(16只):將順鉑用生理鹽水配制成0.25 mg/ml,然后腹腔注射順鉑2.0 mg·kg-1·d-1,連續8天;拮抗組(16只):前2天腹腔注射連翹酯苷25.0 mg·kg-1·d-1[4],第3天起腹腔注射連翹酯苷后30 min,再腹腔注射順鉑2.0 mg·kg-1·d-1,連續8天。整個過程中避免接觸噪聲,每天測量體重以調整藥量并嚴密觀察豚鼠的毛發及精神狀況等變化。每組豚鼠首次用藥前及末次用藥后第二天行ABR閾值檢測,末次檢測完畢后,心臟穿刺采血[5]用于血清總超氧化物歧化酶(total superoxide disumutase,T-SOD)活性和丙二醛(malondialdehyde,MDA)含量檢測,最后斷頭處死取耳蝸,行硝酸銀染色全耳蝸鋪片觀察、耳蝸組織切片觀察及掃描電鏡觀察。
順鉑組6只、拮抗組3只動物因內耳損傷、造模不成功以及死亡而未列入統計范圍內。28個耳蝸用于硝酸銀染色全耳蝸鋪片及毛細胞定量觀察,其中,空白組8個、順鉑組8個、拮抗組12個;26個耳蝸用于耳蝸切片標本制備,其中,空白組8個、順鉑組8個、拮抗組10個;12個耳蝸用于掃描電鏡樣品的制備,空白組4個、順鉑組4個、拮抗組4個。
1.3ABR檢測 1%戊巴比妥鈉(40 mg/kg ) 腹腔注射麻醉,維持動物的自主呼吸,在隔聲電屏蔽室內進行。短聲刺激,刺激率為20次/秒,掃描時間10 ms,帶通濾波100~3 000 Hz ,聲輸出范圍0~100 dB nHL。記錄電極置于頭項正中,對側外耳道后壁為參考電極,鼻尖為地極[6]。
1.4全耳蝸鋪片及毛細胞定量觀察 耳蝸鋪片標本制備:動物斷頭處死后,取出雙側聽泡,打開聽泡,蝸尖鉆孔,開放卵圓窗和圓窗,從蝸尖灌注新鮮配制的0.5%硝酸銀溶液2~3次,使液體自前庭階、鼓階由卵圓窗、圓窗流出,再用10%福爾馬林溶液灌注并將標本置于固定液中,自然光下曝光2~3小時,解剖顯微鏡下剝離耳蝸蝸殼,取全程基底膜,放置于滴有甘油的載波片中,分回封片。在400倍光鏡下,觀察基底膜毛細胞形態,從蝸頂向底回逐個視野進行計數外毛細胞。將基底膜的全長轉換為百分比長度表示,計錄每5%距離中的外毛細胞數量,同時將采集到的數據錄入計算機。記錄每個耳蝸樣品的數據,并將同組中不同樣品相應單位百分比長度內的外毛細胞數量與數據庫中該種屬健康動物相應單位百分比長度內的外毛細胞均數進行比較,并轉換成該樣本外毛細胞的殘存率再組內取均數,從而得出該組動物的耳蝸外毛細胞殘存率的曲線圖[7~11]。將三組豚鼠耳蝸外毛細胞殘存率曲線圖進行對比并行定性和定量分析。
1.5耳蝸切片標本制備 取各組動物聽泡,暴露耳蝸,蝸尖鉆孔,自蝸尖灌注10%福爾馬林溶液0.5~1.0 ml,將標本置于同種固定液中4 ℃過夜。10%EDTA脫鈣一周。常規石蠟包埋,平行蝸軸方向連續切片,切片厚度約10 μm。行HE染色,封片,400倍光鏡下觀察Corti 器、血管紋、螺旋神經節形態學情況,攝片[12]。
1.6掃描電鏡標本制備 取各組動物聽泡,暴露耳蝸,蝸尖鉆孔,以2.5%戊二醛灌流,并置于相同固定液中,4 ℃過夜。次日清洗后在解剖顯微鏡下剝去耳蝸骨殼,并輕柔剝下螺旋韌帶,暴露耳蝸基底膜,鋨酸處理,PBS清洗3次,梯度酒精脫水,100%醋酸異戊酯替換,CO2臨界點干燥,粘臺,噴金,2 500倍掃描電鏡下觀察攝片。
1.7血清T-SOD活性和丙二醛含量的測定 心臟穿刺采血,3 000 r/min離心10 min,取上清液,-20 ℃冰箱保存待測。檢測指標包括血清總超氧化物歧化酶(total superoxide disumutase,T-SOD)活性和丙二醛(malondialdhyde,MDA)含量。T-SOD活性采用黃嘌呤氧化酶法,以每毫升反應液中SOD抑制率達到50%時對應的SOD量為一個活性單位(1U),結果以U/ml表示;MDA含量采用硫代巴比妥酸比色法,結果以nmol/ml表示[13]。
1.8統計學方法 所有實驗數據均采用SPSS 13.0統計軟件處理,ABR反應閾行自身前后對照比較應用配對t檢驗;組間比較采用單因素χ2分析,多個樣本均數的兩兩比較采用q檢驗;以P<0.05為差異有統計學意義。
2 結果
2.1各組一般情況比較 空白組給藥前后精神狀況和日常活動無明顯變化;順鉑組給藥期間動物活動減少,食欲減退,毛發豎立,疏松脫落,耳廓反射減退,甚至消失;拮抗組給藥期間也有輕度的毛發疏松,但活動、食欲、耳廓反射等變化較順鉑組明顯輕。
2.2各組ABR閾值比較 三組豚鼠給藥前后ABR閾值見表1。給藥前,三組豚鼠ABR閾值無明顯差異,給藥后,順鉑組和拮抗組豚鼠反應閾較用藥前提高,順鉑組閾值增高更明顯。

表1 各組豚鼠給藥前后ABR閾值比較
注:△與同組給藥前比較,P<0.05;*與其余兩組給藥后比較,P<0.05
2.3全耳蝸鋪片毛細胞定量觀察
2.3.1耳蝸鋪片毛細胞形態學觀察 各組內毛細胞未見明顯損傷,損傷主要為外毛細胞。正常組毛細胞排列規則整齊,無缺失及損傷;拮抗組毛細胞排列規則,外毛細胞有散在缺失,纖毛結構不清晰;順鉑組外毛細胞缺失數目增加,甚至成片缺失,外毛細胞結構紊亂(圖1)。
2.3.2外毛細胞計數及殘存率 空白組外毛細胞完整未見明顯缺失(缺失率約1.0%);順鉑組外毛細胞缺失最多且以底回最重,平均缺失率約53.42%,且外毛細胞缺失率自第一排向第三排逐漸增多,由頂回向底回逐步增加;拮抗組外毛細胞有散在缺失,程度介于空白組和順鉑組之間。各組動物外毛細胞殘存率見圖2,組間比較存在顯著性統計學差異(P<0.05)。各組內毛細胞未見明顯缺失或損傷。
2.4耳蝸組織切片觀察 空白組未見明顯異常;拮抗組除了可見少許外毛細胞變性缺失外,血管紋無明顯異常,螺旋神經節細胞輕度退變;而順鉑組除了外毛細胞缺失外,還可見Corti器的結構紊亂、血管紋腫脹,血管擴張,螺旋神經節細胞數目明顯減少(圖3)。
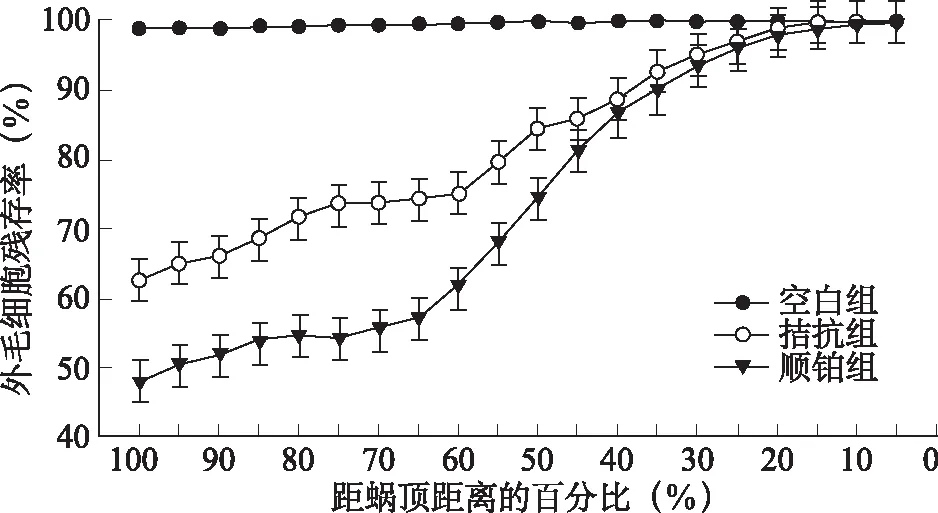
圖2 各組耳蝸鋪片外毛細胞殘存率比較
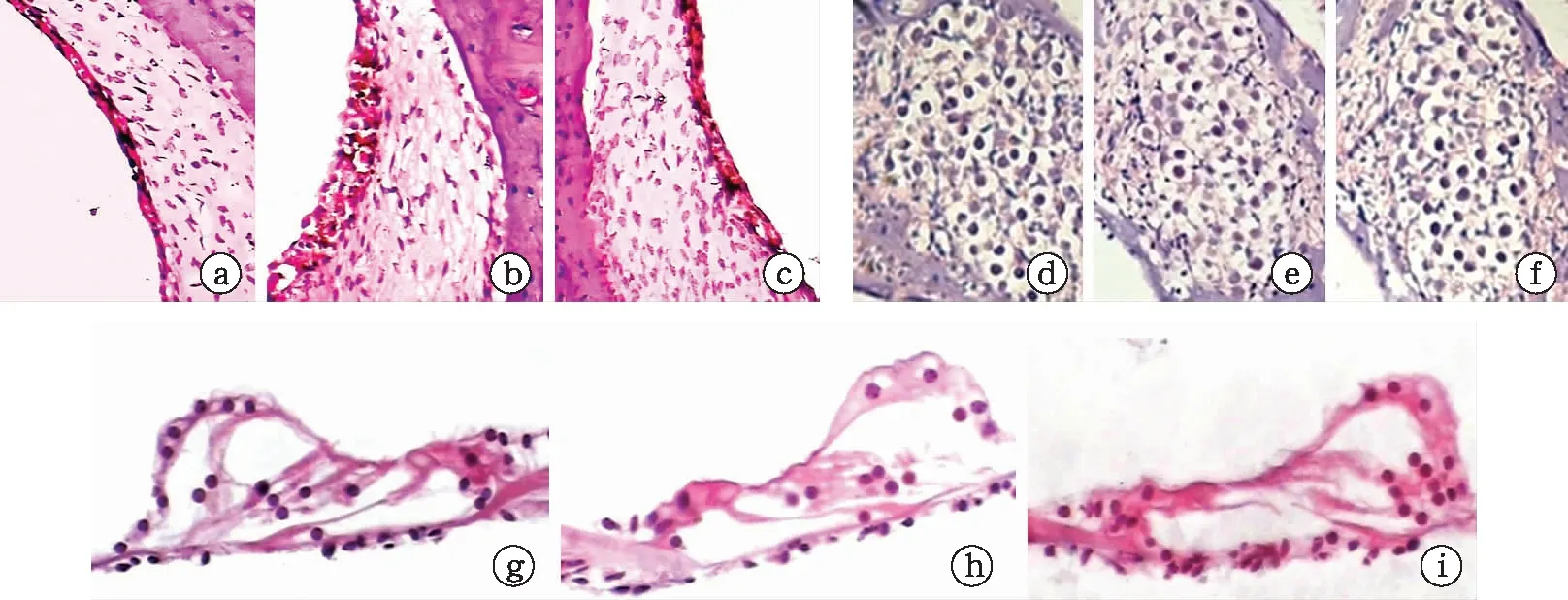
圖3 耳蝸組織切片觀察(HE染色,×400)(a~c為血管紋,d~f為螺旋神經節,g~i為Corti器。a、d、g為空白組,b、e、h為順鉑組,c、f、i為拮抗組)
2.5掃描電鏡觀察結果 空白組耳蝸Corti器中,三排外毛細胞纖毛排列整齊,未見明顯缺失及損傷,順鉑組Corti器中,內毛細胞纖毛腫脹,外毛細胞倒伏,散亂,甚至呈片狀缺失;拮抗組Corti器中,內毛細胞纖毛腫脹呈簇,大部分外毛細胞排列稍有散亂,但未見明顯缺失;拮抗組毛細胞損傷程度介于空白組和順鉑組之間(圖4)。
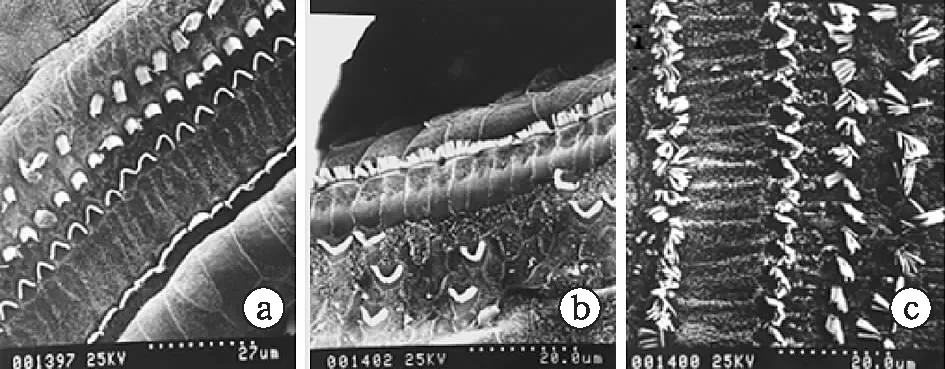
圖4 各組耳蝸毛細胞掃描電鏡觀察
2.6血清T-SOD活性和MDA含量比較 拮抗組T-SOD活性較空白組顯著下降,MDA含量較空白組顯著升高(P<0.05);順鉑組T-SOD活性低于拮抗組,而MDA含量高于拮抗組,差異有統計學意義(P<0.05)。
表3 各組豚鼠血清T-SOD活性和MDA含量比較
注:*與其余兩組比較,P<0.05
3 討論
豚鼠順鉑耳毒性造模過程中,順鉑劑量不宜過大或過小,否則很容易導致豚鼠在出現耳毒性損害之前便因腎毒性而死亡。本研究預實驗發現2 mg·kg-1·d-1是合適的劑量,一般用藥后4天左右蝸底即出現毛細胞損傷,到第5至6天,毛細胞缺失與正常未處理組比較,具有統計學差異。本實驗觀察到動物連續腹腔注射順鉑8天,基底膜底回外毛細胞損傷明顯,達50%以上,而此時豚鼠死亡率相對較低,僅30%左右,故認為2 mg·kg-1·d-1腹腔注射8天是合適的,既造成了基底膜較大范圍的損傷,使豚鼠ABR反應閾明顯增高,又不至于使豚鼠的死亡率過高。
順鉑耳毒性的作用機制目前尚未完全闡明,一般認為機制主要有以下幾種:內耳蓄積的直接損傷、對內耳代謝的影響、血清電解質平衡改變、氧化應激損傷[14]。其中,氧化應激損傷尤為重要。現已發現的諸多防護劑均與拮抗氧化應激損傷有關。如硫代硫酸鈉、蛋氨酸、谷胱苷肽等,其機制主要為清除耳蝸組織氧自由基,減輕因氧化應激反應造成的耳蝸組織細胞損傷[15]。
連翹酯苷為從連翹中提取的一種單體物質,為連翹的主要活性成分,具有顯著的清除組織的氧自由基、抗氧化功效[3]。然而,連翹酯苷能否通過清除耳蝸氧自由基,抑制脂質過氧化反應,從而對順鉑的耳毒性起防護作用,尚未見報道。故本實驗在建立順鉑導致豚鼠內耳損傷模型的基礎上,觀察連翹酯苷對順鉑耳毒性的防護作用。
本實驗發現,順鉑耳毒性主要累及外毛細胞,其損害首先從耳蝸底回開始并逐漸向蝸頂發展,基底膜底回外毛細胞破壞嚴重,可達50%以上,越靠近蝸頂損傷越輕;血管紋和螺旋神經節也多有累及,主要表現為血管紋腫脹和血管擴張,螺旋神經節細胞數目明顯減少。而連翹酯苷可部分拮抗順鉑對內耳組織的損傷,這在拮抗組和順鉑組兩組間外毛細胞損傷的比較上較為明顯,在底回基底膜,順鉑組外毛細胞缺損率高達50%以上,而拮抗組外毛細胞缺損率僅在40%以下;另外,連翹酯苷還可明顯減輕由順鉑導致的外毛細胞腫脹,同時拮抗組血管紋和螺旋神經節所受的損傷也相對較小。
自由基包括氧自由基和氮自由基,正常狀態下,耳蝸內產生的氧自由基與耳蝸內的抗氧化防御系統保持動態平衡[16]。生理狀態下各種自由基具有很高的生物活性,可產生許多生理功能,但當自由基生成過多或其清除系統功能下降時將蓄積過多的自由基,從而對機體產生損傷[17]。SOD是抗過氧化的重要酶,對機體的氧化與抗氧化平衡起著關鍵作用,它可以清除超氧化物陰離子,保護毛細胞免受損傷,還可以使脂質過氧化物還原為相應的醇,減少自由基的生成,它的含量可以反映順鉑耳中毒時脂質過氧化的作用的強弱;氧自由基可引發脂質過氧化反應并因此生成過多的脂質過氧化物,導致其代謝終產物MDA含量顯著增多。因此,T-SOD活性和MDA含量的測定可間接反映耳蝸組織在順鉑耳毒性時清除氧自由基的能力。本實驗結果顯示,順鉑組動物耳蝸組織中T-SOD活力明顯低于正常對照組(P<0.05),表明機體清除自由基的能力顯著下降,提示超氧陰離子自由基含量明顯增多。拮抗組豚鼠ABR閾值較順鉑組明顯降低,T-SOD含量較順鉑組明顯升高,MDA含量明顯降低,提示連翹酯苷可能通過增強體內清除氧自由基的能力,降低耳蝸內的氧化應激反應,減輕因氧化應激反應造成的耳蝸組織細胞損傷,從而說明連翹酯苷可拮抗順鉑耳毒性,對聽力有一定的保護作用。本研究結果增進了對連翹酯苷藥理作用的認識,為其臨床應用提供了新的思路。
4 參考文獻
1 McAlpine D, Johnstone BM. The ototoxic mechanisms of cisplatin[J]. Hear Res, 1990,47:191.
2 Schaefer SD, Post JD, Close LG, et al.Ototoxidty of low-and moderate-dose cisplatin[J].Cancer, 1985, 56:1 934.
3 Qu HH, Zhang YM, Wang Y,et al. Antioxidant and antibacterial activity of two compounds (forsythiaside and forsythin) isolated from Forsythia suspense[J]. The Journal of Pharmacy and Pharmacology,2008, 60:261.
4 黃繼漢, 黃曉暉, 陳志揚,等.藥理試驗中動物間和動物與人體間的等效劑量換算[J].中國臨床藥理學與治療學雜志, 2004 , 9:1 069.
5 栗銘諫, 李洪政, 樊利峰.一次性采制多量豚鼠血清方法的改進[J].陜西醫學檢驗, 2001,16:21.
6 陶澤璋,肖伯奎,劉劍鋒,等.卡那霉素耳中毒后豚鼠耳蝸熱休克蛋白的表達[J]. 聽力學及言語疾病雜志,2000,8:74.
7 亓衛東, 丁大連, 蔣海燕,等.全耳蝸毛細胞定量分析系統[J].聽力學及言語疾病雜志,2007,15:158.
8 Viberg A, Canlon B.The guide to plotting a cochleogram[J].Hearing Res, 2004, 197:1.
9 Sjaak FLK, Stephen JO, Wijbenga J, et al. Partial recovery of cisplatin-induced hearing loss in the albino guinea pig in relation to cisplatin dose[J].Hearing Res,2002,164:138.
10 Greenwood DD.Comparing octaves, frequency ranges, and cochlear-map curvature across species[J].Hearing Res, 1996, 94:157.
11 Marjolein WM, John CMJ, Guido F.Time sequence of degeneration pattern in the guinea pig cochlea during cisplatin administration.A quantitative histological study[J].Hearing Res,2004,197:44.
12 費文彬, 丁海峰, 劉維榮,等.DPOAE監測一次性大劑量順鉑致豚鼠耳毒性的實驗研究[J]. 聽力學及言語疾病雜志,2006,14:357.
13 Watanabe KI, Hess A, Bloch W, et al. Nitric oxide synthase inhibitor suppresses the ototoxic side effect of cisplatin in guinea pigs[J].Anticancer Drugs, 2000,11:401.
14 Leonard PR,Craig AW.Ototoxicity: Therapeutic opportunities [J]. DDT,2005, 10:1 313.
15 Van den Berg JH, Beijnen JH, Balm AJM, et al. Future opportunities in preventing cisplatin induced ototoxicity [J]. Cancer Treatment Reviews,2006,32:390.
16 Leonard PR,Craig AW, Debashree M, et al. Mechanisms of cisplatin-induced ototoxicity and prevention[J]. Hearing Res,2007,,226:157.
17 Watanabe K, Tomiyama S, Jinnouchi K, et al. Expression of inducible nitric oxide synthase in the cochlea following immune response in the endolymphatic sac of guinea pigs[J]. ORL J Otorhinolaryngol Relat Spec, 2001,63:155.

