未折疊蛋白反應在強噪聲致豚鼠耳蝸細胞損傷過程中的作用
薛秋紅 陳小林 龔樹生 謝靜 陳佳 何堅
內質網是細胞加工蛋白質和儲存鈣離子的場所,許多理化因素可以導致未折疊或錯誤折疊蛋白質在內質網的蓄積以及細胞內鈣穩態的失衡,這種狀態稱為內質網應激,近年來有關內質網應激的信號通路與效應的研究已成為熱點。未折疊蛋白反應(unfolded protein response, UPR)是內質網應激激活的信號通路之一,UPR以位于內質網的分子伴侶如葡萄糖調節蛋白78(Bip/GRP78)顯著增加為特征,UPR激發Bip/GRP78高表達,通過協助蛋白質的折疊、裝配和運輸來維持內質網的穩定,保護細胞[1]。有研究表明 UPR在Alzheimer’s病等神經系統疾病的病理過程中有重要作用[2],但其在噪聲性聾方面的研究不多。本研究通過觀察強噪聲暴露后不同時期豚鼠耳蝸細胞UPR標志物Bip/GRP78的表達,探討UPR在噪聲暴露后豚鼠耳蝸細胞損傷過程中的作用。
1 材料與方法
1.1實驗動物 選用健康白色紅目雄性豚鼠48只,體重400~450 g,耳廓反射靈敏,鼓膜完整,無中耳炎,無耳毒性藥物應用史及噪聲接觸史。動物隨機分為6組,即健康對照組和噪聲暴露后3 h、1 d、4 d、14 d、30 d組,每組8只。適應性喂養1周,健康對照組不給噪聲暴露,后5組給予強噪聲暴露4 h。
1.2實驗方法
1.2.1噪聲刺激 噪聲由軟件4 kHz NBN-316 Hz BW-50 mV(解放軍總醫院耳鼻咽喉研究所自制并惠贈) 經筆記本電腦聲卡產生,經功率放大器放大傳至揚聲器,揚聲器置于80 cm×80 cm×85 cm的雙層隔音箱四角,實驗豚鼠置于35 cm×35 cm×50 cm的飼養籠中,自由進水。豚鼠活動范圍內聲強相差最大不超過5 dB。用HS6280型噪聲頻譜分析儀(中國江西國營紅聲器材廠)進行連續監測,測得噪聲頻率為中心頻率4 kHz的窄帶噪聲,聲級計測量噪聲強度為120 dB SPL,暴露時間為4 h。
1.2.2聽性腦干反應(ABR)檢測 對照組和噪聲暴露后各組豚鼠于相應時間點處死前行ABR檢測。動物以10%水合氯醛(30mg/kg)腹腔麻醉,在靜電屏蔽室內測試。采用Nicolet Compass 系統,刺激聲為click,重復率為20次/秒, 掃描周期10 ms,濾波帶寬100~3 000 Hz,信號疊加1 024次,以波Ⅲ為標準判斷反應閾。測試后處死動物,每組取4只豚鼠耳蝸作石蠟切片,余4只提取耳蝸總蛋白。
1.2.3耳蝸石蠟切片 動物以10%水合氯醛(30 mg/kg)腹腔麻醉后,仰臥固定,開胸暴露心臟,灌流沖洗,隨后灌注4%多聚甲醛磷酸緩沖液(pH 7.4)300~500 ml,快速斷頭取出雙側聽泡,兩窗灌注同種液體,放在4%多聚甲醛磷酸緩沖液中4 ℃下過夜,修剪后置入10%乙二胺四乙酸二鈉(pH 6.8)充分脫鈣3周左右。常規石蠟包埋,平行于蝸軸方向連續切片,片厚5 μm,烘干,室溫儲藏備用。
1.2.4Bip/GRP78免疫組化染色 耳蝸組織切片常規脫蠟至水,3% H2O2孵育10 min,蒸餾水沖洗;滴加抗原修復液1~3滴,孵育10 min,10%正常羊血清封閉20 min;滴加羊多抗Bip/GRP78(1:100稀釋,美國Santa Cruz公司產品)(其余試劑均由中山公司提供),4℃過夜(陰性對照用正常羊血清代替一抗);加生物素標記二抗,37 ℃孵育30 min,滴加SABC反應液1~2滴,37 ℃DAB顯色;Mayer蘇木素復染,梯度酒精脫水,透明、封片,顯微鏡(×400)觀察照相。Bip/GRP78染色陽性表現為胞漿/膜中有棕黃色顆粒分布。
1.2.5Western Blot檢測Bip/GRP78蛋白 處死動物,提取雙耳耳蝸總蛋白, 分別用10%SDS - PAGE凝膠電泳,轉膜,封閉1 h;加入羊多克隆Bip/GRP78抗體(1:400,為美國Santa Cruz公司產品,),抗β-actin單克隆抗體(1:400 ,Sigma,美國),4 ℃孵育24 h,洗膜(5 min,3次),加1:5 000辣根過氧化物酶標記的二抗孵育60 min,洗膜,顯色,曝光。
Bip/GRP78免疫組化染色切片由新9.0版HPIAS-100高清晰度彩色病理圖像免疫組化測量系統,在400倍視野下,測每組Corti器、螺旋神經節、側壁細胞染色的平均吸光度值。為減少誤差,固定對每張切片第2、3 回以上部位的細胞進行吸光度測定。在每組中隨機選擇400個受檢細胞做統計學處理,計算每組的平均吸光度值。Bip/GRP78蛋白條帶采用Kodak Digital Science ID 圖像分析系統(USA)進行光密度值測定,分別與以β-actin光密度值的比值代表Bip/GRP78蛋白表達的相對水平。
1.3統計學方法 應用SPSS11.5統計軟件,兩組間比較采用t檢驗,多組間比較采用單因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1ABR閾值 各組ABR閾值見表1。可見,與對照組比較,噪聲暴露后各組ABR閾值顯著升高,差異均有統計學差異(P<0.05)。

表1 各組豚鼠ABR反應閾(n=8只)
注:*與對照組比較,P<0.05
2.2Bip/GRP78免疫組織化學染色觀察結果 噪聲暴露后各組均可見Corti器、螺旋神經節及耳蝸側壁的細胞質/膜上有染色程度不等的棕黃色顆粒分布(圖1),正常對照組染色弱陽性。經圖像分析,各組Corti器、螺旋神經節及耳蝸側壁的Bip/GRP78蛋白免疫組化染色平均吸光度值見表2,噪聲暴露后各組Bip/GRP78蛋白Corti器、螺旋神經節及耳蝸側壁的平均吸光度值與對照組比較差異有統計學意義(P<0.01),暴露后30 d組與暴露后3 h、1 d、4 d、14 d組Bip/GRP78蛋白差異也有統計學意義(P<0.01),而暴露后3 h、1 d、4 d、14 d組間Bip/GRP78蛋白差異無統計學意義(P>0.05)。
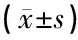
表2 各組豚鼠耳蝸各部位Bip/GRP78免疫組化染色的平均吸光度值(n=4只)
注:*與對照組同一部位比較,P<0.01;▲與暴露后3 h、1 d、4 d、14 d組同一部位比較,P<0.01

圖1 光鏡下耳蝸各部位Bip/GRP78的表達(免疫組化SP染色×400)a、b、c為暴露后3 h組的Corti器、側壁、螺旋神經節的Bip/GRP78免疫組化SP染色強陽性細胞(箭頭所示) ,d、e、f為對照組Corti器、側壁、螺旋神經節Bip/GRP78免疫組化SP染色弱陽性細胞(箭頭所示)
2.3Bip/GRP78蛋白的Western Blot檢測 Bip/GRP78蛋白的Western Blot法檢測蛋白變化條帶見圖2。可見暴露后各組表達明顯增高,而且在暴露后3 h、1 d、4 d、14 d組時達到高峰,30 d時減弱,對照組Bip/GRP78表達較少。經圖像分析并以Bip/GRP78蛋白與β-actin平均光密度比值進行統計學分析,結果暴露后各組與對照組差異有統計學意義(P<0.01),暴露后30 d組與暴露后3 h、1 d、4 d、 14 d組相比差異有統計學意義(P<0.01),但暴露后3 h、1 d、4 d、 14 d組間差異沒有統計學意義(P>0.05)。

圖2 Western Blot法檢測Bip/GRP78蛋白的變化
3 討論
Bip/GRP78又名免疫球蛋白重鏈結合蛋白,與熱休克蛋白70(Hsp70)家族具有高度同源性,存在于各類哺乳動物細胞的內質網腔中,是內質網標志分子伴侶,其表達上調是內質網應激反應的標志之一。近年來認為細胞受刺激時未折疊蛋白反應(UPR)激發Bip/GRP78高表達可能是細胞的一種重要的防御機制[1]。
目前對噪聲性聾的發病機制的研究較多,包括興奮性氨基酸毒性、鈣超載、氧化應激反應等,其中氧化應激、鈣超載與內質網應激關系密切[3]。強噪聲刺激作為一種應激源可引發內質網應激反應,而Bip/GRP78表達上調是內質網應激反應的標志之一。本研究結果顯示,噪聲暴露后3 h、1 d、4 d、14 d、30 d時豚鼠耳蝸Bip/GRP78的表達明顯高于正常對照組。Bip/GRP78的表達上調表明強噪聲誘導了耳蝸細胞的內質網應激反應,其機制可能是鈣超載和大量氧自由基生成的三磷酸腺苷消耗增加,非折疊蛋白反應加劇,Bip/GRP78蛋白合成在某種機制調控下加速,從而阻止進一步的內質網應激反應,當然其具體機制還需要進一步實驗證實。從文中結果看,在噪聲暴露后3 h到30 d,Bip/GRP78一直保持高表達,這可能與強噪聲暴露后耳蝸細胞發生次級損傷有關;Hu等[4]通過實驗證實強噪聲暴露后豚鼠耳蝸從暴露后1 d到14 d不斷有新的細胞損傷在發生,損傷的區域也在持續擴大;次級損傷的發生通過刺激耳蝸細胞Bip/GRP78的持續高表達,來阻止進一步或持久的內質網應激反應,對損傷不嚴重的細胞起保護作用,從而使其恢復正常功能。本研究中,豚鼠聽力損失在噪聲暴露后3 h最嚴重,而暴露后4 d到14 d聽力損失逐漸減輕,也證實Bip/GRP78的表達上調,維持了內質網鈣穩態及內環境的穩定,從而使大量損傷較輕的細胞逐漸恢復。因此,本文結果提示Bip/GRP78蛋白的高表達對強噪聲引起的耳蝸細胞損傷可能具有一定的保護作用,而且這種保護作用從暴露后3小時開始一直可以持續到暴露后30天,30天后由于強噪聲對內耳細胞損害逐漸減弱,Bip/GRP78蛋白的表達也相對減少。本實驗還發現,Bip/GRP78陽性細胞分布在毛細胞、耳蝸側壁及螺旋神經節細胞上,說明Bip/GRP78不僅對毛細胞起保護作用而且對整個內耳細胞都起保護作用;當然這種保護作用是相對的,UPR既誘導促細胞存活信號,又誘導促細胞凋亡信號,對受損嚴重的細胞,內質網應激反應會通過凋亡等方式清除這些細胞[5]。綜上所述,推測豚鼠強噪聲暴露后,啟動UPR保護機制,通過上調分子伴侶Bip/GRP78的表達,引導蛋白質正確折疊,降低細胞損傷,這可能是內耳細胞內源性保護機制之一。
4 參考文獻
1 Hayashi T, Saito A, Okuno S,et al. Induction of GRP78 by ischemic preconditioning reduces endoplasmic reticulum stress and prevents delayed neuronal cell death[J]. J Cereb Blood Flow Metab,2003,23:949.
2 Hoozemans JJ,Veerhuis R,Van Haastert ES,et al. The unfolded protein response is activated in Alzheimer/s disease[J]. Acta Neuropathol,2005,110:165.
3 Hayashi T, Saito A, Okuno S, et al. Induction of GRP78 by ischemic reconditioning reduces endoplasmic reticulum stress and prevents delayed neuronal cell death[J]. Cereb Blood Flow Metab,2003, 23:949.
4 Hu BH, Nicotera T, Henderson D. Involvement of apoptosis in progression of cochlear lesion following exposure to intense noise[J]. Hear Res, 2002,166:62.
5 薛秋紅,陳佳,龔樹生,等. Caspase-12在強噪聲誘導下豚鼠耳蝸細胞凋亡中的作用[J].中華耳鼻咽喉頭頸外科雜志, 2009,44:154.

