日本蟳血細胞及血液生化指標的研究
許星鴻, 閻斌倫, 鄭家聲, 邵營澤, 徐加濤, 徐國成, 周 盟, 周 黎
(1. 淮海工學院 江蘇省海洋生物技術重點建設實驗室, 江蘇 連云港 222005; 2. 中國海洋大學 海洋生命學院, 山東 青島, 266003)
日本蟳血細胞及血液生化指標的研究
許星鴻1, 閻斌倫1, 鄭家聲2, 邵營澤1, 徐加濤1, 徐國成1, 周 盟1, 周 黎1
(1. 淮海工學院 江蘇省海洋生物技術重點建設實驗室, 江蘇 連云港 222005; 2. 中國海洋大學 海洋生命學院, 山東 青島, 266003)
以光鏡和電鏡觀察了日本蟳(Charybdis japonica)血細胞的形態結構, 分析了各類血細胞的大小、數量比例及功能, 并測定了不同發育時期及饑餓狀態的日本蟳血清主要生化指標。結果表明: 日本蟳血細胞可分為4種類型, 從小到大依次為: 無顆粒細胞、小顆粒細胞、中間型細胞和大顆粒細胞; 其核質比分別為: 53.23%、33.64%、24.50%和19.45%; 數量比例分別為: 4.78%、42.69%、36.57%和15.96%。雌蟹血細胞密度顯著高于雄蟹, 而細胞大小在不同性別之間差異不顯著。吞噬能力從強到弱依次為中間型細胞、大顆粒細胞和小顆粒細胞, 無顆粒細胞無吞噬能力。鰓中血細胞表現出更為活躍的吞噬作用。生長期雌蟹血清中總蛋白、葡萄糖和總膽固醇含量均高于雄蟹, 成熟期雄蟹血清總蛋白含量高于雌蟹。雌蟹抱卵后, 血清中維持較高的總蛋白和總膽固醇水平。饑餓 7 d的日本蟳血細胞密度及血清總蛋白、葡萄糖、總膽固醇含量明顯下降, 谷丙轉氨酶、堿性磷酸酶等酶活性顯著降低, 而肌酐和尿素氮含量明顯增加, 日本蟳血清中含有球蛋白。
日本蟳(Charybdis japonica); 血細胞; 血液生化指標; 吞噬能力; 饑餓
甲殼動物缺乏脊椎動物的特異性免疫機制, 其免疫防御反應是通過血細胞的吞噬、包掩、凝集和溶菌等作用于病原體, 同時血細胞受此激發而釋放出多種免疫因子于血漿中, 在兩者共同作用下達到免疫效果[1-2]。因此, 甲殼動物血淋巴的研究對于養殖生產中的病理診斷及病害防治工作具有重要的參考意義。日本蟳(Charybdis japonica)隸屬于甲殼綱(Crustacea)梭子蟹科(Portunidae), 俗稱靠山紅、石閘蟹等, 廣泛分布于中國各海區[3], 為經濟價值較高的海產蟹類[4]。關于日本蟳血液學的研究已有一些報道, 趙青松等[5]對 東海產日本蟳血細胞的形態及數量做了初步研究, 張紅霞等[6]分析了重金屬離子對日本蟳血淋巴抗氧化酶活力的影響, 樊廷俊等[7]分 離純化了日本蟳血藍蛋白, 并研究了脂多糖等免疫促進劑對日本蟳酚氧化酶活性及血細胞的影響[8]。本實驗 采用光鏡和電鏡對日本蟳血細胞進行了細致觀察, 分析了各類血細胞的大小、數量比例及功能,并對不同發育時期及饑餓狀態的日本蟳血清主要生化指標進行了測定, 以豐富該領域的基礎資料,為日本蟳的組織病理、病害防治及繁殖生理等研究提供依據。
1 材料與方法
1.1 材料
實驗用日本蟳分批購買于連云港海產品市場:生長期雌、雄各 10只, 取材于 3月上旬, 體質量(69.53±8.47)g; 成熟期雌、雄各60只, 取材于5月上旬, 體質量(110.28±13.39)g; 抱卵蟹 10只, 取材于 5月下旬, 體質量(93.72±7.15)g。發育分期方法另文發表[9]。采用生態閉路循環養殖系統暫養7 d后用于實驗, 鹽度25, pH8.0, 水溫15℃, 連續充氣, 一日投喂 2次鮮活貝類。饑餓實驗組選取成熟期日本蟳, 雌雄各半, 除不投喂外, 其他暫養條件相同。下述實驗材料未標明發育時期者均取自成熟期。
1.2 方法
1.2.1 血樣采取與計數
用無菌注射器先吸取 10%海水甲醛[5]0.2 mL,再從日本蟳第三步足基關節處抽取等量血液, 充分混勻后, 用血球計數板計數, 計算出血細胞密度。雌蟹、雄蟹及饑餓實驗組測定數均為10只。
1.2.2 血涂片制作、觀察與測量
以抗凝劑和血液的等量混合液按常規法涂片。采用 ACD-福爾馬林混合液[10]作抗凝劑, 瑞-姬混合染色液[11]染色10 min, 血涂片于Nikon E1000顯微鏡下觀察、攝影。雌、雄蟹測定數均為10只, 每只蟹制作血涂片3張。每張涂片隨機選取約200個血細胞進行分類計數[10], 對不同的血細胞隨機選取20個,進行細胞體和細胞核的測量。核質比按下列公式計算: 核質比=(平均核長徑×平均核短徑)/(平均細胞長徑×平均細胞短徑)。
1.2.3 超微結構觀察
電鏡觀察材料取自成熟期雌蟹。取血方法同1.2.1, 抽取0.5 mL血液, 注入已裝有0.5 mL 4%戊二醛的離心管中, 輕搖使其混勻, 2 000 r/min離心5 min, 棄上清, 再加入新的4%戊二醛預固定(4℃),1%鋨酸后固定, 梯度乙醇脫水, Epon812環氧樹脂包埋。LKB-Nova超薄切片機切片, 醋酸鈾和檸檬酸鉛雙染色, 日本電子JEM-1200EX型透射電鏡觀察、攝影。另取鰓, 切成 1 mm3組織塊, 制作超薄切片, 透射電鏡觀察血細胞在機體器官內的自然生理狀態。
1.2.4 血細胞吞噬能力的研究
實驗用大腸桿菌(Escherichia coli)和節桿菌(Arthrobacter)由淮海工學院微生物實驗室提供。將菌種分別接種在營養瓊脂培養基上, 30℃培養48 h, 無菌生理鹽水洗下后, 配成濃度為108個/mL的菌懸液,4℃貯存備用。取雌、雄蟹各5只, 以ACD為抗凝劑等比分別從各蟹取0.5 mL血液后混合均勻。取1 mL該混合液, 加入100 μL菌懸液, 混勻后于30℃孵育1 h。常規涂片, 鏡檢計數。吞噬率=有吞噬作用的血細胞數/隨機選取的100個血細胞×100%, 各類血細胞吞噬率=有吞噬作用的各類血細胞數/隨機選取的100個有吞噬作用的血細胞總數×100%。
1.2.5 血液生化指標測定
分別對生長期、成熟期、已抱卵和饑餓7 d的日本蟳血液生化指標進行測定, 各期測定數均為10只(饑餓實驗組為雌、雄各5只)。用無菌注射器于每只蟹各抽取1.5~2 mL血液, 4℃放置1 h后, 5 000 r/min冷凍離心15 min, 取上清液, 采用BECKMAN CX5全自動生化分析儀測定。
1.3 數據處理
各實驗均重復3次, 實驗數據用“平均數±標準差”表示。采用SPSS16.0軟件進行數據處理, 并進行t檢驗或單因子方差分析(One-way ANOVA), LSD多重比較和Duncan檢驗。
2 結果
2.1 日本蟳的血細胞密度
成熟期雌性日本蟳血細胞密度為(3.75±0.56)×107個/mL, 顯著高于雄蟹的(2.48±0.43)×107個/mL,平均(3.11±0.81)×107個/mL。饑餓7 d后, 雌、雄蟹的血細胞密度均明顯下降, 分別為(1.33±0.36)×107個/mL 和(0.79±0.24)×107個/mL, 平均(1.06±0.41)×107個/mL。
2.2 日本蟳血細胞的分類及形態
通過對光鏡和透射電鏡所觀察到的圖像分析,根據細胞質中顆粒的有無、大小、折光性、染色特性及核質比, 將日本蟳血細胞分為4種類型: 無顆粒細胞、小顆粒細胞、中間型細胞和大顆粒細胞。
2.2.1 無顆粒細胞
光鏡下無顆粒細胞多為圓形或橢圓形, 核質比大, 平均可達 53.23%。一薄層淡藍色細胞質圍繞著藍紫色細胞核, 胞質中沒有明顯顆粒, 但含有一些深藍色絮狀物(圖1-1)。
電鏡觀察可見, 細胞核內異染色質呈斑塊狀,緊貼核膜內側, 核仁1~2個、體積較大。胞質中有少量體積較小的線粒體和液泡, 游離核糖體含量豐富(圖 1-2)。
2.2.2 小顆粒細胞
光鏡下觀察, 小顆粒細胞以橢圓形為主, 也見有近三角形。細胞質比無顆粒細胞略多, 核質比平均為 33.64%。胞質中有少量藍色小顆粒, 沒有折光性(圖 1-3)。
超微結構顯示, 細胞質中的顆粒形狀各異, 有圓形、橢圓形、棒狀及啞鈴狀等; 大小不等, 多介于0.1~0.3 μm。小顆粒電子密度較低。胞質中有較多的液泡, 線粒體體積較大。異染色質也多靠近核膜分布, 但沒有無顆粒細胞的集中(圖1-4)。
2.2.3 中間型細胞
光鏡下中間型細胞體積較大, 多為橢圓形, 也有呈梨形、梭形。細胞核常偏于細胞一側, 且核質比較小, 平均24.50%。細胞質中既有較大的藍色顆粒,也有紅棕色的小顆粒, 多數顆粒具有折光性(圖1-5)。
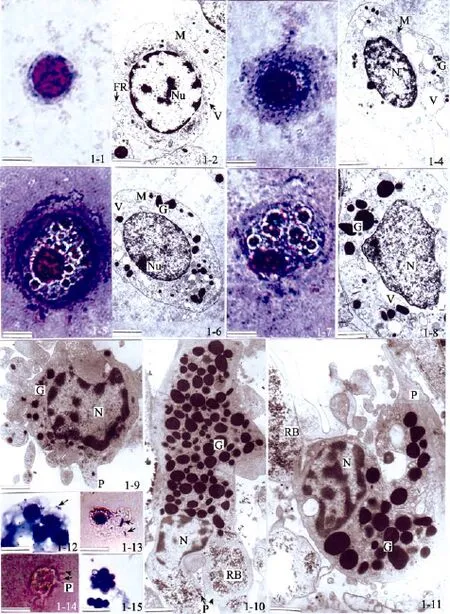
圖1 日本蟳血細胞的光鏡及電鏡觀察Fig. 1 Hemocytes in crab Charybdis japonica under light and electron microscope
電鏡下觀察, 細胞質中的顆粒數量比小顆粒細胞多, 大小從0.1~0.9 μm不等, 大、小顆粒的數量比例相當。胞質中還含有豐富的線粒體、液泡及游離核糖體, 糙面內質網主要分布在核外膜附近。核內染色質以常染色質為主, 核仁1個、位置靠近核膜(圖1-6)。
2.2.4 大顆粒細胞
光鏡下觀察, 大顆粒細胞形態多樣, 有橢圓形、子彈形及不規則形。細胞核偏于細胞一側, 平均核質比僅 19.45%。細胞質中的顆粒多數染成藍色, 體積大且折光性強, 也含有少量紅色小顆粒(圖1-7)。
超微結構顯示, 細胞質中的顆粒絕大多數在 0.5 μm以上, 最大顆粒長徑可達1.1 μm。其他特征類似于中間型細胞, 但胞質中的液泡體積較大(圖1-8)。
2.2.5 鰓中的血細胞形態
鰓中的血細胞也能明顯分成上述 4種類型, 但與抽取外周血離心得到的血細胞相比, 除無顆粒細胞形態相似外, 3種有顆粒細胞的形態結構均有一定差異。小顆粒細胞(圖 1-9)形狀不規則, 向四周伸出數個短小的偽足, 部分偽足中也包含著小顆粒; 核質分布特點與前述相同, 但核形狀較不規則。中間型細胞(圖1-10)和大顆粒細胞(圖1-11)均伸出粗大的偽足, 進行著吞噬作用。這兩類細胞的胞質中基本不含有前述的液泡, 但有體積較大的殘余體; 顆粒明顯增多, 尤其中間型細胞中的顆粒數量增加了近兩倍,占據了細胞大部分空間。
2.3 日本蟳血細胞的大小與數量比例
從表1可見, 日本蟳4種類型血細胞從小到大依次為: 無顆粒細胞、小顆粒細胞、中間型細胞和大顆粒細胞, 除了雄蟹無顆粒細胞的長徑明顯大于雌蟹之外, 細胞大小在不同性別之間差異不顯著。4類血細胞所占的數量比例從大到小依次為: 小顆粒細胞、中間型細胞、大顆粒細胞和無顆粒細胞, 雌蟹的小顆粒細胞明顯少于雄蟹, 而大顆粒細胞比雄蟹的多, 無顆粒細胞和中間型細胞數量比例的性別差異不顯著。
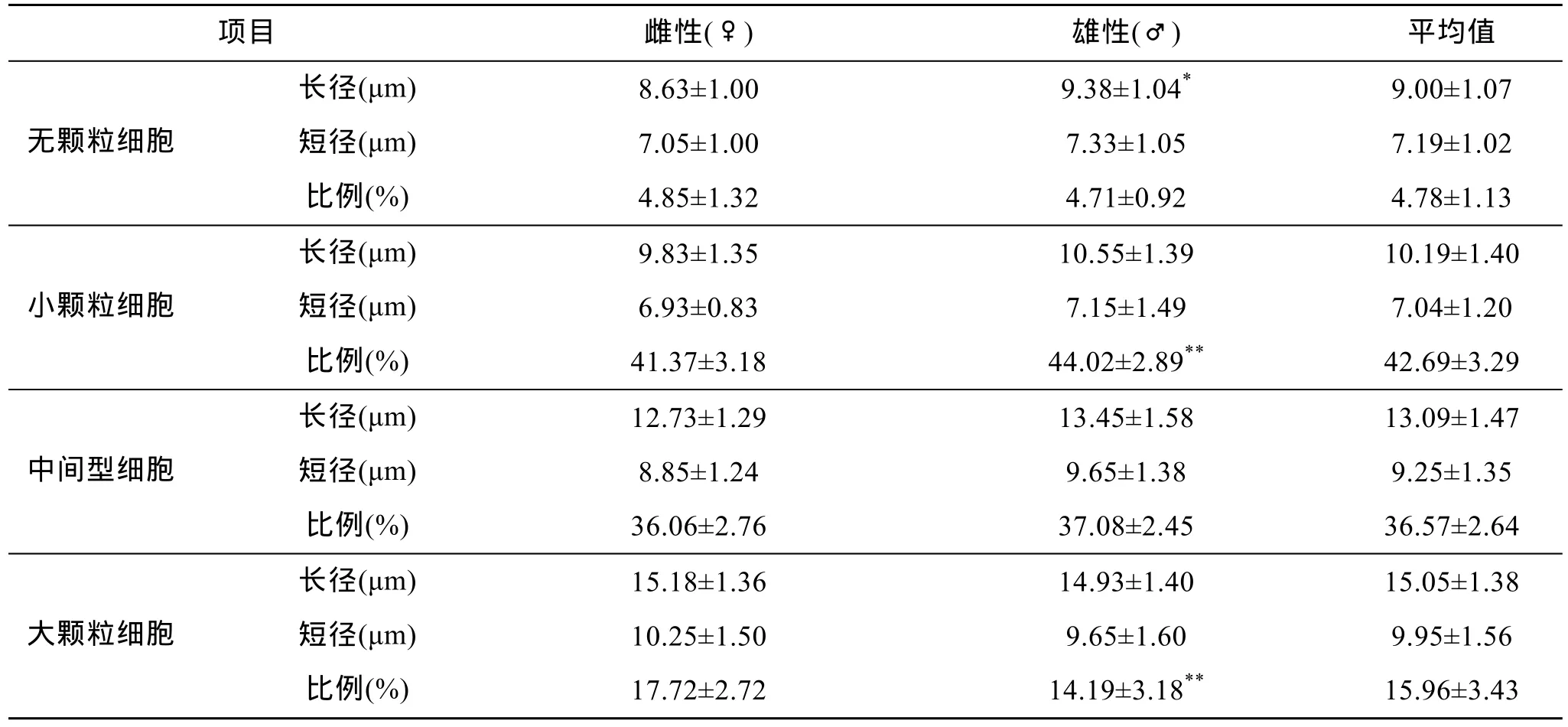
表1 日本蟳血細胞的大小與數量比例Tab. 1 The sizes and percentages of hemocytes in Charybdis japonica
2.4 日本蟳血細胞的吞噬能力
在血細胞和細菌體外孵育實驗中, 可以觀察到在細菌的刺激下, 日本蟳血細胞對細菌的吸附(圖1-12)、吞噬(圖1-13, 1-14)及血細胞之間的凝集現象(圖1-12, 1-15)。沒有觀察到無顆粒細胞的吞噬現象。
在30℃、1 h的反應時間內, 日本蟳血細胞對大腸桿菌和節桿菌的菌懸液的吞噬率分別為62.33%和52.93%。以中間型細胞吞噬能力最強, 在所有發生吞噬作用的血細胞中, 對兩種菌懸液的吞噬率分別為54.87%和52.13%; 其次是大顆粒細胞, 吞噬率分別為 27.40%和 29.54%; 小顆粒細胞的吞噬能力相對較低, 吞噬率分別為17.73%和18.33%。
2.5 日本蟳的血液生化指標
由表2可知, 日本蟳從生長期到成熟期, 血清中總蛋白、葡萄糖、總膽固醇、肌酐和尿酸等含量升高, 谷丙轉氨酶和谷草轉氨酶活性增強, 而尿素氮含量減少, 堿性磷酸酶活性有所下降。在生長期, 雌蟹血清的總蛋白、葡萄糖和總膽固醇含量均高于雄蟹。當發育至成熟期, 雄蟹血清的總蛋白含量反而高于雌蟹, 但雌蟹血清的葡萄糖和總膽固醇含量依然顯著高于雄蟹。雌蟹抱卵后, 血清中葡萄糖、甘油三酯、高密度脂蛋白含量顯著降低, 而總蛋白、低密度脂蛋白、肌酐含量升高。饑餓 7 d 的日本蟳血清總蛋白、葡萄糖、總膽固醇含量明顯下降, 谷丙轉氨酶、堿性磷酸酶等酶活性顯著降低, 而肌酐和尿素氮含量明顯增加。
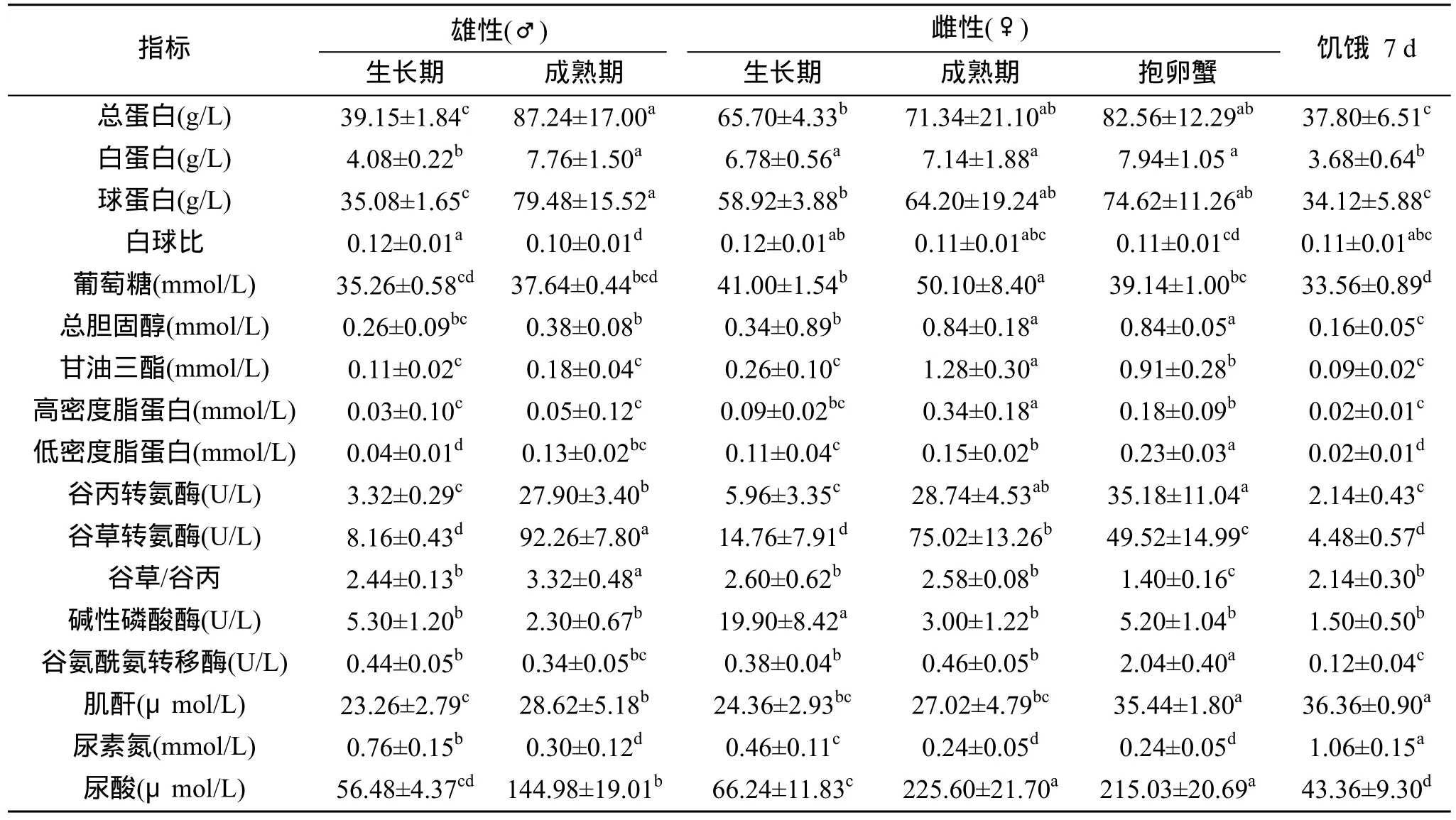
表2 不同性別和發育階段及饑餓7 d的日本蟳血液生化指標Tab. 2 Blood biochemical indices of male and female at different development stages in Charybdis japonica and the effects of starvation(mean±S.D)
3 討論
3.1 日本蟳血細胞的類型、結構與功能
目前對甲殼動物血細胞的分類方法主要有兩種:一種是分3類[12-14]-透明細胞(或無顆粒細胞)、半顆粒細胞(或小顆粒細胞)和顆粒細胞(或大顆粒細胞);另一種是分 4類[10,15]-無顆粒細胞、小顆粒細胞、中間型細胞和大顆粒細胞。趙青松等[5]通過顯微觀察,將東海產日本蟳的血細胞分成了無顆粒細胞、小顆粒細胞和大顆粒細胞 3種類型, 本研究認為黃海產日本蟳的血細胞除了這 3類血細胞外, 還存在著一種中間型細胞, 其顆粒大小從0.1~0.9 μm不等, 分別與小顆粒細胞和大顆粒細胞中的顆粒相似, 同周凱等[10]對鋸緣青蟹及陸宏達等[15]對中華絨螯蟹的血細胞研究結論一致。
脊椎動物 B淋巴細胞在接觸抗原后, 會多次分裂并分化為漿細胞, 產生免疫球蛋白, 參與機體體液免疫[16]。陳平等[17]在研究對蝦時發現了類似細胞的存在, 稱之為“漿樣細胞”, 認為其能合成原始的免疫球蛋白,具有體液免疫的萌芽。日本蟳無顆粒細胞“核質比大”的特征類似于脊椎動物的淋巴細胞,同時又具有漿細胞的特點-細胞核內異染色質呈斑塊狀、核糖體豐富, 且缺乏吞噬能力, 其功能值得深入研究。
3類顆粒細胞均具有吞噬功能。從體外的血細胞和細菌孵育實驗結果看, 以中間型細胞吞噬能力最強, 其次是大顆粒細胞、小顆粒細胞的吞噬能力相對較低。小顆粒細胞伸出的偽足較短小, 說明其主要是吞噬較小的物質。中間型細胞和大顆粒細胞的偽足粗大, 且胞質內含較多的液泡和消化殘體, 結構特征與其較強的吞噬功能相符。
在細菌的刺激下, 可以觀察到日本蟳血細胞對細菌的吸附及血細胞凝集成團的現象。Smith等[18]認為甲殼類動物的血細胞在未受到感染等刺激的情況下, 大多數免疫因子如抗細菌蛋白、酚氧化酶等在血細胞內處于非活性狀態, 受到感染等刺激后通過調節血細胞內物質的釋放, 使這些免疫因子激活,從而影響著血細胞團的形成和包裹的作用。日本蟳通過血細胞的凝集, 對細菌進行吸附、包裹和吞噬,使細菌得以清除,顯示了日本蟳血細胞具有的非特異性免疫功能。
與從步足基部取得的血細胞相比, 日本蟳鰓中的血細胞表現出更為活躍的吞噬作用。鰓作為呼吸器官, 鰓腔中的血竇與外界水環境只隔著一層上皮細胞, 極易受到水體中細菌等病原的侵襲, 所以鰓中血細胞較強的吞噬功能構成了蟹體抗感染的重要防線。
3.2 日本蟳血液生化指標
對甲殼動物血液生化指標的研究報道較少。和三疣梭子蟹(Portunus trituberculatus)[19]相比, 日本蟳血清中的總蛋白、血糖和肌酐等含量較高, 酶活性較低, 兩者總膽固醇、尿素氮的含量相近。
血漿中總蛋白及白蛋白等指標可反應機體營養和代謝狀態[20]; 膽固醇是皮質類激素和性激素的前體, 和機體物質代謝、性腺發育密切相關[21]; 血糖水平則受棲息環境、活動性及餌料等多種因素的影響[22]。處于生長期的雌性日本蟳血清中總蛋白、葡萄糖和總膽固醇含量均高于雄蟹, 表明雌蟹性腺發育時, 機體的代謝比雄蟹旺盛, 且需要更多的營養物質, 這和卵母細胞發育、卵黃大量合成積累有關。發育至成熟期, 由于卵母細胞內對蛋白質的貯存,造成雄蟹血清的總蛋白含量反而高于雌蟹, 但雌蟹較高的血糖和總膽固醇含量可以保證其繁殖活動對能量的需求及較高的激素水平。日本蟳為分批產卵類型, 雌蟹抱卵后, 血清維持較高的總蛋白和總膽固醇含量可以給卵巢的進一步發育提供充足的營養來源。
中華絨螯蟹(Eriocheir sinensis)雌性血淋巴總蛋白水平成熟后會顯著下降[23], 而本研究發現雌性日本蟳成熟后的血清總蛋白會略有升高, 可能與種類差異有關。一般認為甲殼動物體液不具有免疫球蛋白, 缺乏抗體介導的免疫反應[2]。本實驗在日本蟳血清中測出了球蛋白, 三疣梭子蟹的血清中也發現有球蛋白[19]。隨著生長發育的進展, 日本蟳血清中球蛋白含量有一定升高, 其球蛋白特性及免疫機制有待于進一步研究。
3.3 饑餓對日本蟳血液的影響
日本蟳饑餓 7 d后, 血清總蛋白、球蛋白、葡萄糖、總膽固醇含量及血細胞密度等明顯下降, 谷丙轉氨酶、堿性磷酸酶等酶活性亦顯著降低, 表明其代謝強度及免疫力均減弱。魚類饑餓后的血液生化指標變化規律有一定差異, 奧利亞羅非魚(Oreochromis aureus)饑餓 1周后紅細胞、葡萄糖和甘油三酯含量下降顯著, 但血清總蛋白下降不明顯, 至饑餓2周后才顯著下降[24]; 而鱸魚(Lateolabrax japonicus)饑餓1周后的血清總蛋白甚至有所增加, 第2周回落, 至第4周才顯著下降[25]。這可能是因為魚類比蟹類貯存有較多的糖原和脂肪, 饑餓時動物首先動用的是血糖,然后是脂類, 最后是蛋白, 所以饑餓初期魚類的血清總蛋白含量沒有明顯下降。肌酐是肌酸和磷酸肌酸代謝最終產物, 其含量與肌肉活動量相關[20]。饑餓后的日本蟳血清中肌酐含量升高, 可能是其覓食活動增加所致。
[1]Soderhall K, Cerenius L. Crustacean immunity[J].Ann Rev Fish Dis, 1992, 2: 3-23.
[2]徐海勝, 徐步進. 甲殼動物細胞及體液免疫機理的研究進展[J]. 大連水產學院學報, 2001, 16(1): 49-56.
[3]梁象秋, 方紀祖, 楊和荃. 水生生物學[M]. 北京: 中國農業出版社, 1996: 360.
[4]王春琳, 陳建青, 葉曉園, 等. 日本蟳的營養成分組成分析[J]. 營養學報, 2005, 27(1): 81-83.
[5]趙青松, 陳惠群, 王春琳, 等. 日本蟳血淋巴細胞的初步研究[J]. 水利漁業, 2005, 25(3): 13-14.
[6]張紅霞, 潘魯青, 劉靜. 重金屬離子對日本蟳血淋巴抗氧化酶(SOD, CAT, GPx)活力的影響[J].中國海洋大學學報, 2006, 36(增刊): 49-53.
[7]Fan T J, Zhang Y N, Yang L L, et al. Identification and characterization of a hemocyanin- derived phenoloxidase from the crabCharybdis japonica[J]. Comparative Biochemistry and Physiology, Part B 2009, 152:144-149.
[8]樊廷俊, 于苗苗, 楊玲玲, 等. 四種免疫促進劑對日本蟳酚氧化酶和血細胞的影響[J]. 中國海洋大學學報, 2009, 39(3): 421-428.
[9]許星鴻, 閻斌倫, 鄭家聲, 等. 日本蟳的性腺發育和生殖周期[J]. 海洋湖沼通報, 2010, 39(3): 29-36.
[10]周凱, 房文紅, 喬振國. 鋸緣青蟹血細胞的形態及分類[J]. 中國水產科學, 2006, 13(2): 212-216.
[11]周暉, 陳剛. 魚類和蝦蟹血細胞染色方法[J]. 海洋與漁業, 2006, 7: 14-36.
[12]Bauchau A G. Crustaceans.Invertebrate blood cells[M].New York: Academic Press, 1981: 2 385-2 420.
[13]葉燕玲, 陳寬智. 中國對蝦血細胞超微結構、分類及計數[J]. 青島海洋大學學報, 1993, 23(2): 35-42.
[14]李廣友, 王青. 中國對蝦血細胞及其免疫研究[J]. 海洋與湖沼, 1995, 22(6): 591-560.
[15]陸宏達. 中華絨螯蟹血細胞的顯微、亞顯微形態結構及分類[J]. 水生生物學報, 2002, 26(5): 494-500.
[16]李霞. 水產動物組織胚胎學[M]. 北京: 中國農業出版社, 2006: 33, 54.
[17]陳平, 黃槐, 池信才, 等. 四種對蝦血細胞組成及超微結構[J]. 水生生物學報, 1998, 22(2): 158-163.
[18]Smith V J, Brown J H, Hauton C. Immunostimulation in crustacean: does it really protect against infection[J].Fish Shellfish Immunol, 2003, 15: 71-79.
[19]陳惠群, 金珊, 王國良, 等. 三疣梭子蟹血淋巴細胞及血液生化指標的初步研究[J]. 水產科學, 2004,23(6): 1-4.
[20]劉紅柏, 黃江, 馬愛枝, 等. 中草藥復方添加劑對施氏鱘生長及血液生化指標的影響[J]. 水產學雜志,2009, 22(3): 14-19.
[21]沈同, 王鏡巖. 生物化學[M]. //北京: 高等教育出版社, 1996. 200.
[22]張濤, 章龍珍, 趙峰, 等. 基于血液生化指標判別分析西伯利亞鱘性別及卵巢發育時期[J]. 中國水產科學, 2007, 14(2): 236-246.
[23]吳敏嘉, 姜耀新. 中華絨螯蟹血淋巴和肝胰腺的總蛋白含量與性早熟的關系[J]. 水產學報, 2000, 24(4):306-311.
[24]駱作勇, 王雷, 王寶杰, 等. 不同投喂模式對奧利亞羅非魚血液生化指標與生長性能的影響[J]. 中國水產科學, 2007, 14(5): 743-748.
[25]錢云霞, 陳惠群, 孫江飛, 等. 饑餓對養殖鱸魚血液生理生化指標的影響[J]. 中國水產科學, 2002, 9(2):133-137.
Hemocytes and blood biochemical characterization ofCharybdis japonica
XU Xing-hong1, YAN Bin-lun1, ZHENG Jia-sheng2, SHAO Ying-ze1, XU Jia-tao1,XU Guo-cheng1, ZHOU Meng1, ZHOU Li1
(1. Jiangsu Key Laboratory of Marine Biotechnology, Huaihai Institute of Technology, Lianyungang 222005, China;2. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China)
Jun., 26, 2010
Charybdis japonica; hemocyte; blood biochemical value; phagocytic capacity; starvation
In order to provide data for tissue pathology, disease control, and reproductive physiological research ofCharybdis japonica, this paper reported the hemocytes and the blood biochemical characterization ofCharybdis japonica. With light and electronic microscopes, four types of hemocytes, including agranular hemocyte (AG), small granular hemocyte (SG), intermediate granular hemocyte (IG) and large granular hemocyte (LG), were classified according to their granular existence, granular size, refractivity, staining characters, and nuclear-cytoplasmic ratio. The nuclear-cytoplasmic ratios were 53.23%(AG), 33.64%(SG), 24.50%(IG) and 19.45% (LG), respectively. Among these hemocytes, the percentages of AG, SG, IG and LG were 4.78%, 42.69%, 36.57%, and 15.96%, respectively. The female crab had higher density of hemocytes than the male, but there was no significant difference in cell size. The phagocytic capacity of hemocytes from strong to weak were IG, LG and SG. AG had no phagocytic capacity. The hemocytes in gill had big pseudopodia and abundant residual body suggesting they could be more active in phagorytosis. In the developing phase, the values of total protein(TP), glucose(GLU) and cholesterin(CHOL) of female were higher than those of male,but the male crabs in maturation had more TP than the female. After spawning, the female crabs could maintain high levels of TP and CHOL. After starvation for seven days, the values of density of hemocytes, TP, GLU,and CHOL decreased obviously and there were lower activities of alanine aminotransferase(ALT) and alkaline phosphatase(ALP) than before, but the levels of creatinine(CREA) and usea nitrogen(BUN) increased. Globin was found in the blood serum ofCharybdis japonica.
Q959.223
A
1000-3096(2011)08-0051-07
2010-06-26;
2011-08-21
江蘇省海洋生物技術重點建設實驗室開放課題(Z2007HS006); 江蘇省科技廳蘇北科技發展計劃項目(BN2010026)
許星鴻(1970-), 女, 江蘇省泰興人, 副教授, 碩士, 主要從事海洋動物發育生物學研究, 電話: 0518-85835092, E-mail:xhxu119@163.com
致謝:中國海洋大學海洋生命學院姜明老師和青島醫學院電鏡室譚金山老師對本工作給予大力支持和幫助, 謹致謝忱。
譚雪靜)

