嗜水氣單胞菌Hcp蛋白的原核表達?多克隆抗體制備及生物信息學分析
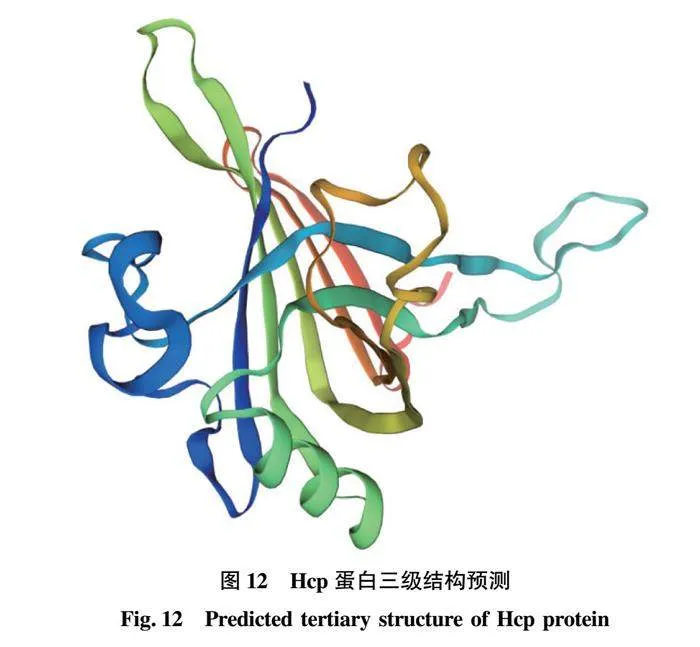
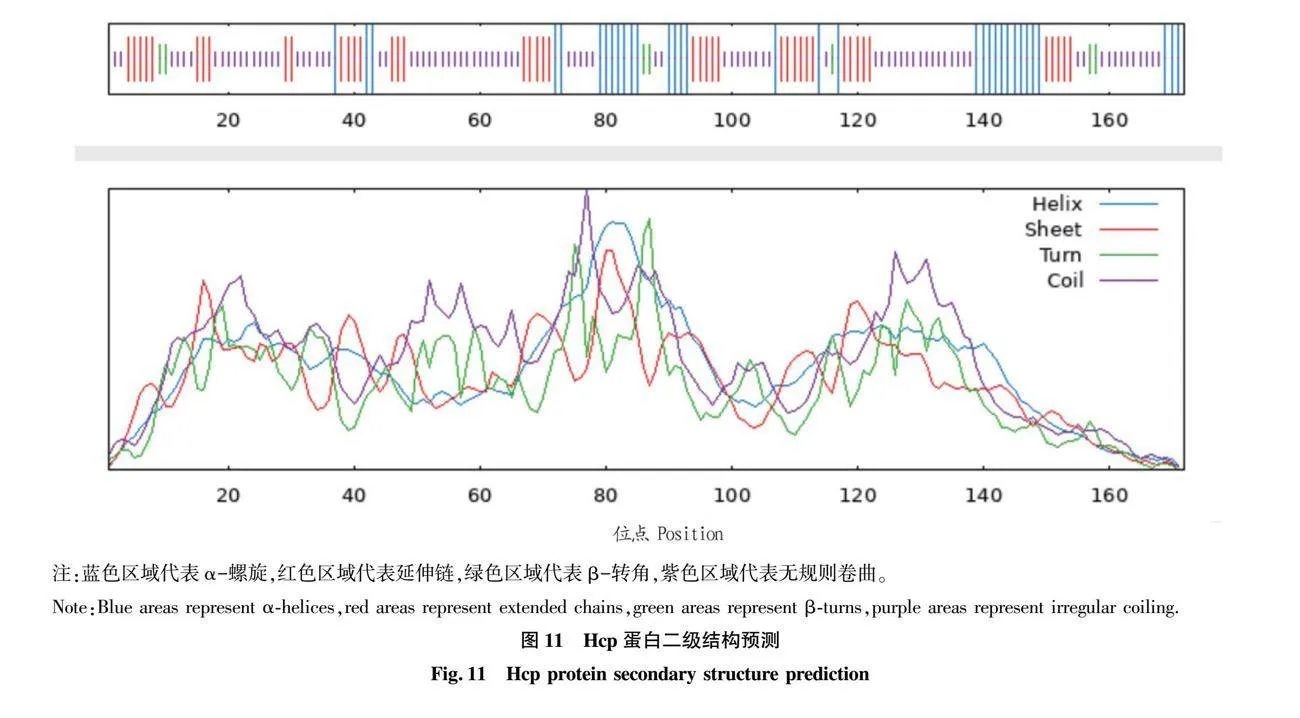
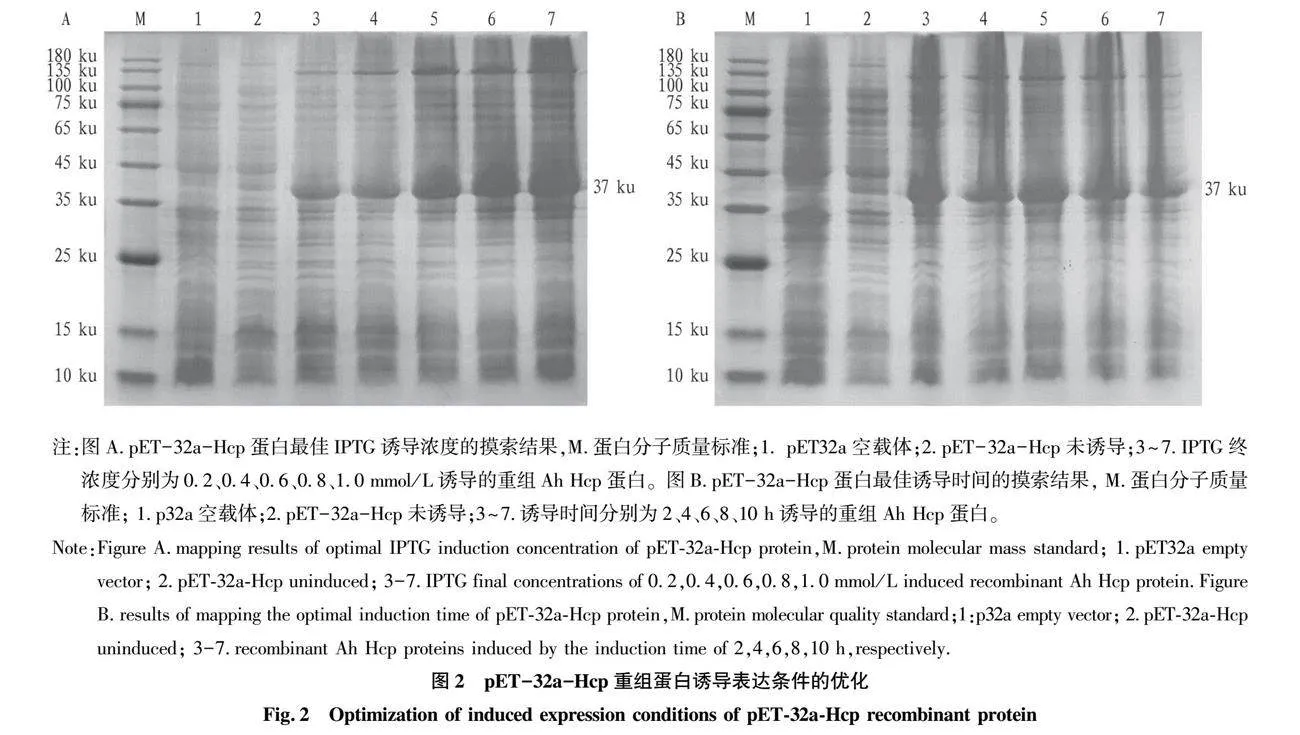
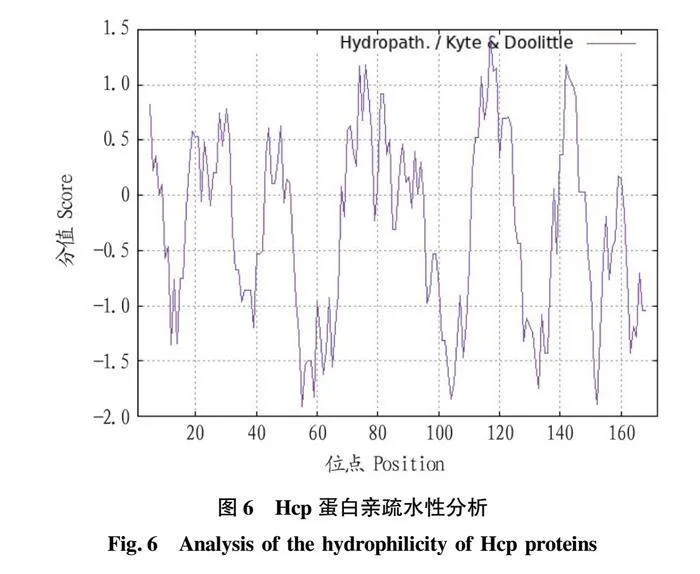
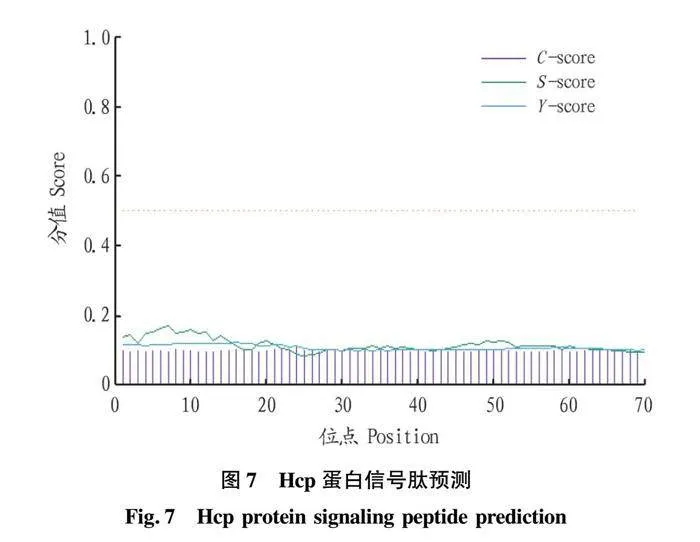
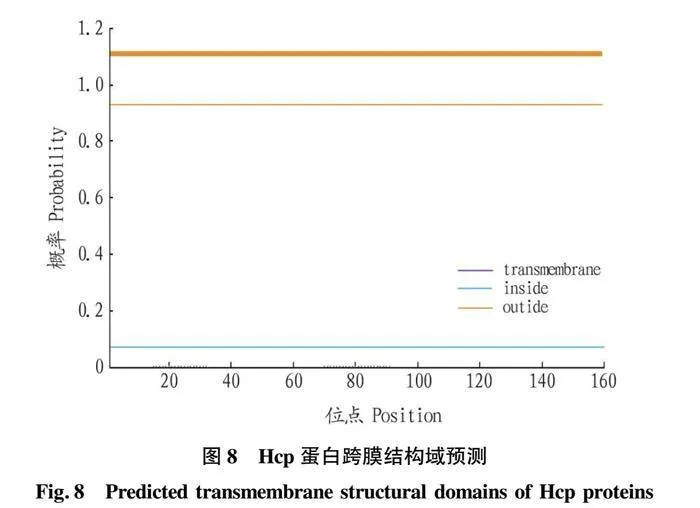

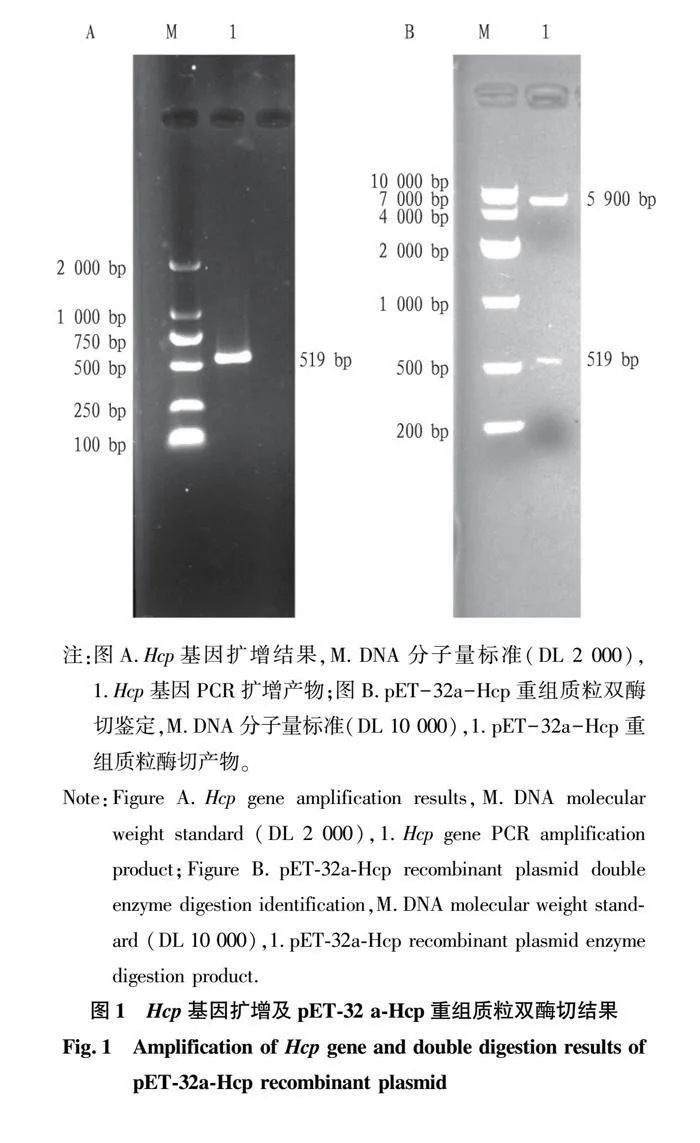
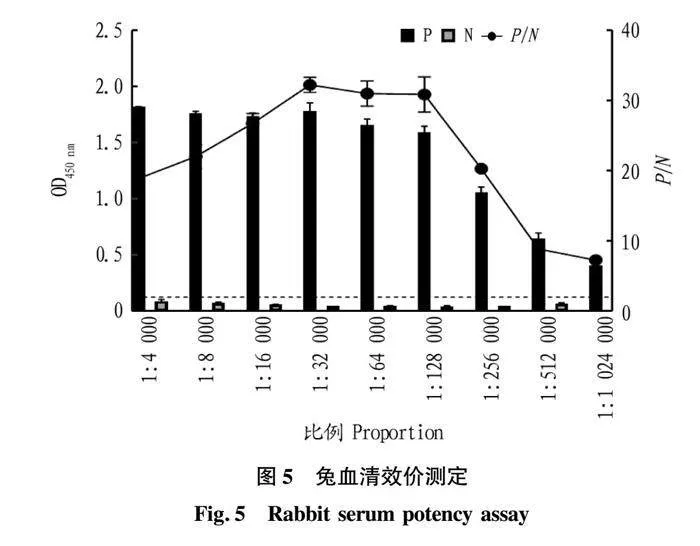
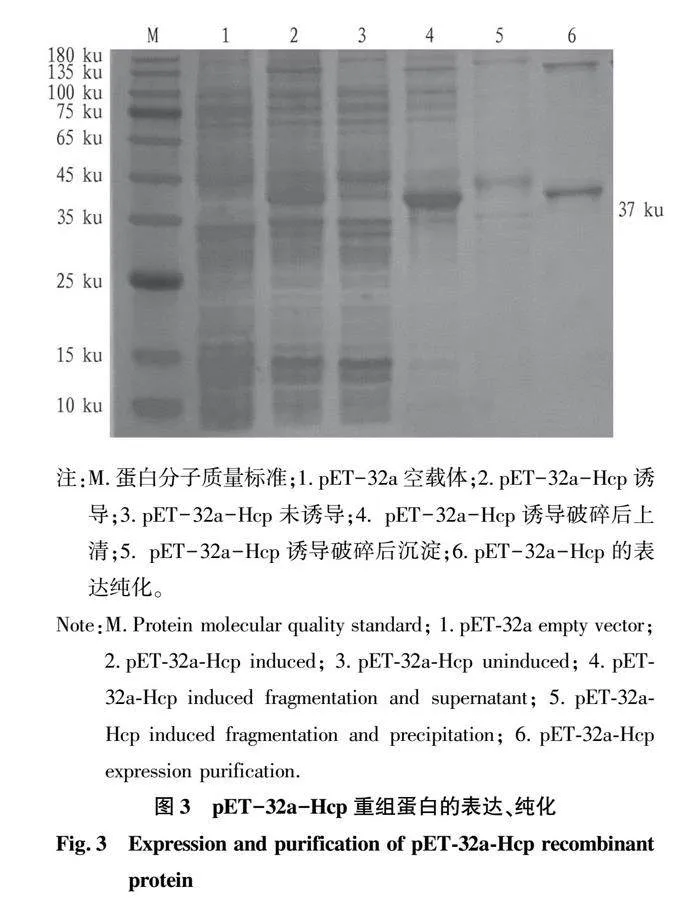

摘要 [目的]獲得嗜水氣單胞菌(Aeromonas hydrophila,AH)Hcp蛋白的多克隆抗體(Polyclonal Antibody)及基本生物學特性。[方法]利用RT-PCR方法擴增Hcp基因,構建重組表達質粒后轉化BL21感受態細胞,經IPTG(異丙基硫代半乳糖苷,Isopropyl β-D-Thiogalactoside)誘導表達獲得Hcp重組蛋白,純化后免疫家兔,制備針對該蛋白的多克隆抗體,進行抗體的效價測定、Western blotting鑒定,利用生物信息學在線工具對其基本理化性質、保守結構域、磷酸化位點、二級與三級結構進行預測。[結果]該蛋白在IPTG 終濃度為 0.6 mmol/L、37 ℃下誘導表達6 h可獲得最高表達量,蛋白主要以可溶性蛋白的形式存在;Western blotting結果顯示,AH的培養物上清與沉淀均能夠與制備的兔抗發生特異性結合,具有良好的反應原性,制備的多克隆抗體效價達1.024×106。生物信息學分析表明,嗜水氣單胞菌Hcp蛋白的分子式為C846H1304N224O259S8,共編碼172個氨基酸,相對分子質量為19 013.49 u,等電點(PL)為5.24,屬于穩定蛋白;二級結構中無規則卷曲占比為 51.74%,延伸鏈占比為25.00%,α-螺旋占比為19.19%,β-轉角占比為4.07%。[結論]成功制備了Hcp蛋白的多克隆抗體,為進一步研究AH的VI 型分泌系統(Type VI secretion system,T6SS)提供技術支持。
關鍵詞 嗜水氣單胞菌;Hcp基因;原核表達;多克隆抗體制備;生物信息學
中圖分類號 S 94 文獻標識碼 A 文章編號 0517-6611(2024)23-0079-06
doi:10.3969/j.issn.0517-6611.2024.23.018
Prokaryotic Expression of Hcp Protein of Aeromonas hydrophila,Preparation of Polyclonal Antibody and Bioinformatics Analysis
XU Yi-lan1,XU Jia-le2,LU Bing-xia1 et al
(1.Guangxi Veterinary Research Institute/Key Laboratory of Veterinary Biotechnology of Guangxi,Nanning,Guangxi 530002;2.Animal Science and Technology College,Guangxi University,Nanning,Guangxi 530005)
Abstract [Objective]In order to obtain a polyclonal antibody to the Hcp protein of Aeromonas hydrophila (AH) and its basic biological properties.[Method]The present study utilized RT-PCR to amplify the Hcp gene,constructed a recombinant expression plasmid and then transformed the BL21 receptor cells,which were induced to express the Hcp recombinant protein through IPTG (Isopropyl β-D-Thiogalactoside),purified and immunized fc1dca0e9a683cd4688b2a6868e22dd7rabbits,and then prepared a polyclonal antibody against the protein.Hcp recombinant protein was obtained by IPTG (Isopropyl β-D-Thiogalactoside) induced expression,purified and immunized rabbits,and polyclonal antibody against the protein was prepared,and the potency of the antibody was determined,identified by Western blotting,and its basic physicochemical properties,conserved structural domains,and phosphorylation sites were investigated using bioinformatics online tools,secondary and tertiary structure prediction.[Result]The results showed that the highest expression of the protein was obtained at the final concentration of IPTG of 0.6 mmol/L at 37 ℃ for 6 h,and the protein mainly existed in the form of soluble protein; the results of Western blotting showed that the supernatant and precipitate of the culture of AH were able to specifically bind to the prepared rabbit antibody with good reactivity,and the potency of the prepared polyclonal antibody reached 1.024×106.Bioinformatics analysis showed that the molecular formula of Aeromonas hydrophila Hcp protein was C846H1304N224O259S8,encoding a total of 172 amino acids,with a relative molecular mass of 19 013.49 u,an isoelectric point (pl) of 5.24,which is a stabilized protein; the secondary structure of the protein was 51.74% of the irregularly coiled,25.00% of the elongated chain,and 25.00% of the alpha-chain.25.00%,α-helix accounted for 19.19%,and β-turns accounted for 4.07%.[Conclusion]In this study,a polyclonal antibody to Hcp protein was successfully prepared,which can provide technical support for the further study of Type VI secretion system (T6SS) of AH.
Key words Aeromonas hydrophila;Hcp gene;Prokaryotic expression;Preparation of polyclonal antibody;Bioinformatics
基金項目 廣西重點研發計劃項目(桂科AB21076008,桂科AB20297059);玉林市科學研究與技術開發計劃項目(玉市科20220519)。
作者簡介 許藝蘭(1996—),女,廣西北流人,研究實習員,碩士,從事動物病原學研究。*通信作者:陳忠偉,正高級獸醫師,從事動物病毒學研究;何穎,正高級獸醫師,博士,從事獸醫藥理學和動物傳染病學研究。
收稿日期 2024-01-15
嗜……

