滇水金鳳花蜜相關(guān) SWEET7和 SWEET16的克隆及表達(dá)分析

摘 要 植物SWEET(Sugars will eventually be exported transporter)基因家族是一類重要的糖轉(zhuǎn)運(yùn)蛋白,參與開花植物的花蜜合成。本研究以野生型和突變型滇水金鳳(Impatiens uliginosa)為材料,基于課題組前期的花距轉(zhuǎn)錄組數(shù)據(jù),通過(guò)篩選和RT-PCR技術(shù)克隆得到花蜜相關(guān)基因 SWEET7和 SWEET16,分別命名為 IuSWEET7和 IuSWEET16,其cDNA分別為741 bp和903 bp,分別編碼246和300個(gè)氨基酸。生物信息學(xué)分析表明:IuSWEET7為疏水性不穩(wěn)定蛋白,IuSWEET16為疏水性穩(wěn)定蛋白,二者均含有2個(gè)典型的MtN3/saliv保守結(jié)構(gòu)域; IuSWEET7和 IuSWEET16基因的氨基酸序列與杜鵑花(KAG5539487.1)、一串紅(XP_042052415.1)等植物同源序列的相似性均在54.15%~71.48%;系統(tǒng)進(jìn)化分析表明, IuSWEET7和 IuSWEET16處于兩個(gè)不同分支。qRT-PCR分析表明兩個(gè)基因在野生型和突變型滇水金鳳花距的3個(gè)時(shí)期中均有表達(dá),且在不同部位中表達(dá)模式不同。其中 IuSWEET7基因在野生型滇水金鳳中其表達(dá)量從花苞期至盛花期逐漸上升;在突變型2距和3距中其表達(dá)量從花苞期至盛花期先上升后下降,且在始花期表達(dá)量最高;而 IuSWEET16基因在野生型和突變型3距中其表達(dá)量從花苞期至盛花期均逐漸上升,但在突變型2距中其表達(dá)量從花苞期至盛花期先上升后下降,也在始花期時(shí)達(dá)到最高。
關(guān)鍵詞 滇水金鳳;花蜜; SWEET7基因; SWEET16基因;基因克隆;表達(dá)分析
植物的開花及傳粉策略是植物有性繁殖成功與否的關(guān)鍵,花蜜在植物授粉系統(tǒng)中發(fā)揮著關(guān)鍵作用,植物通過(guò)調(diào)節(jié)花蜜的分泌與分布影響傳粉者的訪花行為,進(jìn)而影響其種群的延續(xù)及發(fā)展。在植物授粉系統(tǒng)中,表征花蜜的常規(guī)指標(biāo)有花蜜成分、花蜜量和花蜜濃度。花蜜成分及花蜜量與傳粉者的訪花頻率、開花植物的授粉效率等存在很大的聯(lián)系[1-4]。在自然界中,開花植物與其他物種之間存在著互惠、敵對(duì)等多種相互作用[5],植物以花蜜作為訪花報(bào)酬,吸引傳粉者,體現(xiàn)了開花植物與傳粉者間的互惠作用;有些花蜜對(duì)盜蜜者、部分傳粉者具有驅(qū)避功能,體現(xiàn)了開花植物與傳粉者、盜蜜者間的敵對(duì)作用,這可能與花蜜中所含的苦澀堿性化學(xué)成分有關(guān)[6]。此外,大量研究發(fā)現(xiàn),蜜腺分泌花蜜,且花蜜質(zhì)量與蜜腺結(jié)構(gòu)存在一定的相關(guān)性[7-8]。
花蜜富含人體健康所需的多種營(yíng)養(yǎng)成分[9],成分主要為糖類化合物,以及少量的氨基酸、蛋白質(zhì)、生物堿等物質(zhì),所以可將花蜜視為糖的水溶液[6]。糖類化合物不僅能夠?yàn)橹参镒陨泶x提供能量,其合成、轉(zhuǎn)運(yùn)及代謝對(duì)蛋白質(zhì)、脂質(zhì)合成有重要作用[10]。此外,糖類化合物對(duì)植物生長(zhǎng)發(fā)育也發(fā)揮著重要作用,可作為信號(hào)分子調(diào)控植物生長(zhǎng)發(fā)育,如種子萌發(fā)、花器官形成和逆境調(diào)控等過(guò)程[11]。大多數(shù)被子植物中的花蜜主要基于不同比例的蔗糖和單糖[12],蔗糖是植物葉肉細(xì)胞光合作用的主要產(chǎn)物,也是最常見的糖類運(yùn)輸形式。SWEET蛋白作為一類新的糖轉(zhuǎn)運(yùn)蛋白[13],不僅對(duì)蔗糖、葡萄糖及果糖等具有轉(zhuǎn)運(yùn)作用,而且可以對(duì)糖類的跨膜運(yùn)輸進(jìn)行調(diào)控,從而參與植物的生長(zhǎng)發(fā)育[14]。目前,對(duì)SWEET基因的深入研究主要在擬南芥和矮牽牛中。研究表明,擬南芥中的9個(gè) AtSWEET9基因在花中集中表達(dá)[15],其中 AtSWEET9在蜜腺中的表達(dá)量較高,且 AtSWEET9突變體表現(xiàn)出花蜜分泌減少[16];矮牽牛的 NEC1基因與 AtSWEET9基因?yàn)橥椿颍湓诿巯僦械谋磉_(dá)量較高,且其表達(dá)量升高使花蜜的分泌量顯著提升[17-18]。由此說(shuō)明SWEET基因家族對(duì)花蜜分泌至關(guān)重要。
滇水金鳳(Impatiens uliginosa)是鳳仙花科(Balsaminaceae)鳳仙花屬(Impatiens)的一年或多年生植物,具有生長(zhǎng)快、生物量大、周年開花、抗逆性強(qiáng)等特性,滇水金鳳不僅花色多樣,而且有奇特的花距結(jié)構(gòu),具有較高的觀賞價(jià)值,也因此深受國(guó)內(nèi)學(xué)者的廣泛關(guān)注[19-20]。對(duì)于鳳仙花的研究逐漸涉及各個(gè)方面,如杜曉華等[21]對(duì)鳳仙花(Impatiens balsamina)和茶花鳳仙(Impatiens balsamena)進(jìn)行了多倍體誘導(dǎo),張茜等[22]對(duì)四川西南地區(qū)的鳳仙花屬植物進(jìn)行了花粉微形態(tài)研究。迄今為止,國(guó)內(nèi)外尚未見有關(guān)鳳仙花SWEET基因的報(bào)道。本研究通過(guò)分離克隆野生型和突變型滇水金鳳SWEET基因,對(duì)其序列結(jié)構(gòu)和系統(tǒng)進(jìn)化進(jìn)行分析;并通過(guò)qRT-PCR研究SWEET基因在滇水金鳳野生型和突變型花距中不同時(shí)期及部位的時(shí)空表達(dá)模式,進(jìn)而探究其在滇水金鳳花距中花蜜生產(chǎn)的功能與作用,為滇水金鳳野生型和突變型生態(tài)適應(yīng)機(jī)制、花蜜形成的分子調(diào)控機(jī)制提供一定的基礎(chǔ)數(shù)據(jù)和理論依據(jù)。
1 材料與方法
1.1 試驗(yàn)材料
滇水金鳳1個(gè)花距的為野生型,2個(gè)和3個(gè)花距的為突變型。野生型和突變型材料均從昆明市撈魚河濕地公園收集種子后,于2022年6月種植于西南林業(yè)大學(xué)樹木園的溫室大棚,待植株發(fā)育成熟,選取15棵健壯植株,采取發(fā)育完全的3個(gè)關(guān)鍵時(shí)期(花苞期、始花期、盛花期)的5個(gè)部位(1距、2距主距、2距側(cè)距、3距主距、3距側(cè)距)(圖1)。試驗(yàn)材料從植株上分離后,用已滅菌的刀和鑷子迅速分離距部,放入液氮中,存放于 -80 ℃冰箱中,備用。
1.2 總RNA的提取與SWEET7和SWEET16基因的克隆
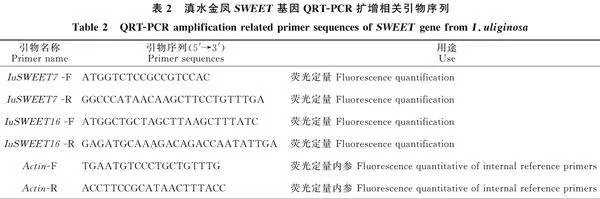
利用RNA提取試劑盒(Omega美國(guó))提取滇水金鳳花距的總RNA;采用逆轉(zhuǎn)錄試劑盒EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix(北京全式金生物)將RNA逆轉(zhuǎn)錄成cDNA,-20 ℃保存,備用。以滇水金鳳花距轉(zhuǎn)錄組中的 IuSWEET7和 IuSWEET16基因?yàn)橐罁?jù),對(duì)引物進(jìn)行設(shè)計(jì)(表1),并送往生物工程(上海)股份有限公司合成。以滇水金鳳花距的cDNA為模板進(jìn)行PCR擴(kuò)增。PCR產(chǎn)物經(jīng)回收純化后,與載體pMD19-T連接,轉(zhuǎn)化DH5感受態(tài)細(xì)胞,最后挑選陽(yáng)性菌液生工測(cè)序。
1.3 SWEET7和SWEET16基因序列分析
運(yùn)用Expasy在線軟件(https://web.expasy.org /protparam)對(duì) SWEET7和 SWEET16基因的基本理化特性進(jìn)行分析;利用SMART在線工具(http://smart.embl-heidelberg.de)預(yù)測(cè)基因結(jié)構(gòu)域;采用WoLF PSORT在線軟件(https://wolfpsort.hgc.jp)對(duì)IuSWEET7和IuSWEET16蛋白的亞細(xì)胞定位進(jìn)行預(yù)測(cè);借助SWISS-MODEL(https://swissmodel.expasy.org/interactive)預(yù)測(cè)基因的三維空間結(jié)構(gòu);借助BLAST(https://blast.ncbi.nlm.nih.gov /Blast.cgi)獲得IuSWEET7和IuSWEET16蛋白的同源序列,利用DNAMAN 9.0軟件對(duì)其進(jìn)行比對(duì)分析;采取MEGA- X軟件的鄰接法(Bootstrap=1 000)進(jìn)行系統(tǒng)進(jìn)化分析;在string(http://string-db.org/)網(wǎng)站選擇8條IuSWEET蛋白制作互作網(wǎng)絡(luò)。
1.4 SWEET7和SWEET16基因時(shí)空表達(dá)模式分析
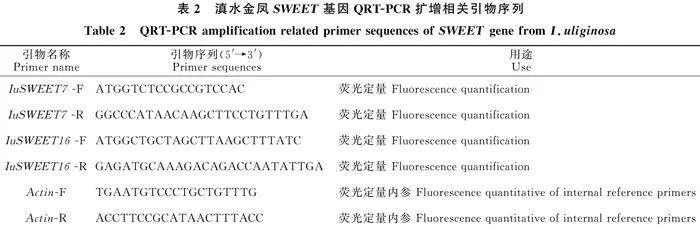
分別提取野生型和突變型滇水金鳳3個(gè)時(shí)期、5個(gè)部位的RNA,逆轉(zhuǎn)錄合成cDNA,-20 ℃冰箱保存,備用。設(shè)計(jì) SWEET7和 SWEET16基因qRT-PCR引物,以IuActin作為內(nèi)參基因,引物均購(gòu)自于生工生物工程(上海)股份有限公司(表2)。借助Light Cycler 480 Ⅱ(Roche)實(shí)時(shí)定量PCR儀進(jìn)行基因表達(dá)相對(duì)定量分析。每個(gè)樣品進(jìn)行3個(gè)重復(fù),采用2-△△CT法計(jì)算。分別將2距盛花期側(cè)距和3距花苞期側(cè)距定義為單位1作為對(duì)照,對(duì) SWEET7和 SWEET16基因在不同時(shí)期和不同部位的時(shí)空表達(dá)模式進(jìn)行分析。
2 結(jié)果與分析
2.1 滇水金鳳SWEET7和SWEET16基因的克隆[JP]
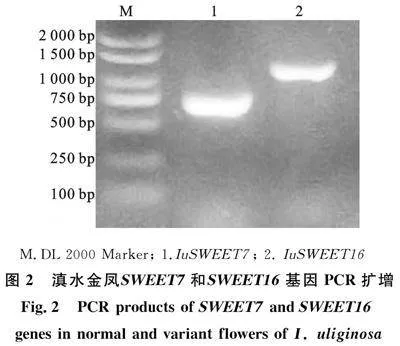
根據(jù)筆者課題組所測(cè)的野生型和突變型滇水金鳳轉(zhuǎn)錄組數(shù)據(jù)來(lái)設(shè)計(jì)特異性引物,以滇水金鳳花距的cDNA為模版進(jìn)行 SWEET7和 SWEET16基因的cDNA擴(kuò)增。經(jīng)PCR擴(kuò)增,獲得 SWEET7和 SWEET16基因的全長(zhǎng)cDNA序列,分別為741和903 bp(圖2),分別編碼246和300 aa。
2.2 滇水金鳳SWEET7和SWEET16基因的序列結(jié)構(gòu)分析
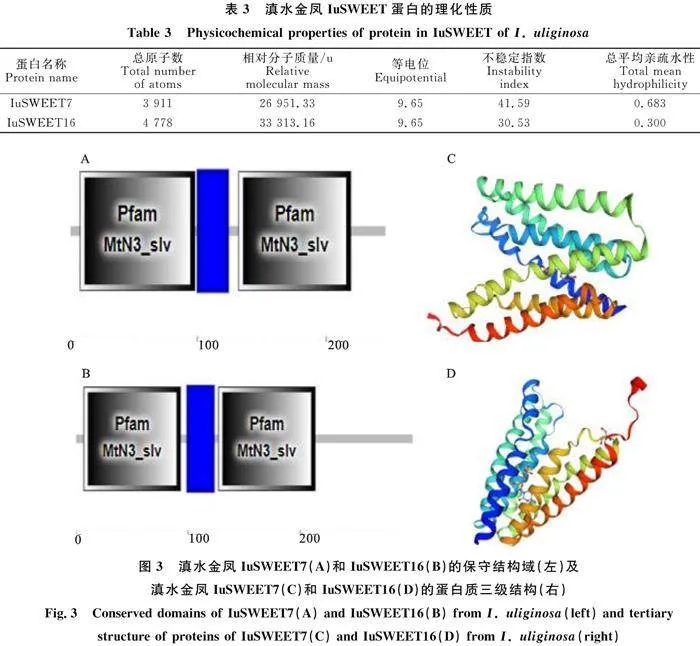
運(yùn)用Expasy-ProtParam軟件對(duì)野生型和突變型滇水金鳳花距 SWEET7和 SWEET16基因的編碼蛋白進(jìn)行分析,結(jié)果表明,IuSWEET7和IuSWEET16的不穩(wěn)定指數(shù)分別為41.59和 30.53(表3),IuSWEET7為不穩(wěn)定蛋白,IuSWEET16為穩(wěn)定蛋白。利用SMART分析結(jié)構(gòu)域結(jié)果顯示,二者均具備兩個(gè)MtN3/saliva保守結(jié)構(gòu)域(圖3左)。利用TMHMM 2.0進(jìn)行跨膜區(qū)預(yù)測(cè),結(jié)果表明IuSWEET7和IuSWEET16蛋白分別存在7個(gè)和6個(gè)跨膜結(jié)構(gòu)域。借助WOLF PSORT分析發(fā)現(xiàn), IuSWEET7和 IuSWEET16基因亞細(xì)胞定位均于質(zhì)膜上。此外,利用SOPMA二級(jí)結(jié)構(gòu)分析軟件對(duì)IuSWEET7和IuSWEET16蛋白進(jìn)行預(yù)測(cè),結(jié)果顯示IuSWEET7蛋白的α-螺旋占比為41.87%,β-轉(zhuǎn)角占比2.85%,延伸鏈為22.36%,無(wú)規(guī)則卷曲為32.93%;IuSWEET16蛋白的α-螺旋占比為52%,β-轉(zhuǎn)角占比2.67%,延伸鏈為16%,無(wú)規(guī)則卷曲為 29.33%。運(yùn)用SWISS-MODEL對(duì)IuSWEET7和IuSWEET16蛋白的三級(jí)結(jié)構(gòu)進(jìn)行預(yù)測(cè),發(fā)現(xiàn)野生型和突變型滇水金鳳花距的IuSWEET7和IuSWEET16蛋白高級(jí)結(jié)構(gòu)均以 α-螺旋為主(圖3右)。
2.3 滇水金鳳SWEET7和SWEET16基因的系統(tǒng)進(jìn)化分析
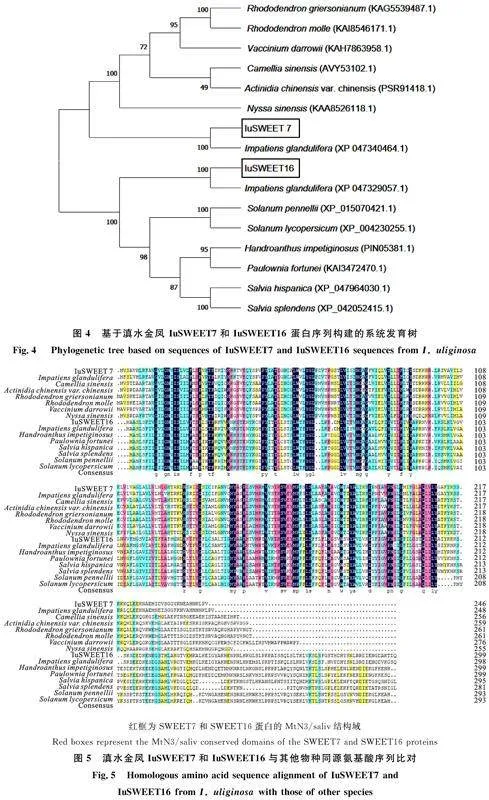
運(yùn)用BLAST和DNAMAN軟件將 SWEET7和 SWEET16[JP]編碼的蛋白序列與其他物種進(jìn)行同源性比對(duì),發(fā)現(xiàn)二者與喜馬拉雅鳳仙花(I. glandulifera)的同源性最高,分別為 71.48%和 62.25%。利用MEGA軟件構(gòu)建系統(tǒng)進(jìn)化樹,發(fā)現(xiàn)IuSWEET7和IuSWEET16均與喜馬拉雅鳳仙花聚為一支,但處于兩個(gè)不同分支(圖4)。此外,IuSWEET7和IuSWEET16與杜鵑花(Rhododendron griersonianum)、羊躑躅(Rhododendron molle)、常綠越橘(Vaccinium darrowii)、山茶花(Camellia sinensis)、中華獼猴桃(Actinidia chinensis var.chinensis)、藍(lán)果樹(Nyssa sinensis)、潘那利番茄(Solanum pennellii)、番茄(Solanum lycopersicum)、粉紅鐘花(Handroanthus impetiginosus)、泡桐(Paulownia fortunei)、鼠尾草(Salvia hispanica)、一串紅(Salvia splendens)等植物的SWEET7和SWEET16同源序列相似性均在54.15%~ 71.48%,并且如圖5中紅框所示,這些物種都包含有SWEET基因家族的兩個(gè)典型MtN3/saliv結(jié)構(gòu)域(圖5)。
2.4 滇水金鳳SWEET7和SWEET16基因的時(shí)空表達(dá)分析
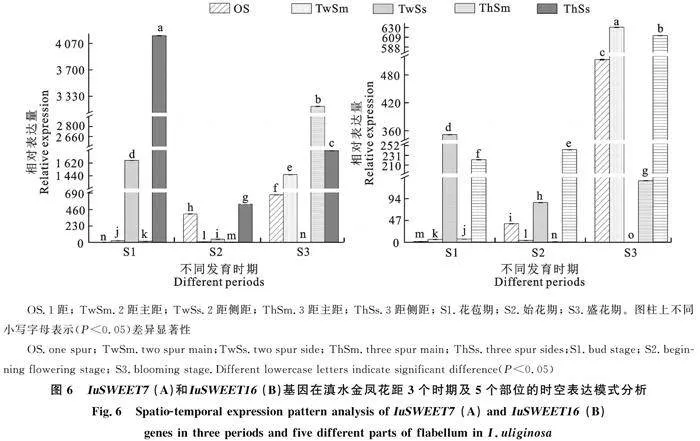
研究發(fā)現(xiàn), SWEET7和 SWEET16基因在滇水金鳳發(fā)育的3個(gè)關(guān)鍵時(shí)期(花苞期、始花期和盛花期)及5個(gè)部位(1距、2距主距、2距側(cè)距、3距主距和3距側(cè)距)均有表達(dá)(圖6)。 IuSWEET7基因在野生型1距中從花苞期至盛花期表達(dá)量逐漸上升;在突變型2距和3距中花苞期至盛花期表達(dá)量先上升后下降,在始花期時(shí)達(dá)到最高。 IuSWEET16基因在野生型1距和突變型3距中,從花苞期至盛花期表達(dá)量均逐漸上升;但在突變型2距中從花苞期至盛花期表達(dá)量先上升后下降,在始花期時(shí)達(dá)到最高。因此,SWEET7和 SWEET16基因在野生型和突變型花距中表現(xiàn)出不同的表達(dá)模式。從滇水金鳳不同發(fā)育時(shí)期來(lái)看,除突變型2距的側(cè)距外,花苞期和盛花期的 IuSWEET7和 IuSWEET16基因表達(dá)量在突變型中均顯著高于野生型,與盛花期的突變型花蜜量顯著高于野生型的結(jié)果一致。從滇水金鳳不同部位來(lái)看,在野生型和突變型主距中, IuSWEET7和 IuSWEET16基因主要在盛花期時(shí)表達(dá)量較高;在側(cè)距中, IuSWEET7和 IuSWEET16基因主要在花苞期時(shí)表達(dá)量較高。綜上,推測(cè)側(cè)距的花蜜量是從花苞期開始積累的,而主距中的花蜜量主要是盛花期產(chǎn)生的; IuSWEET7和 IuSWEET16基因在野生型和突變型花距的花蜜生產(chǎn)過(guò)程中均發(fā)揮了重要作用。
2.5 IuSWEET家族互作網(wǎng)絡(luò)
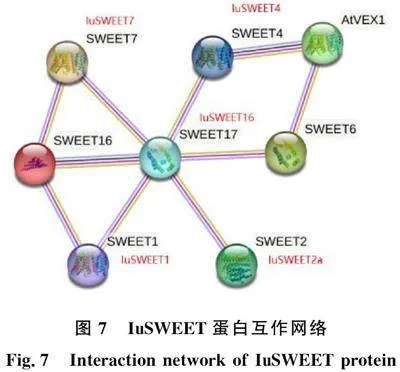
探究蛋白之間的互作對(duì)研究基因功能有一定幫助。目前缺乏對(duì)IuSWEET蛋白互作的報(bào)道。通過(guò)同源比對(duì),從野生型和突變型滇水金鳳花距轉(zhuǎn)錄組中選擇了與IuSWEET7和IuSWEET16同源性較高的IuSWEET1、IuSWEET2、IuSWEET4和IuSWEET17,制作了擬南芥中存在相互作用的SWEET互作網(wǎng)絡(luò)(圖7)。通過(guò)蛋白質(zhì)互作網(wǎng)絡(luò)發(fā)現(xiàn),IuSWEET7和IuSWEET16蛋白之間相互作用,結(jié)合對(duì)野生型和突變型滇水金鳳 SWEET7、 SWEET16基因的時(shí)空表達(dá)分析發(fā)現(xiàn), IuSWEET7和 IuSWEET16在不同發(fā)育時(shí)期和不同部位中均有表達(dá)且表達(dá)模式不同。因此,可推測(cè)IuSWEET7和IuSWEET16蛋白相互作用共同來(lái)調(diào)控野生型和突變型花距中花蜜的 合成。
3 討 論
花蜜是植物與授粉媒介相互作用的重要決定因素,也是授粉綜合征的一個(gè)組成部分,花蜜是提供給傳粉者的主要獎(jiǎng)勵(lì),其數(shù)量、成分和位置是植物與傳粉昆蟲相互作用的重要決定因素[23]。糖類化合物是花蜜的主要組成部分,F(xiàn)ahn[24]學(xué)者研究維管植物中的分泌組織時(shí)預(yù)測(cè),在蜜腺內(nèi)發(fā)生轉(zhuǎn)錄過(guò)程中參與碳水化合物代謝的基因數(shù)量會(huì)明顯增多,而一些酶和轉(zhuǎn)運(yùn)蛋白則能夠改變花蜜中碳水化合物的組成,最終產(chǎn)生成熟的花蜜。在矮牽牛中利用傳粉綜合征確定了一個(gè)參與控制花蜜量和組成的單一QTL[25],但至今參與這一現(xiàn)象的特定調(diào)控基因尚不清楚,參與蜜腺中花蜜合成和分泌相關(guān)基因表達(dá)方面的信息一直很缺乏。基于筆者課題組前期研究發(fā)現(xiàn),野生型和突變型滇水金鳳盛花期花距中的花蜜量存在較大差異,突變型2距和3距由于數(shù)目和花距形態(tài)等原因,單花的花蜜總量比野生型1距的多,這對(duì)提高吸引傳粉者概率和頻率是十分有利的。
SWEET基因家族只存在于植物中,參與花蜜合成分泌、韌皮部裝載等一系列生理過(guò)程,被視為一類轉(zhuǎn)運(yùn)糖、糖醇和激素的載體。本研究從野生型和突變型滇水金鳳中成功分離克隆出與花蜜合成轉(zhuǎn)運(yùn)相關(guān)基因 IuSWEET7和 IuSWEET16,跨膜結(jié)構(gòu)域預(yù)測(cè)發(fā)現(xiàn)IuSWEET7具有SWEET家族典型的7個(gè)跨膜結(jié)構(gòu)域,這與國(guó)外研究者們?cè)跀M南芥中發(fā)現(xiàn)的部分SWEETs也存在7個(gè)跨膜結(jié)構(gòu)域的情況一致[26];而IuSWEET16只有6個(gè)跨膜結(jié)構(gòu)域。MtN3/saliv結(jié)構(gòu)域是具有植物糖轉(zhuǎn)運(yùn)蛋白特異性的功能域,尤其是植物SWEET基因家族特有的功能域,與糖的跨膜運(yùn)輸有關(guān)[15]。本研究中兩個(gè)基因編碼的蛋白均有2個(gè)MtN3/saliv保守結(jié)構(gòu)域,這與梁大曲等[27]發(fā)現(xiàn)在馬尾松中包含典型的兩個(gè)MtN3/saliv結(jié)構(gòu)域的結(jié)果一致。同源性分析發(fā)現(xiàn),野生型和突變型滇水金鳳花距中 SWEET7和 SWEET16基因的氨基酸序列與杜鵑花、羊躑躅、山茶花等植物的SWEET基因同源性達(dá)71.48%和62.25%。
已有研究表明,植物SWEET基因家族有4個(gè)分支,分別為CladeⅠ、CladeⅡ、CladeⅢ和CladeⅣ。其中CladeⅠ( SWEET1~ SWEET3)為己糖轉(zhuǎn)運(yùn)蛋白,主要轉(zhuǎn)運(yùn)葡萄糖;CladeⅡ( SWEET4~ SWEET8)主要轉(zhuǎn)運(yùn)葡萄糖;CladeⅢ( SWEET9~ SWEET15)主要轉(zhuǎn)運(yùn)蔗糖;CladeⅣ( SWEET16~ SWEET17)是一種液泡膜轉(zhuǎn)運(yùn)蛋白,主要轉(zhuǎn)運(yùn)果糖[28]。通過(guò)分析滇水金鳳野生型和突變型花距系統(tǒng)進(jìn)化發(fā)現(xiàn),IuSWEET7和IuSWEET16均與喜馬拉雅鳳仙花聚為一支,但I(xiàn)uSWEET7和IuSWEET16存在不同的分支,這與薛蓓蓓等[29]發(fā)現(xiàn)在木薯中 SWEET7和 SWEET16基因處于不同分支的結(jié)果一致,表明 IuSWEET7和 IuSWEET16在滇水金鳳花蜜合成分泌中發(fā)揮著不同的作用。
SWEETs基因在不同植物及不同生長(zhǎng)發(fā)育時(shí)期中表達(dá)特征具有較大差異,大部分與糖的合成轉(zhuǎn)運(yùn)密切相關(guān),在泌蜜植物中發(fā)揮著重要作用。qRT-PCR分析發(fā)現(xiàn), IuSWEET7和 IuSWEET16在滇水金鳳野生型及突變型花距的花苞期、始花期、盛花期中均有表達(dá)。其中,野生型滇水金鳳花距的 IuSWEET7和 IuSWEET16從花苞期至盛花期表達(dá)量上調(diào),這與牡丹中SWEET基因時(shí)空表達(dá)一致[30]。通過(guò)對(duì)滇水金鳳的IuSWEET7和IuSWEET16蛋白進(jìn)行蛋白質(zhì)互作預(yù)測(cè)發(fā)現(xiàn)其SWEET蛋白質(zhì)之間可能存在相互作用,這與歐倩等[31]發(fā)現(xiàn)在慈竹SWEET蛋白間可能兩兩存在相互作用,共同調(diào)控糖的轉(zhuǎn)運(yùn)結(jié)果一致。所以,可推測(cè)IuSWEET7和IuSWEET16蛋白相互作用共同調(diào)控花蜜中糖的合成、轉(zhuǎn)運(yùn)和分泌。
滇水金鳳的蜜腺結(jié)構(gòu)和花蜜存在于花距中,基于盛花期花蜜量的差異,從野生型和突變型滇水金鳳花距轉(zhuǎn)錄組中篩選出花蜜相關(guān)基因 IuSWEET7和 IuSWEET16。本研究發(fā)現(xiàn)的兩個(gè)基因在滇水金鳳野生型和突變型花蜜生產(chǎn)過(guò)程中發(fā)揮著重要作用,但其具體花蜜合成機(jī)制以及花蜜物質(zhì)成分與傳粉者之間的相互作用還有待深入研究。本研究不僅能夠?yàn)樘骄康崴瘌P花蜜的分子和生理機(jī)制提供一定的理論基礎(chǔ),而且能夠?yàn)轼P仙花物種繁殖、花形改良提供一定的基礎(chǔ)數(shù)據(jù)和理論依據(jù)。
參考文獻(xiàn) Reference:
[1] BAKER H G,BAKER I.Chemical constituents of the nectars of two erythrina species and their hybrid[J]. Annals of the Missouri Botanical Garden,1979,66(3):446-450.
[2] BAKER H G,BAKER I. The occurrence and significance of amino acids in floral nectar[J]. Plant Systematics and Evolution,1986,151(5):175-186.
[3] STUURMAN Jeroen,HOBALLAH Maria Elena,BROGER Larissa,et al. Dissection of floral pollination syndromes in Petunia[J]. Genetics,2004,168(3):1585-1599.
[4] CLINE G,ELENA H M,CRIS K,et al. Genetics of flower size and nectar volume in Petunia pollination syndromes[J]. Planta,2006,225(1):203-212.
[5] STRAUSS S Y,IRWIN R E. Ecological and evolutionary consequences of multispecies plant-animal interactions.[J].Annual Review of Ecology Evolution and Systematics,2004,35(1):435-566.
[6] 卿 卓,蘇 睿,董 坤,等. 花蜜化學(xué)成分及其生態(tài)功能研究進(jìn)展[J]. 生態(tài)學(xué)雜志,2014,33(3):825-836.
QING ZH,SU R,DONG K,et al. Research progress on nectar compositions and their ecological functions[J]. Chinese Journal of Ecology,2014,33(3):825-836.
[7] NEPI M,ADERKAS P,WAGNER R,et al. Nectar and pollination drops:how different are they?[J]. Annals of Botany,2009,104(2):205-219.
[8] PACINI E,MASSIMO N,VESPRINI J L.Nectar biodiversity:a short review[J].Plant Systematics and Evolution,2003(2):7-21.
[9] 石秋梅,尹傳華,王 虹,等. 白麻花蜜腺及花瓣乳突細(xì)胞的發(fā)育解剖學(xué)研究[J]. 西北農(nóng)業(yè)學(xué)報(bào),2022,31(10):1381-1388.
SHI Q M,YIN CH H,WANG H,et al. Developmental anatomy of nectar glands and petal papilla cells in Apocynum pictum Schrenk [J].Acta Agriculturae Boreali-occidentalis Sinica,2022,31(10):1381-1388.
[10] 黃 成,李旭楠,李詩(shī)燕,等. 植物SWEET基因家族的研究進(jìn)展[J]. 中國(guó)農(nóng)學(xué)通報(bào),2022,38(17):17-26.
HUANG CH,LI X N,LI SH Y,et al. Research progress of plant SWEET gene family[J]. Chinese Agricultural Science Bulletin,2022,38(17):17-26.
[11] KHN C,GROF C P. Sucrose transporters of higher plants[J]. Current Opinion in Plant Biology,2010, 13(3):287-297.
[12] BRANDENBURG A,DELL’OLIVO A,BSHARY R. The sweetest thing[J]. Current Opinion in Plant Biology,2009,12(4):486-490.
[13] TAO Y,CHEUNG L S,LI S,et al. Structure of a eukaryotic SWEET transporter in a homotrimeric complex.[J]. Nature,2015,527:75-77.
[14] JEENA G S,KUMAR S,SHUKLA R K. Structure,evolution and diverse physiological roles of SWEET sugar transporters in plants[J]. Plant Molecular Biology,2019,100(4):351-365.
[15] WELLMER F,ALVES-FERREIRA M,DUBOIS A,et al. Genome-wide analysis of gene expression during early Arabidopsis flower development [J]. Plos Genetics,2006,2(7):1012-1024.
[16] LIN I W,SOSSO D,LI Q C,et al. Nectar secretion equires sucrose phosphate synthases and the sugar transporter SWEET9.[J]. Nature,2014,508(7497):546-549.
[17] GE Y X,ANGENENT G C,WITTICH P E,et al. NEC1,a novel gene,highly expressed in nectary tissue of Petunia hybrida[J]. Plant Journal,2000,24(6):725-734.
[18] MENG Y,SHIPING W.Rice MtN3/Saliva/SWEET family genes and their homologs in cellular organisms[J]. Molecular Plant,2013,6(3):665-674.
[19] LI Y,WEI C M,LI X Y,et al. De novo transcriptome sequencing of Impatiens uliginosa and the analysis of candidate genes related to spur development[J]. Bmc Plant Biology,2022,22(1):553-569.
[20] 魏春梅,李 洋,孟丹晨,等. 滇水金鳳花距發(fā)育相關(guān)基因TIP的克隆及表達(dá)分析[J]. 植物生理學(xué)報(bào),2022,58(9):1757-1765.
WEI CH M,LI Y,MENG D CH,et al. Cloning and expression analysis of TIP genes related to petal spur development in Impatiens uliginosa[J]. Plant Physiology Journal,2022,58(9):1757-1765.
[21] 杜曉華,孫涌棟,袁少寒,等. 兩種鳳仙花多倍體的誘導(dǎo)[J]. 西北農(nóng)業(yè)學(xué)報(bào),2011,20(7):56-59.
DU X H,SUN Y D,YUAN SH H,et al. Identification of colchicines-induced polyploid plants in two species of Impatiens balsamina[J]. Acta Agriculturae Boreali-occidentalis Sinica,2011,20(7):56-59.
[22] 張 茜,趙秋燕,谷志佳,等. 四川西南地區(qū)鳳仙花屬植物花粉微形態(tài)研究[J]. 園藝學(xué)報(bào),2023,50(8):1664-1678.
ZHANG X,ZHAO Q Y,GU ZH J,et al.Studies on pollen micromorphology of Impatiens plants in southwest Sichuan[J]. Acta Horticulturae Sinica,2023,50(8):1664-1678.
[23] PARACHNOWITSCH A L,JESSAMYN S M,NINA S. Evolutionary ecology of nectar[J].Annals of Botany,2019,123(2):247-261.
[24] FAHN A.Tansley review No.14 secretory tissues in vascular plants[J].New Phytologist,1988,108(3):229-257.
[25] CLINE G,ELENA H M,CRIS K,et al. Genetics of flower size and nectar volume in Petunia pollination syndromes[J]. Planta,2006,225(1):203-212.
[26] CHEN L Q,HOU B H,LALONDE S,et al. Sugar transporters for intercellular exchange and nutrition of pathogens[J]. Nature,2010,468(11):527-532.
[27] 梁大曲,石長(zhǎng)雙,涂晶晶,等. 馬尾松PmSWEET基因的克隆、亞細(xì)胞定位及表達(dá)分析[J]. 植物生理學(xué)報(bào),2022,58(2):447-457.
LIANG D Q,SHI CH SH,TU J J,et al. Cloning,subcellular localization and expression analysis of PmSWEET gene in Pinus massoniana[J]. Plant Physiology Journal,2022,58(2):447-457.
[28] CHEN L Q,QU X Q,HOU B H,et al. Sucrose efflux mediated by SWEET proteins as a key step for phloem transport[J]. Science,2012,335(6065):207-211.
[29] 薛蓓蓓,覃麗芳,董明右,等. 木薯SWEETs基因家族生物信息學(xué)及表達(dá)特性研究[J]. 基因組學(xué)與應(yīng)用生物學(xué),2019,38(1):260-268.
XUE B B,QIN L F,DONG M Y,et al. Bioinformatics analysis and expressional characteristics of cassava SWEETs gene family[J]. Genomics and Applied Biology,2019,38(1):260-268.
[30] 王 銳,徐娟娟,劉 鑫,等. 牡丹開花相關(guān)SWEET家族基因生物信息學(xué)與表達(dá)模式分析[J]. 西北植物學(xué)報(bào),2019,39(12):2145-2153.
WANG R,XU J J,LIU X,et al. Bioinformatics and expression pattern analysis of SWEET family genes during peony flowering development[J]. Acta Botanica Boreali-Occidentalia Sinica,2019,39(12):2145-2153.
[31] 歐 倩,王博雅,杜恬恬,等. 慈竹BeSWEET4-2和BeSWEET1a-2基因的克隆和表達(dá)分析[J]. 西北植物學(xué)報(bào),2020,40(11):1833-1839.
OU Q,WANG B Y,DU T T,et al. Cloning and expression analysis of BeSWEET4-2 and BeSWEET1a-2 from Bambusa emeiensis[J]. Acta Botanica Boreali-Occidentalia Sinica,2020,40(11):1833-1839.
Cloning and Expression Analysis of SWEET7 and SWEET16 Genes
Associated with Nectar in Spur of Impatiens uliginosa
ZHANG Xiaoli,TAN Yi,LI Fan,ZHAO Luqiu,SHI Wanlei,HUANG Haiquan and HUANG Meijuan
(College of Landscape Architecture and Horticulture Sciences,Southwest Research Center for Engineering
Technology of Landscape Architecture (State Forestry and Grassland Administration),Yunnan Engineering
Research Center for Functional Flower Resources and Industrialization,Research and Development Center
of Landscape Plants and Horticulture Flowers,Southwest Forestry University,Kunming 650224,China)
Abstract The SWEET (Sugars will eventually be exported transporter) gene family in plants is an important class of sugar transporter proteins involved in nectar synthesis in flowering plants. In this study,wild type and mutant Impatiens uliginosa were used as materials,the transcriptome data of the flower spur generated by our research group were used,we identified and cloned the nectar-related genes SWEET7 and SWEET16 through screening and RT-PCR techniques,designating them as IuSWEET7 and IuSWEET16,respectively. Their cDNA were 741 bp and 903 bp,encoding 246 and 300 amino acids,respectively. Bioinformatics analysis showed that IuSWEET7 was a hydrophobically unstable protein,while IuSWEET16 was a hydrophobically stable protein,both containing two typical MtN3/saliv conserved domains; the amino acid sequences of IuSWEET7 and IuSWEET16 genes showed similarity ranging from 54.15% to 71.48% to the homologous sequences in Rhododendron griersonianum and Salvia splendens; phylogenetic analysis showed that IuSWEET7 and IuSWEET16 belonged to two different branches. QRT-PCR analysis showed that both genes were expressed across three stages of flower spur in both wild-type and mutant I. uliginosa,with varying expression patterns in different organs. The expression of IuSWEET7 gene in wild-type I. uliginosa exhibited a gradual increase from the bud stage to the flowering stage. In the mutants,the expression first increased and then decreased in 2 and 3 spurs of mutants type,with the highest expression observed during the first flowering stage. The expression of IuSWEET16 gene increased gradually from the bud stage to the flowering stage in wild-type and 3 spur of mutant type. However,in the second spur of the mutant type,the expression increased at first and then decreased from the bud stage to the flowering stage,reaching its peak at the first flowering stage.
Key words Impatiens uliginosa; Nectar; SWEET7 gene; SWEET16 gene; Gene cloning; Expression analysis
Received 2023-08-25 Returned 2023-10-07
Foundation item National Natural Science Foundation of China (No.32060364,No.32060366);Major Science and Technology Special Project of Yunnan Province(No.202102AE090052);Ph.D Supervisory Team of Genetic Improvement and Efficient Breeding of Garden Plants in Yunnan Province.
First author ZHANG Xiaoli,female,master student. Research area:landscape plants. E-mail:2536628677@qq.com
Corresponding author HUANG Meijuan,female,Ph.D,professor. Research area:landscape plants. E-mail:xmhhq2001@163.com
(責(zé)任編輯:潘學(xué)燕 Responsible editor:PAN Xueyan)
基金項(xiàng)目:國(guó)家自然科學(xué)基金(32060364,32060366);云南省重大科技專項(xiàng)(202102AE090052);云南省園林植物遺傳改良與高效繁育博士生導(dǎo)師團(tuán)隊(duì)。
第一作者:張曉麗,女,碩士研究生,從事園林植物研究。E-mail:2536628677@qq.com
通信作者:黃美娟,女,博士,教授,從事園林植物研究。E-mail:xmhhq2001@163.com

