基于流式細胞術(shù)的蜘蛛抱蛋屬植物倍性檢測和核DNA含量測定體系的建立



摘 要 為建立適用于蜘蛛抱蛋屬植物的倍性檢測及其核DNA含量的流式細胞術(shù)方法,以蜘蛛抱蛋屬植物成熟葉片為材料,比較了WPB解離液、LB01解離液、Galbraith’s解離液以及改良Galbraith’s解離液制備的細胞核懸液的效果。結(jié)果表明:改良Galbraith’s解離液能夠更廣泛地適用于蜘蛛抱蛋屬植物成熟葉片的細胞核懸液的制備且效果較好。利用改良Galbraith’s解離液對12種13個居群的蜘蛛抱蛋屬植物進行倍性檢測,并通過染色體制片計數(shù)法進行驗證。結(jié)果表明:12種蜘蛛抱蛋屬植物的DNA含量的熒光強度峰值范圍為1 753 078.81~5 817 826.99。其中,11種二倍體植物的峰值范圍為1 753 078.81~2 937 690.80,四倍體輻花蜘蛛抱蛋的峰值為3 892 503.69,六倍體泰國蜘蛛抱蛋的峰值為5 817 826.99。此外,以蔥為內(nèi)標,對以上蜘蛛抱蛋屬植物的核DNA含量進行測定和估算,首次估測了11種蜘蛛抱蛋植物的核DNA含量,蜘蛛抱蛋的DNA含量與已有報道的結(jié)果相近。其中,二倍體植物的核DNA含量為14.16~18.73 Gb;四倍體輻花蜘蛛抱蛋的核DNA含量為28.33 Gb;六倍體泰國蜘蛛抱蛋的核DNA含量為43.03 Gb。結(jié)果可為蜘蛛抱蛋屬植物的遺傳育種研究、全基因組研究以及喀斯特植物的起源與演化研究提供重要科學(xué)依據(jù)。
關(guān)鍵詞 蜘蛛抱蛋屬;染色體數(shù)目;流式細胞術(shù);倍性水平;核DNA含量
DNA是生物體內(nèi)遺傳信息的攜帶者,控制著生物體的生存和繁衍[1]。生物體內(nèi)的DNA含量通常是恒定的,借助流式細胞術(shù)可成功測定植物的核DNA含量,為基因組學(xué)和進化生物學(xué)等領(lǐng)域的研究提供理論基礎(chǔ)[2-3]。Galbraith等[4]首次應(yīng)用流式細胞儀成功檢測了17種植物的DNA含量,開創(chuàng)了流式細胞術(shù)應(yīng)用于植物學(xué)研究的先河。此后,由于流式細胞術(shù)具有操作簡便、高效且結(jié)果準確等優(yōu)點,被廣泛應(yīng)用于植物核DNA含量的測定和倍性鑒定[5-8]。
倍性鑒定不僅是評價植物nNlZLWTC/C+0A1bfm0hh+3Q09rkrzBZGGXJucaL4OXw=資源的主要內(nèi)容,還對植物資源的開發(fā)利用具有重要的意義。植物倍性水平檢測的主要方法有染色體制片計數(shù)法和流式細胞術(shù)法[9]。傳統(tǒng)的植物倍性檢測主要依靠染色體制片計數(shù)法,該方法操作技術(shù)難度大且耗時長,不宜大規(guī)模對植株開展倍性鑒定;而流式細胞術(shù)法具有操作簡單、快速、結(jié)果可靠等優(yōu)點,在很大程度上克服了傳統(tǒng)染色體制片計數(shù)法的缺點,常用于植物種質(zhì)資源和遺傳研究中植株倍性的快速批量檢測,如蘋果、棗、葡萄、百合、杏、吊鐘花屬、石斛以及涼粉草等[10-17]。
流式細胞術(shù)能夠成功檢測植株倍性的關(guān)鍵在于獲得高質(zhì)量的細胞核懸浮液[18]。目前,已報道多種提取細胞核的解離液,如沈捷等[19]選擇Lysis buffer LB01作為制備杉木根尖細胞核懸液的最佳分離緩沖液。吳麗萍等[20]發(fā)現(xiàn)WPB解離液適合制備棗屬植物細胞核懸液。鄒璇等[21]比較了WPB解離液、Tris·MgCl2解離液、Galbraith’s解離液以及LB01解離液對玉蘭亞屬植物葉片細胞核懸液的裂解效果,結(jié)果發(fā)現(xiàn)WPB解離液最適合木蘭科玉蘭亞屬植物。劉鳳霞等[22]發(fā)現(xiàn)Galbraith’s解離液為提取梨葉片細胞核的適宜緩沖液。由于不同類群的植物體內(nèi)所含的化學(xué)成分復(fù)雜多樣,在采用流式細胞術(shù)建立特定類群植物的倍性鑒定和DNA含量的測定體系時,需要比較不同解離液的裂解效果,篩選出適合的解離液,甚至可能需要對篩選出來的解離液的成分進行適當改良,以獲得最佳的細胞核分離效果。[JP]
蜘蛛抱蛋屬(Aspidistra)為多年生草本植物,隸屬于天門冬科(Asparagaceae),原產(chǎn)于亞洲東部的熱帶和亞熱帶地區(qū),在全世界范圍內(nèi)已知該屬植物200余種,其中尤以中國西南部和越南北部地區(qū)產(chǎn)的種類最為豐富[23-24]。蜘蛛抱蛋屬植物種類眾多,具有一定的觀賞價值,其葉子四季常青,且葉片上帶些許黃色或白色的斑點或條紋,是插花藝術(shù)上常用的高級葉材[25]。該屬植物的根狀莖在民間可作藥用,具有一定的藥用價值[26]。目前,通過傳統(tǒng)的染色體制片計數(shù)法已報道了65種[27]蜘蛛抱蛋屬植物的染色體倍性,分別有二倍體(2n = 36或2n = 38)、四倍體(2n=76)以及六倍體(2n=114)。通過流式細胞術(shù)測定蜘蛛抱蛋屬植物的核DNA含量的研究資料較少,僅Bharathan等[28]利用流式細胞術(shù)報道過蜘蛛抱蛋(A.elatior)的C值為17.90 pg。本研究以蜘蛛抱蛋屬植物的成熟葉片為材料,篩選出適合蜘蛛抱蛋屬植物的細胞核解離液,擬建立一套蜘蛛抱蛋屬植物的倍性檢測和核DNA含量的測定體系,為蜘蛛抱蛋屬的基因組學(xué)研究、系統(tǒng)發(fā)育和進化研究提供科學(xué)依據(jù),同時也為該屬植物種質(zhì)資源的開發(fā)和利用以及遺傳育種提供技術(shù)支持。
1 材料與方法
1.1 試驗材料
野外采集產(chǎn)自中國4個省(自治區(qū))9個縣以及泰國清邁的蜘蛛抱蛋屬植物的活體植株(表1)。移栽于廣西民族大學(xué)溫室大棚中,其成熟葉片用于流式細胞術(shù)檢測,幼嫩的根尖用于染色體制片實驗。
1.2 試驗方法
1.2.1 植物細胞核解離液的配制 共選用4種細胞核解離液,分別為WPB解離液[29]、LB01解離液[30],Galbraith’s解離液[31]以及改良的Galbraith’s解離液,成分及配制方法見表2。其中,改良Galbraith’s解離液是在Galbraith’s解離液原有成分的基礎(chǔ)上,增加了聚乙烯吡咯烷酮(PVP),二硫蘇糖醇(DTT),抗壞血酸,乙二胺四乙酸(EDTA)以及β-巰基還原劑。
1.2.2 流式細胞術(shù)檢測法 (1)細胞核懸液的制備:稱取0.5~1 g葉片,加入1~2 mL預(yù)冷的細胞核解離液,冰上快速垂直切割樣品。經(jīng)40 μm的濾膜過濾,4 ℃ 孵育5 min,后離心5 min (1 000 r/min)棄上清,加入500 μL 預(yù)冷的細胞核解離液、20 μL 1 mg/mL RNase溶液和20 μL 1 mg/mL PI(碘化丙啶)熒光染液,混勻得到細胞核懸液,避光染色0.5~1 h。
(2)流式細胞儀檢測和分析:使用美國Becton Dickinson公司的BD Accuri C6 Plus流式細胞儀,采用FL2通道,每張葉片進行3次生物學(xué)重復(fù),每個樣品檢測至少10 000個細胞,取平均值。
使用流式細胞儀自帶的軟件BD Accuri C6 Plus 對流式細胞術(shù)試驗的數(shù)據(jù)進行采集和分析,得到各樣品的峰值直方圖。以CV值(DNA峰的變異系數(shù))的大小評價流式測定結(jié)果數(shù)據(jù)質(zhì)量的優(yōu)劣,樣品平均峰值的變異系數(shù)CV%(coefficientof variation)大于8%的結(jié)果予以舍棄[32]。
(3)倍性鑒定和DNA含量測定:采用二倍體輻花蜘蛛抱蛋(Aspidistra subrotata)為倍性檢測的外部參照[33],推測蜘蛛抱蛋屬其他物種的倍性水平,計算公式為:DNA含量比值=待測樣品DNA含量熒光強度峰值均值/對照樣品DNA含量熒光強度峰值均值。
以已完成全基因組測序的蔥(Allium fistulosum)[34]作為測定蜘蛛抱蛋屬植物細胞核DNA含量的內(nèi)部參照,即標準樣品的核DNA含量為 11.27 Gb。計算公式為:細胞核DNA含量 (Gb)=待測樣品的DNA含量熒光強度峰值均值/標準樣品的DNA含量熒光強度峰值均值×標準樣品的核DNA含量。
1.2.3 染色體制片計數(shù)法 取生長活躍的根尖置于0.1%的秋水仙素溶液中室溫處理2.5~3 h后水洗2~3次,轉(zhuǎn)移至卡諾固定液(冰乙酸∶無水乙醇為1∶3)中處理30 min。取已固定的根尖水洗2~3次后,置于1 mol/L鹽酸與45%醋酸混合液(比例為1∶1)中,60 ℃水浴5 min,解離后水洗2~3次,晾干1 min,再放入卡寶品紅染色液中染色1 h以上。取已染色的根尖分生區(qū)前端置于載玻片上,滴加適量的45%醋酸后制片。使用Leica DM2000顯微鏡觀察20個以上的細胞,選取染色體形態(tài)清晰、分散性好的3~5個中期細胞拍照并統(tǒng)計染色體數(shù)目。
2 結(jié)果與分析
2.1 蜘蛛抱蛋屬植物成熟葉片的細胞核懸浮液的制備和優(yōu)化
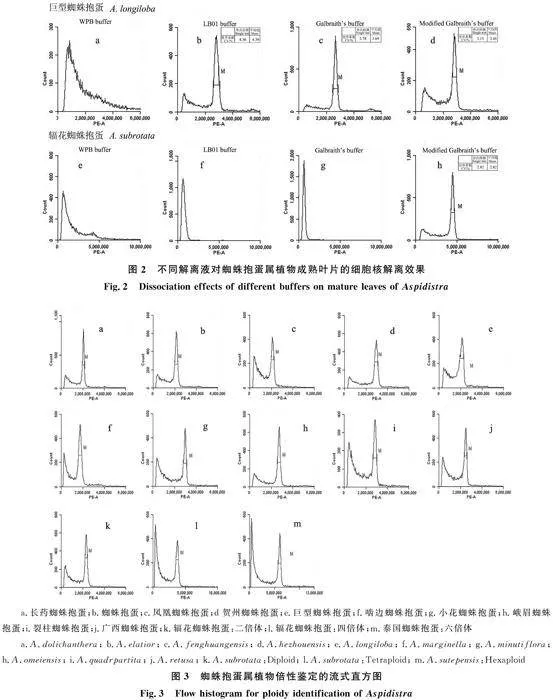
為獲得適合蜘蛛抱蛋屬植物成熟葉片的細胞核解離液,本研究以巨型蜘蛛抱蛋和四倍體輻花蜘蛛抱蛋的成熟葉片為材料,比較WPB、LB01、Galbraith’s以及改良Galbraith’s共4種細胞核解離液的裂解效果。在二倍體巨型蜘蛛抱蛋中,利用4種解離液制備的細胞核懸液的顏色均為綠色。在四倍體輻花蜘蛛抱蛋中,使用WPB和改良Galbraith’s解離液制備的細胞核懸液為綠色,而使用LB01以及Galbraith’s解離液制備的細胞核懸液為紅褐色(圖1)。
通過流式細胞儀測定發(fā)現(xiàn),在巨型蜘蛛抱蛋中使用WPB解離液的獲得的細胞碎片多,無DNA主峰,裂解效果差(圖2-a);而使用LB01解離液、Galbraith’s解離液以及改良Galbraith’s解離液可獲得DNA峰,其變異系數(shù)CV均值分別為4.39%、3.64%、3.45%(圖2-b~2-d)。可見,使用LB01解離液、Galbraith’s解離液以及改良Galbraith’s解離液均可用于制備巨型蜘蛛抱蛋的細胞核懸液且效果較好,其中改良Galbraith’s解離液制備的細胞核懸液效果最好。
四倍體輻花蜘蛛抱蛋的流式細胞儀測定的結(jié)果表明,WPB解離液、LB01解離液以及Galbraith’s解離液制備的細胞核懸液均無法獲得DNA峰(圖2-e~2-g),而改良Galbraith’s解離液制備的細胞核懸液可獲得DNA峰,其變異系數(shù)CV均值為2.82%(圖2-h)。
可見,改良Galbraith’s解離液能夠更廣泛地適用于蜘蛛抱蛋屬植物成熟葉片的細胞核懸液的制備且效果較好。
2.2 蜘蛛抱蛋屬植物的倍性鑒定
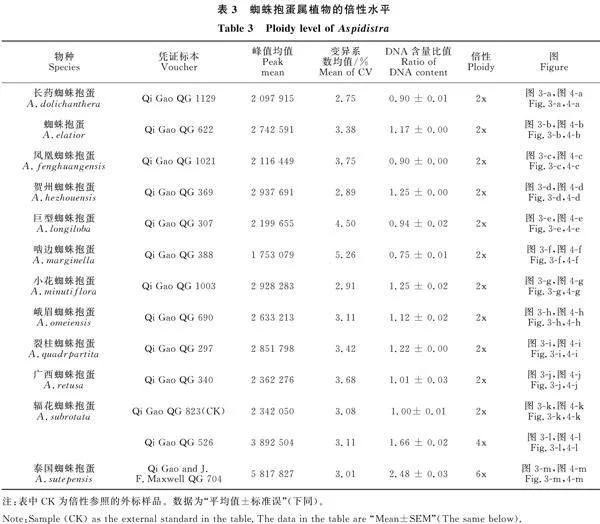
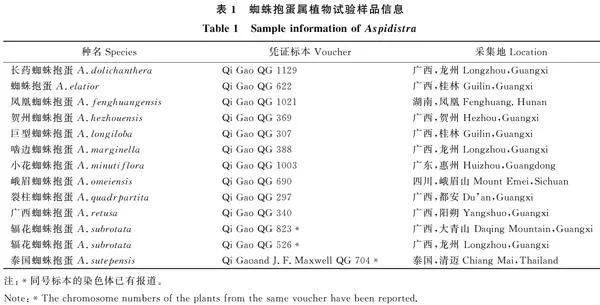
使用改良Galbraith’s解離液制備12種13個居群的蜘蛛抱蛋屬植物成熟葉片的細胞核懸液,通過流式細胞術(shù)檢測12種蜘蛛抱蛋屬植物的倍性(圖3)。結(jié)果表明,12種蜘蛛抱蛋屬植物DNA熒光強度峰值均值的范圍為1 753 078~ 5 817 827,變異系數(shù)均值為2.75%~5.26%,均小于8%,說明試驗樣品的數(shù)據(jù)質(zhì)量可信度高,檢測結(jié)果準確(表3)。
以二倍體的輻花蜘蛛抱蛋為外標(圖3-k),發(fā)現(xiàn)10種蜘蛛抱蛋屬植物的DNA含量熒光強度的峰值均值與對照樣本的DNA含量熒光強度的峰值均值接近,其峰值均值范圍為1 753 079~2 937 691,DNA含量比值范圍為0.75~1.25,估測為二倍體;輻花蜘蛛抱蛋的DNA含量熒光強度峰值均值分別為2 342 050和3 892 505,其DNA含量比值為1和1.66,分別位二倍體和四倍體;泰國蜘蛛抱蛋的DNA含量熒光強度峰值均值為5 817 827,其DNA含量比值為2.48,為六倍體。
2.3 常規(guī)染色體制片計數(shù)法的結(jié)果
本研究利用常規(guī)染色體制片計數(shù)法驗證流式細胞術(shù)的倍性鑒定結(jié)果,結(jié)果表明10種蜘蛛抱蛋屬植物為二倍體,其染色體數(shù)目分別為2n=36 或2n=38;輻花蜘蛛抱蛋存在二倍體和四倍體,染色體數(shù)目分別為2n=38和2n=76;泰國蜘蛛抱蛋為六倍體,染色體數(shù)目為2n=114(圖4)。染色體制片計數(shù)法的倍性檢測結(jié)果與流式細胞術(shù)的檢測結(jié)果一致。
2.4 12種蜘蛛抱蛋屬植物核DNA含量
以蔥作為內(nèi)部參照,通過流式細胞儀測定蜘蛛抱蛋屬12種13個居群植物的細胞核DNA熒光強度(圖5)。通過計算可知(表4),12種蜘蛛抱蛋屬植物的核DNA含量為14.16 Gb~43.03 Gb。其中,二倍體蜘蛛抱蛋屬植物的核DNA含量為14.16 Gb~18.73 Gb;長藥蜘蛛抱蛋的核DNA含量最小,為14.16 Gb;小花蜘蛛抱蛋的核DNA含量最大,為18.73 Gb。四倍體輻花蜘蛛抱蛋的核DNA含量為28.33 Gb,六倍體泰國蜘蛛抱蛋的核DNA含量為43.03 Gb。蜘蛛抱蛋屬13個不同居群植物的核DNA含量的方差分析表明(表4),該屬的六倍體泰國蜘蛛抱蛋和四倍體輻花蜘蛛抱蛋的核DNA含量存在顯著性差異 (P<0.05),六倍體泰國蜘蛛抱蛋、四倍體輻花蜘蛛抱蛋與其他二倍體物種的核DNA含量存在顯著性差異(P<0.05)。
3 討論與結(jié)論
流式細胞儀成功鑒定植物倍性的關(guān)鍵在于制備高質(zhì)量的單顆粒細胞核懸液,而影響細胞核懸液制備的主要因素是植物材料和細胞核解離液[35-37]。在進行細胞流式試驗測定時,大多使用嫩葉作為制備材料,并配合使用特定的細胞核解離液,以獲得高質(zhì)量的單顆粒細胞核懸液。本研究中,由于受到植物生長發(fā)育周期的限制,不易獲得蜘蛛抱蛋屬植物的嫩葉,因此需要篩選出適合于裂解成熟葉片的裂解液。WPB、LB01、Galbraith’s為常用的細胞核解離液。在本研究中,WPB解離液不適用于制備蜘蛛抱蛋屬植物成熟葉片的細胞核懸液,LB01、Galbraith’s解離液對巨型蜘蛛抱蛋的解離效果較好。變異系數(shù)(CV)作為檢測經(jīng)流式細胞儀分析細胞核懸液所形成直方圖中DNA峰的數(shù)據(jù)準確性的主要指標,其值越小,數(shù)據(jù)準確性以及可靠性越高。因此,通過比較DNA峰的變異系數(shù)CV值,發(fā)現(xiàn)Galbraith’s解離液的效果最好。然而,利用LB01、Galbraith’s解離液制備輻花蜘蛛抱蛋的成熟葉片細胞核懸液時均發(fā)生褐化現(xiàn)象。為了找到適用于輻花蜘蛛抱蛋的細胞核解離液,本研究對Galbraith’s解離液的配方進行改良,改善了細胞核懸液制備過程中的褐化現(xiàn)象。此外,經(jīng)改良Galbraith’s解離液制備的細胞核懸液還可普遍用于蜘蛛抱蛋屬的其他種類,且解離效果優(yōu)于其他解離液。
在流式細胞分析試驗中,標準物的選擇對檢測植物的核DNA含量非常重要。早期研究中,應(yīng)用流式細胞術(shù)測定核DNA含量時多選用雞紅細胞作為內(nèi)標[38]。但Johnson等[39]認為應(yīng)用流式細胞術(shù)的檢測對象為植物時,應(yīng)當選擇植物材料作為檢測核DNA含量的內(nèi)標。對于內(nèi)標植物的選擇,應(yīng)選擇已知DNA含量且穩(wěn)定,與待測植物的核DNA含量接近[36]。本研究選擇了已完成全基因組測序的蔥[34]作為內(nèi)標植物,經(jīng)試驗獲得的內(nèi)標峰與待測樣品峰易于區(qū)分。Bharathan等[28]曾報道蜘蛛抱蛋的核DNA含量約為17.90 Gb,與本研究中獲得的蜘蛛抱蛋的核DNA含量的結(jié)果相近。可見,基于流式細胞術(shù)的蜘蛛抱蛋屬植物核DNA含量的測定數(shù)據(jù)可靠,重復(fù)性高。
本研究以成熟葉片作為試驗材料,通過對Galbraith’s解離液的改良,分別選擇輻花蜘蛛抱蛋作為外標植物、蔥作為內(nèi)標植物,建立了一套適用于蜘蛛抱蛋屬植物倍性檢測和核DNA含量測定的體系,首次報道了11種蜘蛛抱蛋屬植物的核DNA含量,為該屬植物的遺傳育種研究、全基因組研究以及喀斯特植物的起源與演化研究提供重要科學(xué)依據(jù)。
參考文獻 Reference:
[1] 梁 華,蔣 露,朱大海,等.中國吊鐘花屬植物核DNA含量(2C-值)與倍性水平研究[J].廣西植物,2022,42(1):58-67.
LIANG H,JIANG L,ZHU D H,et al.Nuclear DNA content ( 2C-value ) and ploidy level of Enkianthus species (Ericaceae) from China[J].Guihaia,2022,42(1):58-67.
[2]齊香玉,陳雙雙,馮 景,等.3種瓣型茉莉基因組大小測定與比較[J].江蘇農(nóng)業(yè)科學(xué),2020,48(19):40-44.
QI X Y,CHEN SH SH,F(xiàn)ENG J,et al.Determination and comparision of genome size of three types of Jasminum sambac[J].Jiangsu Agricultural Science,2020,48(19):40-44.
[3]WU H,SU W,SHI M,et al.Genomic c-value variation analysis in jujube (Ziziphus jujuba Mill.) in the middle Yellow River basin[J].Plants (Basel),2023,12(4):1-13.
[4]GALBRAITH D W,HARKINS K R,MADDOX J M,et al.Rapid flow cytometric analysis of the cell cycle in intact plant tissues[J].Science,1983,220(4601):1049-1051.
[5]嚴東瑩,李 艷,孫文禮,等.基于流式細胞術(shù)的海菜花屬植物基因組大小測定[J].植物科學(xué)學(xué)報,2020,38(2):173-180.
YAN D Y,LI Y,SUN W L,et al.Estimation of genome sizes of plants from Ottelia Pers.based on flow cytometry[J].Plant Science Journal,2020,38(2):173-180.
[6]段一凡,李 嵐,楊欣欣,等.桂花及其近緣種倍性和基因組大小分析[J].南京林業(yè)大學(xué)學(xué)報(自然科學(xué)版),2021, 45(5):47-52.
DUAN Y F,LI L,YANG X X,et al.Study on ploidy and genome sizes of Osmanthus fragrans and its related species[J].Journal of Nanjing Forestry University ( Natural Sciences Edition ),2021,45(5):47-52.
[7]李春牛,李先民,黃展文,等.利用流式細胞術(shù)鑒定茉莉花基因組大小和染色體倍性[J].熱帶作物學(xué)報,2021,42(5):1231-1236.
LI CH N,LI X M,HUANG ZH W,et al.Genome size estimation and ploidy identification of Jasminum sambac by flow cytometry[J].Chinese Journal of Tropical Crops,2021,42(5):1231-1236.
[8]PELLICER J,LEITCH I J.The application of flow cytometry for estimating genome size and ploidy level in plants[J].Methods in Molecular Biology,2014,1115:279-307.
[9]王 珧.甘薯及其近緣野生種基因組大小及倍性鑒定[D].海口:海南大學(xué),2020.
WANG Y.Genome size and ploidy of sweetpotato and its wild relatives[D].Hai`kou:Hainan University,2020.
[10] 張 虹,路國棟,趙 帥,等.利用流式細胞儀鑒定植物倍性的研討[J].分子植物育種,2020,18(11):3713-3717.
ZHANG H,LU G D,ZHAO SH,et al.Discussion on identification of plant ploidy by flow cytometry[J].Molecular Plant Breeding,2020,18(11):3713-3717.
[11]石蔭坪,束懷瑞.利用流式細胞光度術(shù)鑒定蘋果倍性的研究[J].西北植物學(xué)報,1998,18(4):26-30.
SHI Y P,SHU H R.Use of flow cytometry for identification of ploidy in apple[J].Acta Botanica Boreali-Occidentalia Sinica,1998,18(4):26-30.
[12]王利虎,呂 曄,羅 智,等.流式細胞術(shù)估測棗染色體倍性和基因組大小方法的建立及應(yīng)用[J].農(nóng)業(yè)生物技術(shù)學(xué)報,2018,26(3):511-520.
WANG L H,L Y,LUO ZH,et al.Establishment and application of a method for chromosome ploidy identification and genome size estimation using flow cytometry in Ziziphus jujuba[J].Journal of Agricultural Biotechnology,2018,26(3):511-520.
[13]裴 丹,葛孟清,董天宇,等.208個葡萄品種染色體倍性的流式細胞分析[J].中外葡萄與葡萄酒,2019(5):21-28.
PEI D,GE M Q,DONG T Y,et al.Analysis of ploidy of 208[JP2] grape varieties by FCM[J].Sino-overseas Grapevine & [JP]Wine,2019(5):21-28.
[14]陳敏敏,張永春,蔡友銘,等.利用流式細胞術(shù)快速鑒定61份百合品種倍性[J].上海農(nóng)業(yè)學(xué)報,2020,36(6):13-17.
CHEN M M,ZHANG Y CH,CAI Y M,et al.Ploidy identification of 61 lily cultivars by flow cytometry[J].Acta Agriculturae Shanghai,2020,36(6):13-17.
[15]楊 麗,孫浩元,張俊環(huán),等.利用流式細胞術(shù)鑒定杏及其部分近緣植物的倍性[J].西北農(nóng)業(yè)學(xué)報,2021,30(10):1504-1513.
YANG L,SUN H Y,ZHANG J H,et al.Ploidy identification of germplasm resources of Apricot and its wild relatives by flow cytometry[J].Acta Agriculturae Boreali-occidentalis Sinica,2021,30(10):1504-1513.
[16]熊文艷,普 冉,劉云禮,等.基于流式細胞術(shù)對27種石斛的倍性鑒定和基因組大小分析[J].熱帶作物學(xué)報,2022,43(11):2249-2257.
XIONG W Y,PU R,LIU Y L,et al.Estimation ploidy and genome size of 27 Dendrobium species by flow cytometry[J].Chinese Journal of Tropical Crops,2022,43(11):2249-2257.
[17]鐘玲安,鄒 璇,李珂清,等.涼粉草不同種質(zhì)的染色體倍性與基因組大小研究[J].中藥材,2023,46(3):548-553.
ZHONG L A,ZOU X,LI K Q,et al.Study on the chromosome ploidy and genome size of different germplasms of Mesona chinensis[J].Journal of Chinese Medicinal Materials,2023,46(3):548-553.
[18]齊嫣然,王英平,郝小麗,等.DNA流式細胞術(shù)及其在植物基因組大小與倍性檢測中的研究與應(yīng)用[J].分子植物育種,2020,20(7):2279-2285.
QI Y R,WANG Y P,HAO X L,et al.DNA flow cytometry and its application in the detection of plant genome size and ploidy[J].Molecular Plant Breeding,2020,20(7):2279-2285.
[19]沈 捷,徐 進,劉光欣,等.不同分離緩沖液對杉木根尖細胞核懸液DNA分辨率的影響[J].分子植物育種,2015, 13(1):190-196.
SHEN J,XU J,LIU G X,et al.Effects of different isolation buffers on DNA resolution in nucleus suspension of root tip cell of Cunninghamia lanceolata(Lamb.) Hook.[J].Molecular Plant Breeding,2015,13(1):190-196.
[20]吳麗萍,唐 巖,李穎岳,等.棗和酸棗基因組大小測定[J].北京林業(yè)大學(xué)學(xué)報,2013,35(3):77-83.
WU L P,TANG Y,LI Y Y,et al.Estimation of genome size of Ziziphus jujuba and Z.acdiojujuba[J].Journal of Beijing Forestry University,2013,35(3):77-83.
[21]鄒 璇,孫李勇,萬小霞,等.玉蘭亞屬多倍體植物DNA C-值流式細胞術(shù)測定體系的建立[J].植物科學(xué)學(xué)報,2020,38(3):369-377.
ZOU X,SUN L Y,WAN X X,et al.Establishment of flow cytometry system for DNA C-value determination of polyploid species in subgenus Yulania[J].Plant Science Journal,2020,38(3):369-377.
[22]劉鳳霞,李京一,王志剛,等.適合流式細胞儀分析的梨葉片細胞核提取緩沖液篩選[J].農(nóng)業(yè)生物技術(shù)學(xué)報,2018,26(6):1034-1042.
LIU F X,LI J Y,WANG ZH G,et al.The screening of the optimum buffer to produce pear (Pyrus) leaf nuclear suspensions for flow cytometry analysis[J].Journal of Agricultural Biotechnology,2018,26(6):1034-1042.
[23]MO F Y,ZHANG S Z,LIN C R,et al.Aspidistra latistyla (Asparagaceae),a new species from China[J].Phytotaxa,2021,512(1):73-78.
[24]羅新燕,徐文芬,何順志.蜘蛛抱蛋屬Aspidistra Ker-Gawl.植物的初步研究[J].貴州科學(xué),2018,36(6):1-11.
LUO X Y,XU W F,HE SH ZH.Preliminary study on Aspidistra Ker-Gawl[J].Guizhou Science,2018,36(6):1-11.
[25]呂惠珍,黃寶優(yōu),潘春柳,等.蜘蛛抱蛋屬植物研究概況[J].廣東農(nóng)業(yè)科學(xué),2016,43(9):17-25.
L H ZH,HUANG B Y,PAN CH L,et al.Research review of Aspidistra (Asparagaceae)[J].Guangdong Agricultural Sciences,2016,43(9):17-25.
[26]劉安莉,呂定豪,王 霞,等.蜘蛛抱蛋屬植物分類學(xué)研究進展[J].貴州科學(xué),2020, 38(3):35-41.
LIU A L,L D H,WANG X,et al.Research advances in taxonomy of Aspidistra[J].Guizhou Science,2020, 38(3):35-41.
[27]CHEN T T,CHEN M Q,GAO M,et al. Cytological study on Aspidistra from Thailand[J].Cytologia,2023, 88(1):83-87.
[28]BHARATHAN G,LAMBERT G,GALBRAITH D W.Nuclear DNA content of monocotyledons and related taxa[J].American Journal of Botany,1994,81(3):381-386.
[29]LOUREIRO J,RODRGUEZ E,DOLEZEL J,et al.Two new nuclear isolation buffers for plant DNA flow cytometry:A test with 37 species[J].Annals of Botany,2007,100:875-888.
[30]DOLEZEL J,GREILHUBER J,SUDA J.Estimation of nuclear DNA content in plantsusing flow cytometry[J].Nature Protocols,2007,2(9):2233-2244.
[31]ORTIZ-RAMIREZ C,AREVALO E D,XU X,et al.An efficient cell sorting protocol for maize protoplasts[J].Current Protocols in Plant Biology,2018,3(3):e20072.
[32]林 丹,李冰冰,趙振利,等.基于流式細胞儀對不同品種泡桐倍性及白花泡桐基因組大小的測定[J].河南農(nóng)業(yè)大學(xué)學(xué)報,2019,53(3):337-342,399.
LIN D,LI B B,ZHAO ZH L,et al.Determination of ploidy of different paulownia species and genome size of Paulownia fortunei based on flow cytometry[J].Journal of Henan Agricultural University,2019,53(3):337-342,399.
[33]CHEN J S,GAO Q,ZHOU H,et al.Distribution,karyomorphology,and morphology of Aspidistra subrotata (Asparagaceae) at different ploidy levels in limestone areas of Asia[J].Comparative Cytogenetics,2017,11(1):1-13.
[34]LIAO N,HU Z,MIAO J,et al.Chromosome-level genome assembly of bunching onion illuminates genome evolution and flavor formation in Allium crops[J].Nature Communications,2022,13(1):6690-6674.
[35]王利虎,張 瓊,陳 凱,等.流式細胞術(shù)在植物倍性鑒定及基因組大小估測中的應(yīng)用策略[J].分子植物育種,2021,19(17):5833-5841.
WANG L H,ZHANG Q,CHEN K,et al.Application strategy of flow cytometry in plant ploidy identification and genome size estimation[J].Molecular Plant Breeding,2021,19(17):5833-5841.
[36]田新民,周香艷,弓 娜.流式細胞術(shù)在植物學(xué)研究中的應(yīng)用——檢測植物核DNA含量和倍性水平[J].中國農(nóng)學(xué)通報,2011,27(9):21-27.
TIAN X M,ZHOU X Y,GONG N.Application of flow cytometry in plant research——Analysis of nuclear DNA content and ploidy level in plant cell[J].Chinese Agricultural Science Bulletin,2011,27(9):21-27.
[37]金 亮,徐偉韋,李小白,等.DNA流式細胞術(shù)在植物遺傳及育種中的應(yīng)用[J].中國細胞生物學(xué)學(xué)報,2016,38(2):225-234.
JIN L,XU W W,LI X B,et al.Application of DNA flow cytometry to plant genetics and breeding[J].Chinese Journal of Cell Biology,2016,38(2):225-234.
[38]武榮花,葛蓓蓓,王茂良,等.應(yīng)用流式細胞術(shù)測定18個中國古老月季基因組大小[J].北京林業(yè)大學(xué)學(xué)報,2016, 8(6):94-100.
WU R H,GE B B,WANG M L,et al.Estimation of genome size of eighteen Chinese old garden roses by flow cytometry[J].Journal of Beijing Forestry University,2016,38(6):94-100.
[39]JOHNSTON J S,BENNETT M D,RAYBURN A L, et al.Reference standards for determination of DNA content of plant nuclei[J].American Journal of Botany,1999, 86(5):609-613.
Establishment of a System for Estimating Ploidy Level and Nuclear DNA Content of Aspidistra Baed on Flow Cytometry
CHEN Tingting1,2,MA Junpeng1,HUANG Yingying1,LIANG Guibing1,ZHOU Hao1 and GAO Qi1
(1.School of Marine Sciences and Biotechnology,Guangxi Minzu University,Nanning 530006,China;2.Nanning Nornal Universisty,Nanning 530001,China)
Abstract To establish a flow cytometry method for determining the ploidy level and nuclear DNA content in the genus Aspidistra,we compared the effects of nuclear suspension prepared with WPB buffer,LB01 buffer,Galbraith’s buffer and modified Galbraith’s buffer with the mature leaves.The results showed that the modified Galbraith’s buffer could be more widely and effectively applied to prepare nuclear suspension of mature leaves of Aspidistra.Using the modified Galbraith’s buffer,we detected and verified ploidy level of 12 species from 13 populations within this genus using chromosome counting method.The peak fluorescence intensity of DNA content of 12 species ranged from 1 753 078.81 to 5 817 826.99.Among these,the peak value of 11 diploid plant ranged from 1 753 078.81 to 2 937 690.80,while the tetraploid A.subrotata was 3 892 503.69,and the hexploid A.sutepensis was 5 817 826.99.In addition,the nuclear DNA content of the above plants was measured using Allium fistulosum as internal standard.The nuclear DNA content of 11 species of plants was estimated for the first time,and the DNA content of A.elatior was similar to the reported results.The nuclear DNA content of diploid plants ranged from 14.16 to 18.73 Gb,the tetraploid A.subrotata was 28.33 Gb,and the hexaploid A.sutepensis was 43.03 Gb.The results of this study provide an important scientific basis for the research of genetic breeding,whole-genome research,and the exploration of the origin and evolution of karst plants.
Key words Aspidistra; Chromosome number; Flow cytometry; Ploidy level; Nuclear DNA content
Received 2023-09-29 Returned 2023-11-27
Foundation item The National Natural Science Foundation of China (No.31560056);Research Start-up Project of Guangxi Minzu University (No.2018KJQD15).
First author CHEN Tingting,female,master student.Research area:botany.E-mail:1779894174@qq.com
Corresponding author GAO Qi,female,Ph.D,research fellow.Research area:botany.E-mail:qigao_qg@foxmail.com
(責(zé)任編輯:潘學(xué)燕 Responsible editor:PAN Xueyan)
基金項目:國家自然科學(xué)基金(31560056);廣西民族大學(xué)引進人才科研啟動項目(2018KJQD5)。
第一作者:陳婷婷,女,碩士研究生,研究方向為植物學(xué)。E-mail:1779894174@qq.com
通信作者:高 乞,女,博士,研究員,研究方向為植物學(xué)。E-mail:qigao_qg@foxmail.com

