腐敗希瓦氏菌4H鉻還原機制的探究
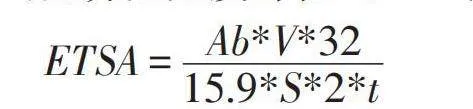

摘要:本文為探究腐敗希瓦氏菌4H還原Cr(VI)的機制,采用掃描電鏡(SEM)、傅里葉紅外光譜(FTIR)、X射線光電子能譜(XPS)、電化學測試等方法進行表征。結果表明腐敗希瓦氏菌4H還原Cr(VI)的機制主要與微生物的代謝和電子傳遞能力有關。通過XPS分析發現細菌在對Cr(VI)的還原過程中,菌體表面有Cr(VI)和Cr(III)兩種形態存在,進一步證明該菌通過還原方法去除六價鉻;掃描電鏡結果顯示,在六價鉻脅迫下細菌表面無明顯破損,菌體形態由短桿型變成了長桿型,說明該菌對Cr(VI)具有很強的耐受性;傅里葉紅外光譜結果顯示隨著初始Cr(VI)濃度的增加,羥基、羧基、酰胺和磷酸基團所代表的特征峰強度也有明顯的增強;細菌電子傳遞性能測試以及電化學測試結果顯示該菌具有很強的電子傳遞能力。本文通過對腐敗希瓦氏菌4H還原Cr(VI)的機制的探究為微生物還原環境中Cr(VI)提供了理論基礎。
關鍵詞:腐敗希瓦氏菌;鉻還原機制;電子傳遞;生物代謝
中圖分類號:Q939.98文獻標志碼:A文章編號:2095-414X(2024)05-0054-06
0引言
鉻是一種常見的重金屬,其天然存在于巖石、動物、植物、土壤以及火山灰中[1],一般以兩種穩定的氧化態存于水體中:六價鉻[Cr(VI)]和三價鉻[Cr(Ⅲ)][2]。其中Cr(VI)對人體有劇毒,且會引發細胞癌變、畸形以及DNA損傷并造成遺傳性的疾病,在水體中Cr(VI)往往以Cr2O72?、CrO42?、HCrO4?的形式存在,在溶液中的相對分布取決于溶液的pH值、Cr(VI)的濃度和氧化還原電位等[3],難以形成不溶性沉淀,而Cr(Ⅲ)毒性較小,容易以Cr(OH)3的形式從溶液中析出。因此探尋將游離的、毒性較大的Cr(VI)還原為穩定的、毒性較小的Cr(Ⅲ)的技術方法已成為當務之急。
希瓦氏菌屬作為一類重要的異化鐵還原菌,其擁有獨特的呼吸系統,不僅能顯著促進自然條件下有毒有機化合物[4]以及染料的降解[5],還能夠利用多種有毒重金屬和放射性元素作為電子受體,從而實現這些重金屬的還原解毒或固定[6]。因此,在重金屬污染水體及土壤修復方面,希瓦氏菌有著極大的應用潛力和優勢。但目前對希瓦氏菌去除Cr(VI)的探究大多基于奧奈達希瓦氏菌MR-1[7],對于腐敗希瓦氏菌去除Cr(VI)的機理研究較少,為深入挖掘希瓦氏菌屬中具有去除六價鉻能力的優勢菌株,本研究以經過長時間六價鉻馴化的Cr(VI)還原菌腐敗希瓦氏菌4H菌株為研究對象,初步揭示了腐敗希瓦氏菌4H對Cr(VI)的還原機制,為希瓦氏菌屬在鉻污染環境修復方面的應用提供了理論依據。
1材料與方法
1.1實驗材料
腐敗希瓦氏菌4H由課題組分離所得,是一株染料高效脫色菌[8],菌株于-80℃超低溫冰箱冷凍保藏。
LB培養基(每升含10 g蛋白胨,5 g酵母粉,10 g NaCl,固體培養基另添加2%瓊脂)。
蔗糖、三羥甲基氨基甲烷(Tris)、Nafion試劑、重鉻酸鉀、甲醛、甲醇購自上海國藥試劑集團,溶菌酶購自BIOSHARP公司。
1.2外膜和周質細胞色素c的測定
挑平板上的單菌落至LB培養基中,待養至對數中期,分別取2%接種量的菌液于終濃度為0、100、300 mg/L Cr(VI)的LB培養基中,120 rpm,30℃培養24 h。利用低溫離心機8000 rpm,4℃下離心5 min收集細胞。將收集的細胞重懸于50 mM PBS緩沖液(pH 7.4)后再次離心,重復三次以洗滌細胞。將洗滌后的細胞重懸于2 mL SL溶液(l mg/mL溶菌酶,20%(w/v)蔗糖,0.01 M Tris,pH 8.40)中并在恒溫培養搖床中于30℃和120 rpm的條件培養1 h,再以8000 rpm低溫離心10 min收集細胞,再將細胞重懸于Tris-Mg2+溶液中,并于30℃培養0.5 h后8000 rpm離心5 min收集上清液,上清液中包含外膜和周質細胞色素c。使用紫外可見分光光度計在520 nm處的吸光度測量細胞色素c的濃度[9]。
1.3電子傳遞系統活性(ETSA)的測定
實驗通過將2-(對-碘苯基)-3-(對-硝基苯基)-5-苯基氯化四氮唑(INT)還原為三苯基甲攢的方法對不同初始Cr(VI)脅迫下細菌的電子傳遞活性進行測定。挑選平板上的單菌落至LB培養基中,待養至對數中期,分別取2%接種量的菌液于終濃度為0、100、300 mg/L Cr(VI)的LB培養基中,120 rpm,30℃培養24 h。利用低溫冷凍離心機(8000 rpm,4℃,5 min)收集細胞。將收集的細胞重懸于50 mM PBS緩沖液(pH 7.4)中,之后再次離心,反復沖洗三次。取5 mL細胞懸液與1 mL 0.2%INT混合于恒溫搖床中120 rpm,30℃培養0.5 h后,添加l mL 37%甲醛終止酶反應。然后將混合物以8000 rpm離心5 min,棄去上清液,再加入5 mL甲醇重懸收集的細胞,將其在恒溫搖床中120 rpm,30℃培養10 min。離心(8000 rpm,5 min)后獲得的上清液通過紫外可見分光光度計在485 nm處讀取吸光度[10]。
其中Ab為485 nm處的吸光度,V為重懸沉淀物甲醇體積,t為反應時間,S為樣品體積。
1.4掃描電鏡分析
將處于對數期的菌懸液分別接種至含Cr(VI)終濃度分別為0、300 mg/L的LB培養基中,于30℃,120 rpm條件下振蕩培養24 h后離心(6000 rpm,4℃,10 min)收集菌體。菌體洗滌后加入2.5%戊二醛溶液固定12 h。將固定后的菌體進一步處理后在臨界點進行干燥,噴金,進行掃描電鏡的觀察[11]。
1.5傅立葉紅外表面官能團測定
采用傅立葉紅外光譜儀(FT-IR)對菌體表面官能團進行表征。將處于對數期的菌懸液分別接種至含Cr(VI)終濃度分別為0、100、300 mg/L的LB培養基中,于30℃,120 rpm條件下振蕩培養24 h后,4℃,6000 rpm條件下離心10 min收集菌體沉淀,并用50 mM的PBS緩沖溶液反復重懸清洗三次后,離心取菌體沉淀,然后進行冷凍干燥。冷凍干燥后的菌體和溴化鉀混合(體積比1:100),用瑪瑙研缽研磨至粉末狀,然后用壓片模具壓片后進行FT-IR分析[12]。
1.6還原產物的XPS分析
將處于對數期的菌懸液接種至初始Cr(VI)濃度為300 mg/L的LB培養基中,于30℃,120 rpm條件下振蕩培養24 h,離心(5000 rpm,4℃,10 min)收集沉淀,離心沉淀用無菌水沖洗后再次離心重復3遍,所得沉淀經冷凍干燥后用于XPS分析。
1.7希瓦氏菌還原Cr(Ⅵ)的電化學表征
采用辰華電化學工作站中循環伏安法(CV)、電化學阻抗譜(EIS)和Tafel曲線探究Cr(VI)對細菌表面電化學性能的影響。檢測采用傳統三電極系統,其中工作電極為玻璃碳電極、參比電極為Ag/AgCl電極和對電極為鉑絲電極,電解液采用50 mM PBS(pH 7.0)緩沖液。玻璃碳電極使用前采用Al2O3拋光打磨并用純水超聲清洗。吸取10 μl不同鉻濃度培養下的菌體至工作電極表面(已加入適量1%Nafion溶液固定),待自然晾干固定后進行測試。CV的掃描速率為0.01 V/s,掃描電壓范圍為-0.80—0.80 V[13]。EIS測試的頻率范圍為1至106 Hz,測試結果采用Zview2.0軟件模擬等效電路,Tafel曲線的掃描速率為10 mV/s[9]。
2結果
2.1希瓦氏菌還原Cr(Ⅵ)電子傳遞性能的影響
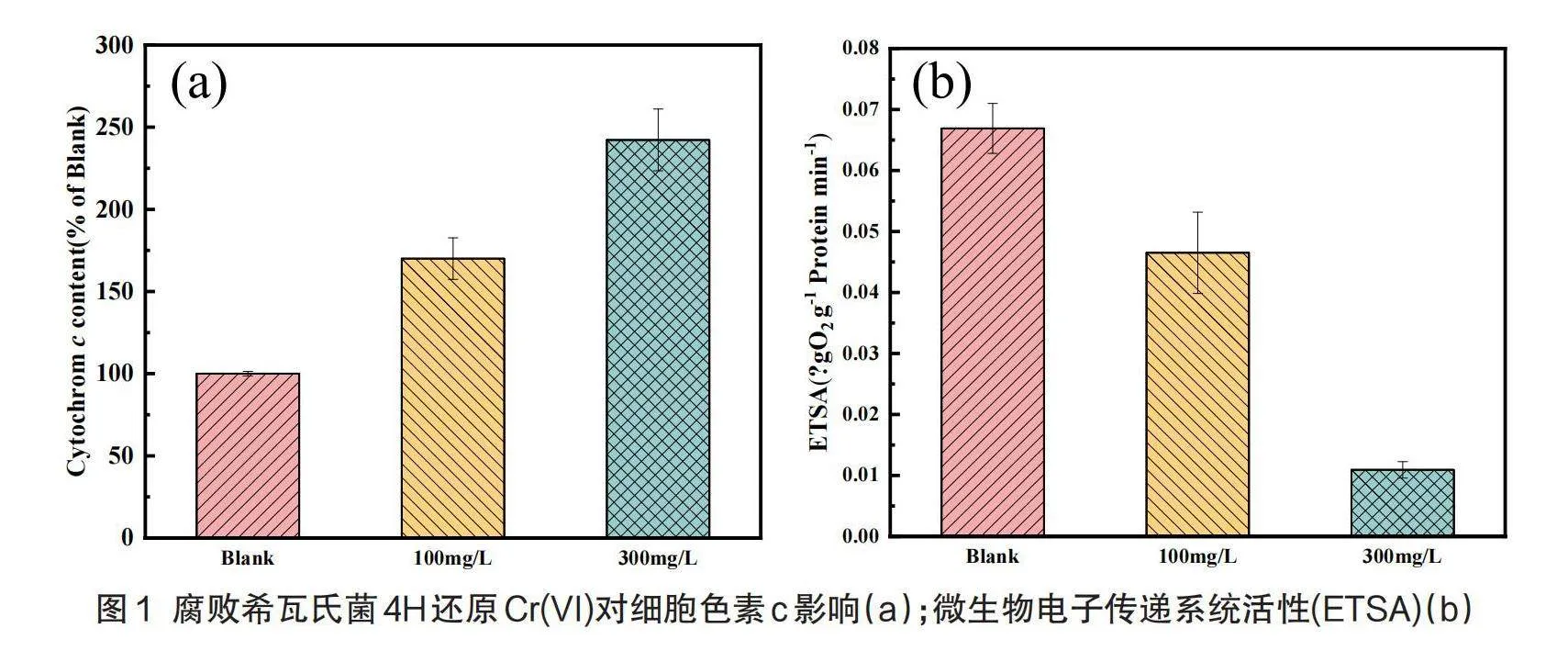
電子傳遞是細胞代謝的基礎,細胞色素c在電子傳遞系統中起著重要作用[14]。由圖1可知100 mg/L鉻脅迫環境下生長的細菌細胞色素c的含量是對照組含量的170.03%,300 mg/L鉻脅迫環境下生長的細菌細胞色素c的含量是對照組含量的242.25%。結果表明隨著鉻濃度的增加,細胞色素c的含量有著顯著的增長,這可能是由于細胞色素c可以加速Cr(VI)的還原,細菌為了抵抗鉻酸鹽的脅迫,通過代謝將Cr(VI)的還原為Cr(Ⅲ)以此來減少鉻對細胞的損害。
此外,以往研究表明,電子傳遞系統活性(ETSA)對微生物的電子傳遞過程起著重要作用,通常用于評估細胞電子傳遞中關鍵酶的活性。由圖1可知細菌于正常環境生長24 h時ETSA為0.067 μgO2 g-1 min-1,而100 mg/L初始Cr(VI)濃度下的ETSA為0.047 μgO2 g-1 min-1,300 mg/L初始Cr(VI)濃度下的ETSA為0.011 μgO2 g-1 min-1,表明隨著初始鉻濃度的增加,反應體系的ETSA降低。這可能是由于Cr(VI)對菌株的毒害作用,當菌株被Cr(VI)毒害時,酶的活性會受到影響,從而直接影響電子傳遞的效率[10]。
2.2掃描電鏡分析
為了深入探究Cr(VI)對細胞膜是否存在破壞,以及觀察鉻脅迫條件下微生物生長形態變化,通過掃描電鏡觀察不同初始Cr(VI)濃度脅迫下腐敗希瓦氏菌4H生長狀態。從圖2(a)和(b)可以觀察到,正常生長的細菌呈現短桿狀,菌體表面光滑平整,生長狀態良好,個體形態明顯。圖2(c)和(d)展示的是在300 mg/L Cr(VI)脅迫濃度下生長24小時后的微生物菌體形態,從圖中可以看出菌體形態變得很長,但表面無明顯破損,細菌整體呈現團聚狀,這可能是由于長期Cr(VI)脅迫干擾了外膜合成,導致異常細胞形態的產生[13],細菌通過形態的改變實現對Cr(VI)脅迫環境下生存的調控。掃描電鏡結果證明了Cr(VI)對細胞膜沒有產生明顯的損壞,腐敗希瓦氏菌4H具有良好的Cr(VI)耐受能力,能夠在高濃度Cr(VI)長時間脅迫條件下生長。
2.3傅里葉紅外光譜分析
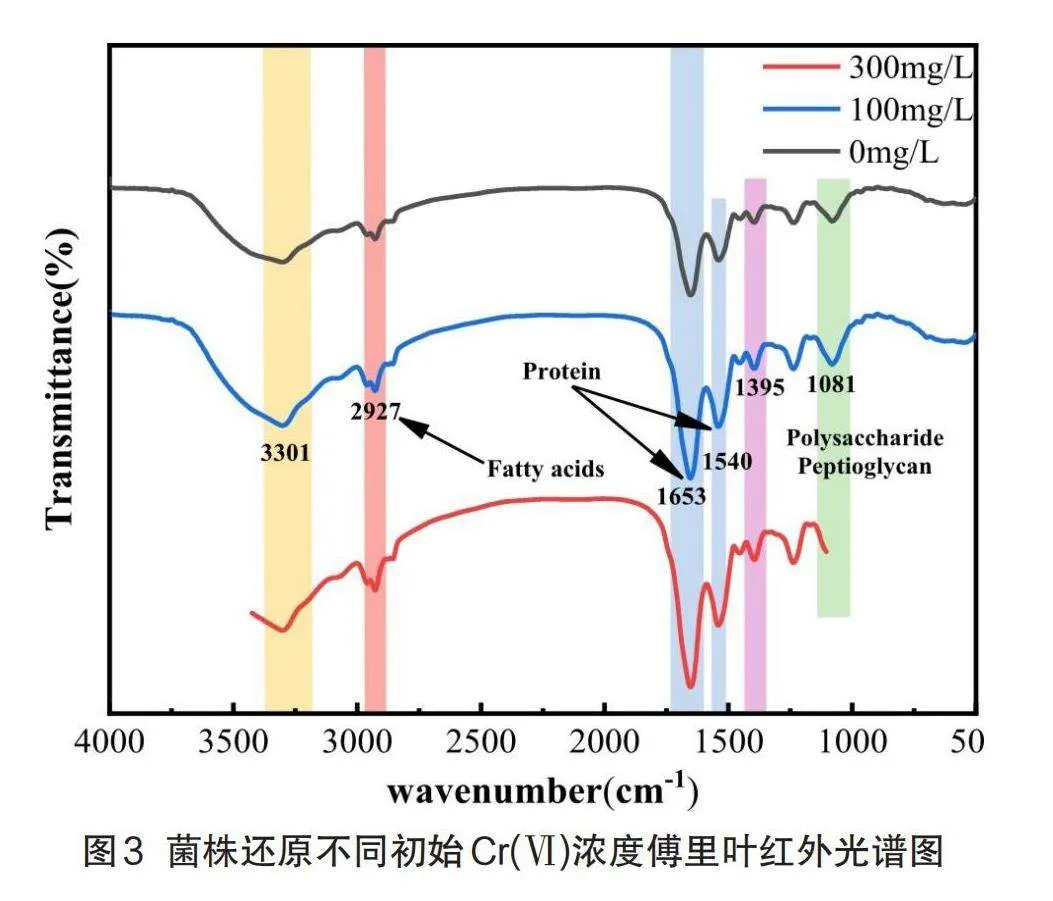
通過對比腐敗希瓦氏菌4H在不同初始Cr(VI)濃度生長24 h后的紅外光譜圖,分析菌體表面官能團對Cr(VI)的作用及影響。如圖3所示3301 cm-1處的所出現的吸收峰是-OH和-NH伸縮振動共同引起的;2927 cm-1處的吸收峰對應細胞膜上拉伸的脂肪鏈(-CH2和-CH3);1653 cm-1處的吸收峰是由酰胺I帶的C=O伸縮振動引起,其所對應的官能團與蛋白質有關,1540cm-1處所出現的峰是由酰胺II帶C-N的伸縮振動和N-H的彎曲振動引起的[15],其對應的官能團也與蛋白質有關,1395 cm-1處出現的峰由C-N伸縮振動產生,其基團主要也來源于蛋白質;1081cm-1處的吸收峰與微生物細胞表面的多糖、脂多糖和肽聚糖等復雜官能團的物質有關。
上述吸收峰在0、100、300 mg/L初始Cr(VI)濃度的譜圖中出峰情況大致相同,說明這些樣品在官能團的種類上差異不是很大,但是在部分特征峰處出現峰強度變大等變化。例如位于3301 cm-1、1653 cm-1、1395 cm-1和1081 cm-1處的吸收峰隨著初始鉻濃度的增加其峰面積發生了明顯的增大[16],表明這些峰所代表的羥基(-OH),酰胺(-CO-NH-)、羧基(-COOH)和磷酸(P=O或P-O)官能團的含量隨著鉻濃度升高而變大[10],說明菌株還原Cr(VI)反應的結合位點主要為羥基、羧基、酰胺和磷酸基團等,而這些大多與細菌的生物大分子的構成、代謝途徑、細胞結構和功能以及細胞信號傳導等方面密切相關,進一步驗證了該菌具有很強的電子傳遞性能以及重金屬代謝能力,對于細菌的生存、環境適應都具有重要意義。
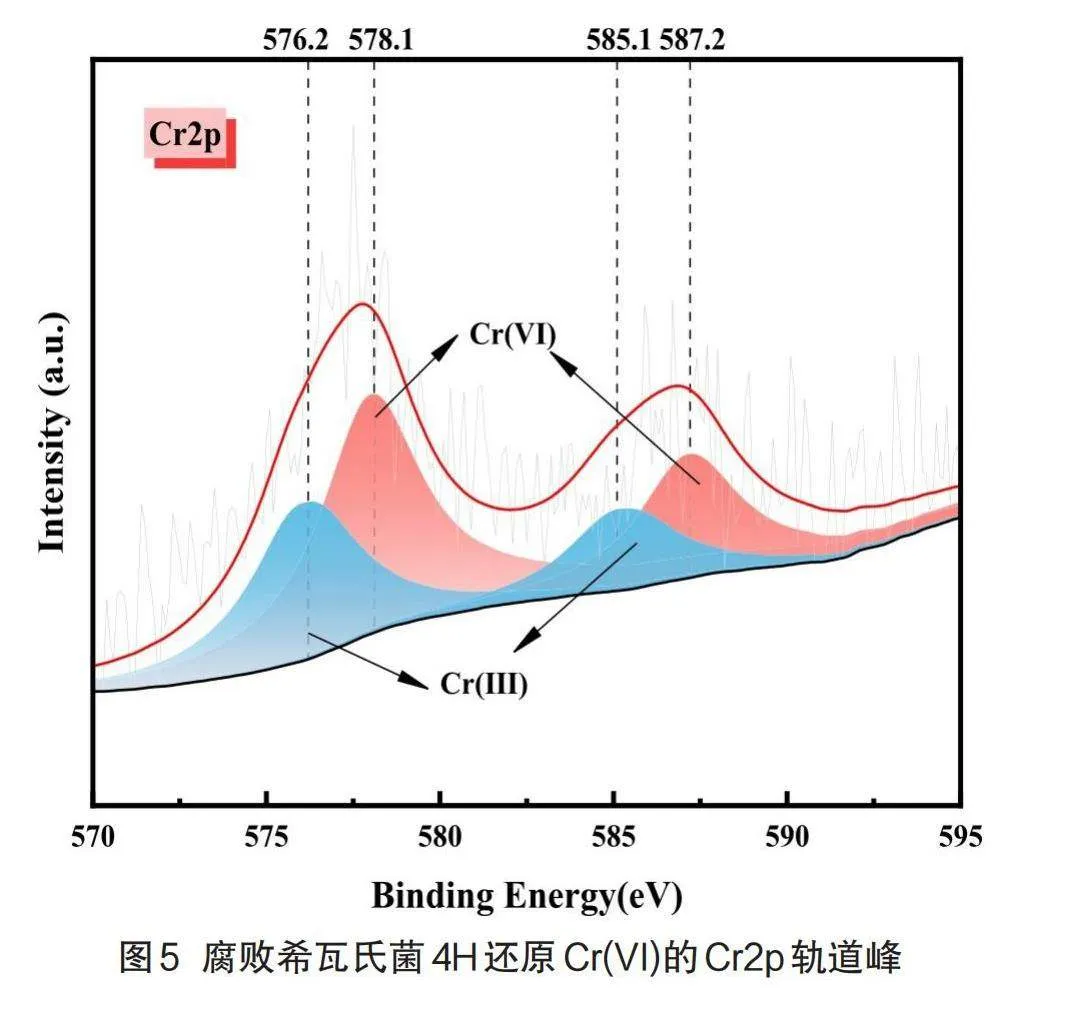
2.4鉻分子形態XPS分析
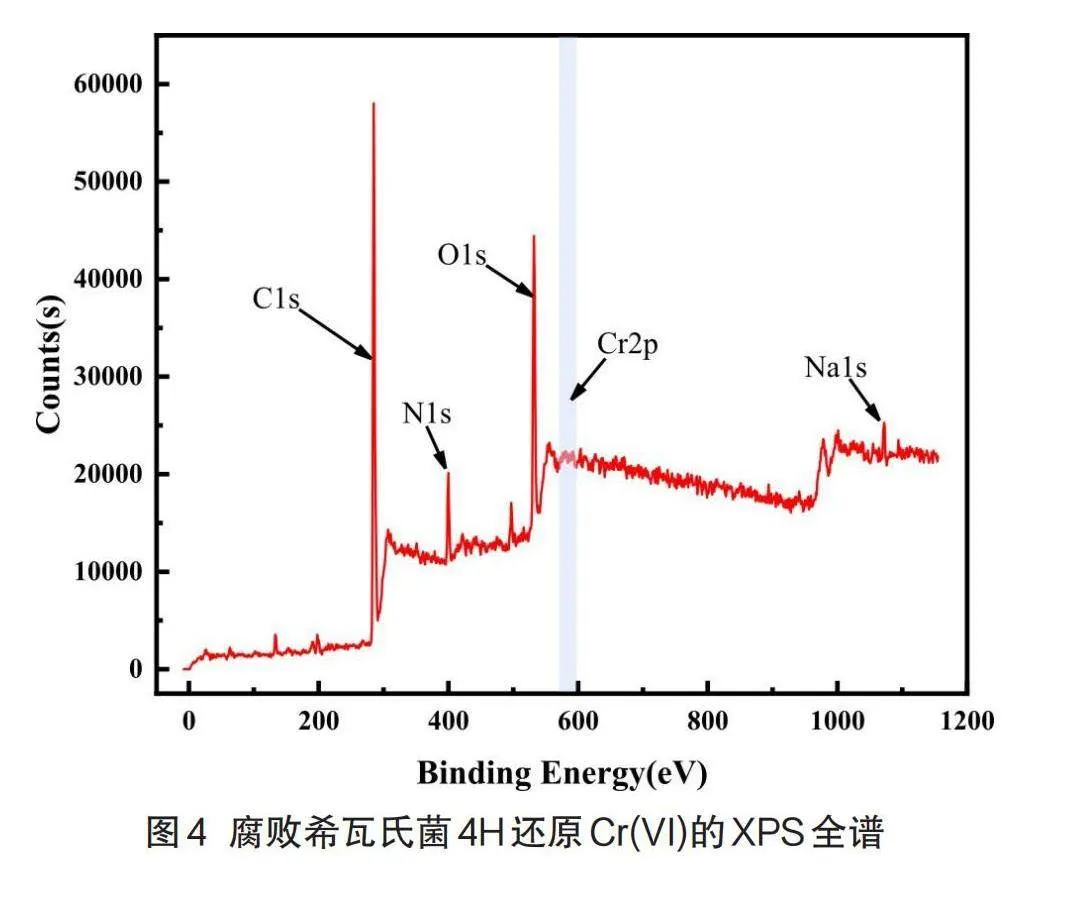
為分析微生物體系Cr(VI)還原的產物,以及菌體表面及內部鉻的形態特征,本研究采用高性能X射線光電子能譜儀對腐敗希瓦氏菌4H還原Cr(VI)的分子形態進行表征,結果見圖4。從圖中可以明顯看出C、N、O、Cr、Na五種元素,其中C、N、O是菌體蛋白質、氨基酸等重要組成元素[17]。
圖5顯示了還原產物的Cr2p光譜圖,結合能576.2 eV(Cr2p3/2)和585.1 eV(Cr2p1/2)的峰值歸因于Cr(III)的(氫)氧化物[18],而結合能578.1 eV(Cr2p3/2)和587.2 eV(Cr2p1/2)的峰值歸因于Cr(VI)的氧化物[19],這說明細菌還原Cr(VI)的過程中可能發生了少量的吸附與氧化還原反應[20],但由于300 mg/L Cr(VI)濃度過高,菌體不能完全將自身表面的Cr(VI)完全還原為Cr(III),所以此時細胞內的Cr(VI)含量高于Cr(III)。
2.5電化學特性分析
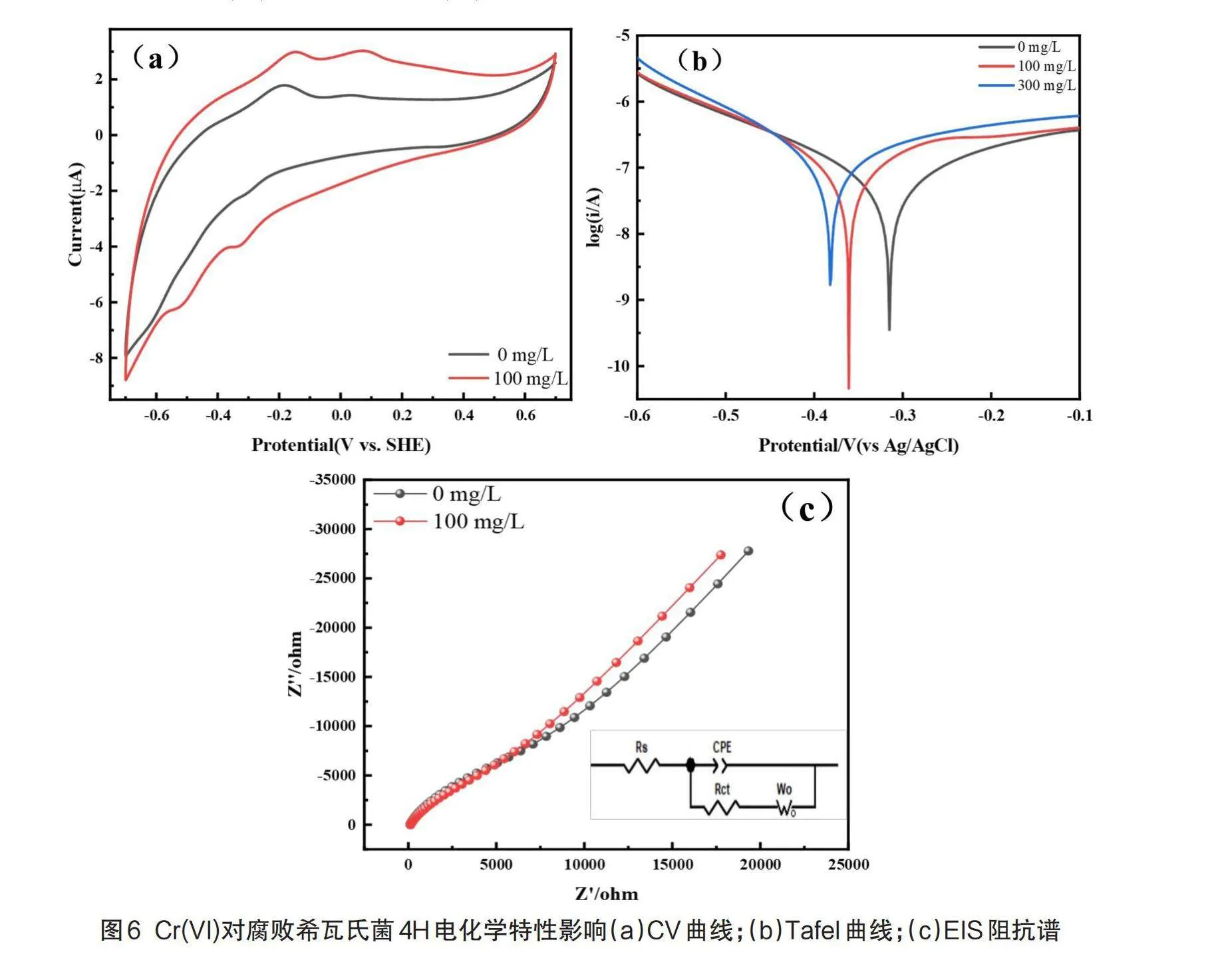
電化學特性是研究細胞電子傳遞特性的重要指標,為了探究腐敗希瓦氏菌4H還原Cr(VI)過程中的電化學特性,對不同初始Cr(VI)濃度條件下生長24 h后的菌體進行CV、EIS和Tafel曲線測試,結果見圖6。
CV常被用來表征物質的電子轉移能力和評估氧化還原電位[21]。由圖6 CV結果可知,相較于正常環境下生長的菌株,100 mg/L初始Cr(VI)條件下生長的菌株在-0.33 V附近的還原峰可能為細菌OmcA/MtrC復合物與黃素類物質協同作用產生的氧化還原峰[22-23],-0.5 V附近的還原峰可能代表核黃素的氧化還原峰[24]。
如圖6所示,根據外推法計算出0、100、300 mg/L初始Cr(VI)濃度細菌的電流交換密度值分別為6.973×10-8 A/cm-2、1.354×10-7 A/cm-2、1.456×10-7 A/cm-2,交換電流密度是評估氧化還原反應速率的重要指標,電流交換密度越大,電子傳遞速率越快,反應越容易進行[25]。
為了更好地揭示電子傳遞效率的變化,使用等效電路對EIS測試結果進行了擬合。其中,Rct值代表電荷傳遞阻抗,其值越低,電荷轉移電阻越小[26]。0 mg/L以及100 mg/L初始Cr(VI)條件下生長的菌株Rct值分別為3700Ω和2240Ω,表明菌體表面Cr(VI)的存在降低了電子傳遞電阻,從而導致更高的電子傳遞效率。
綜上所述,CV、EIS和Tafel曲線分析結果表明,Cr(VI)的脅迫促使了細胞表面的電子傳遞,從而使Cr(VI)的價態發生了轉變,且與細菌的黃素蛋白以及色素細胞c的氧化還原有著必然的聯系。
3結論
本文通過掃描電鏡(SEM)、傅里葉紅外、XPS、電化學表征等方法研究了腐敗希瓦氏菌4H去除Cr(VI)的作用機理,結果表明:通過檢測不同六價鉻濃度下細菌外膜細胞色素c含量、電子傳遞系統活性(ETSA)證明該菌具有很強的電子傳遞性能。通過檢測不同濃度下細菌膜通透性以及SEM分析得出Cr(VI)對該菌細胞膜的損害情況較小,細菌主要通過改變自身形態的方法抵抗Cr(VI)的毒害。通過傅里葉紅外探究發現隨著初始Cr(VI)濃度的增,羥基、羧基、酰胺和磷酸基團所代表的特征峰強度也有明顯的增強,這些基團主要生物大分子的構成、代謝途徑、細胞結構和功能以及細胞信號傳導等方面,進一步驗證了該菌具有很強的電子傳遞性能以及重金屬代謝能力。通過XPS分析細菌還原Cr(VI)的產物,發現腐敗希瓦氏菌4H對Cr(VI)的還原過程中存在Cr(III)的(氫)氧化物,進一步驗證了該菌主要是通過還原的方法去除Cr(VI)。通過檢測CV、EIS、Tafel等化學表征發現菌體表面Cr(VI)的存在促使了細菌自身的電子傳遞,細菌為減少Cr(VI)的毒害,推測該菌可能將Cr(VI)作為電子傳遞受體進行還原作用,其中黃素蛋白與色素細胞c的氧化還原起著重要作用。本研究初步揭示了腐敗希瓦氏菌4H還原Cr(VI)機理,為將微生物應用于Cr(VI)污染的治理提供了理論依據。
參考文獻:
[1]Joutey NT,Sayel H,Bahafid W,et al.Mechanisms of Hexavalent Chromium Resistance and Removal by Micro?organisms[J].Reviews of Environmental Contamination and Toxicology,2015,233:45-69.
[2]Barrera-Díaz C,Lugo-Lugo V,Bilyeu B.A review of chemical,electrochemical and biological methods for aque?ous Cr(VI)reduction[J].Journal of Hazardous Materials,2012,223:1-12.
[3]Bingbing Pang,Hongling Yu,Jin Zhang,et al.Identifica?tion of differentially expressed genes for Pseudomonas sp.Cr13 stimulated by hexavalent chromium[J].PLOS ONE,2022,17(8):e0272528.
[4]Brown SD,Thompson MR,Verberkmoes NC,et al.Mo?lecular Dynamics of the Shewanella oneidensis Response to Chromate Stress[J].Molecular&Cellular Proteomics,2006,5(6):1054-1071.
[5]江瑩,桂震,齊杭杭,等.一株腐敗希瓦氏菌的篩選鑒定及其染料脫色研究[J].安徽農業科學,2015,43(23):224-228.
[6]Bencheikh-Latmani R,Williams SM,Haucke L,et al.Global transcriptional profiling of Shewanella oneidensis MR-1 during Cr(VI)and U(VI)reduction.[J].Applied and Environmental Microbiology,2005,71(11):7453-7460.
[7]Wang J,Wu M,Lu G,et al.Biotransformation and biometh?ylation of arsenic by Shewanella oneidensis MR-1[J].Che?mosphere,2016,145:329-335.
[8]江瑩.一株腐敗希瓦氏菌對活性艷紅X-3B和活性艷藍KN-R的脫色研究[D].武漢紡織大學,2016.
[9]何月.Fe(Ⅲ)調控及硫自養工藝對Te(Ⅳ)生物還原性能與機理研究[D].天津城建大學,2021.
[10]Zheng Y,Li H,Yang Y,et al.Goethite and riboflavin syn?ergistically enhance Cr(VI)reduction by Shewanella oneidensis MR-1[J].Biodegradation,2023,34(2):155-167.
[11]杜艷影.Shewanella oneidensis MR-1對Cr(Ⅵ)的還原及其機理研究[D].安徽農業大學,2019.
[12]Zhu Y,Yan J,Xia L,et al.Mechanisms of Cr(VI)reduction by Bacillus sp.CRB-1,anovel Cr(VI)-reducing bacterium isolated from tannery activated sludge[J].Ecotoxicology and Environmental Safety,2019,186:109792.
[13]冮海銀.蛋白質組學揭示希瓦氏菌MR-1在長期六價鉻馴化中的還原和耐受機制[D].湖南大學,2019.
[14]He Y,Guo J,Song Y,et al.Acceleration mechanism of bio?available Fe(Ⅲ)on Te(IV)bioreduction of Shewanella oneidensis MR-1:Promotion of electron generation,elec?tron transfer and energy level[J].Journal of Hazardous Ma?terials,2021,403:123728.
[15]戴幼芬.微生物胞外聚合物的提取表征及其與Cr(Ⅵ)相互作用研究[D].福建師范大學,2016.
[16]Hui An,Tian T,Ziting Wang,et al.Role of extracellular polymeric substances in the immobilization of hexavalent chromium by Shewanella putrefaciens CN32 unsaturated biofilms.[J].Science of The Total Environment,2021:151184.
[17]徐文強.腐敗希瓦氏菌對水中Cr(Ⅵ)還原能力強化方法的研究[D].中南民族大學,2020.
[18]鄒龍,朱菲,唐潔,等.細菌介導水鐵礦合成鐵硫礦物去除水體鉻污染[J].中國環境科學,2023,43(2):610-619.
[19]Biesinger MC,Payne BP,Grosvenor AP,et al.Resolving surface chemical states in XPS analysis of first row transi?tion metals,oxides and hydroxides:Cr,Mn,Fe,Co and Ni[J].Applied Surface Science,2011,257(7):2717-2730.
[20]杜文濤.克雷伯氏菌Klebsiella Z3對Cr(Ⅵ)的還原性能及機理研究[D].河南農業大學,2017.
[21]Guo H,Chen Z,Chen Z,et al.Enhanced denitrification performance and biocatalysis mechanisms of polyoxometa?lates as environmentally-friendly inorganic redox media?tors[J].Bioresource Technology,2019,291:121816-121816.
[22]韓俊成.希瓦氏菌胞外電子傳遞機制的解析和應用[D].中國科學技術大學,2017.
[23]Marsili E,Baron DB,Shikhare ID,et al.Shewanella se?cretes flavins that mediate extracellular electron transfer[J].Proceedings of the National Academy of Sciences,2008,105(10):3968-3973.
[24]陳緣緣.人工構建胞外電活性基質強化微生物胞外電子傳遞及其重金屬還原性能研究[D].江蘇大學,2022.
[25]Tu J,Guo J,Lu C,et al.Effect and mechanism of cyclodex?trins on nitrate reduction and bio-activity by S.oneidensis.MR-1.[J].Bioresource Technology,2020,317:124002.
[26]Sandil D,Kumar S,Arora K,et al.Biofunctionalized nano?structured tungsten trioxide based sensor for cardiac bio?marker detection[J].Materials Letters,2017,186:202-205.
Corruption Shewanella putrefaciens 4H ChromiumlgjvLekMfMP42xqpmiPjpA== Reduction Mechanism of Exploration
CHEN Xu1,GAO Jun1,BU Fantong1,CAI Yajun1,2
(a.School of Environmental Engineering,b.Engineering Research Center for Clean Production of Textile Dyeing and Printing)
Abstract:In order to investigate the mechanism of Cr(VI)reduction by S.putrefaciens 4H,scanning electron microscopy(SEM),Fourier-transform infrared spectroscopy(FTIR),X-ray photoelectron spectroscopy(XPS)and electrochemical testing were used to characterize it.The results indicate that the mechanism of Cr(VI)reduction by S.putrefaciens 4H was mainly related to the metabolism and electron trans-port capacity of microorganisms.XPS analysis revealed that there were two forms of Cr(VI)and Cr(III)on the surface of bacteria during the reduction of Cr(VI),which further proved that the bacteria removed hexavalent chromium by reduction method.SEM results showed that there was no obvious damage on the surface of the bacteria under chromium hexavalent stress,and the morphology of the bacteria changed from short rod type to long rod type,indicating that the bacteria had strong tolerance to Cr(VI).FTIR results show that with the increase of initial Cr(VI)concentration,the characteristic peaks represented by hydroxyl,carboxyl,amide and phosphate groups also increase signifi-cantly.The results of electron transfer performance test and electrochemical test show that the bacterium has strong electron transfer ability.This study provides atheoretical basis for the microbial treatment of Cr(VI)in reduction environments by investigating the mechanism of Cr(VI)reduction by S.putrefaciens 4H.
Keywords:shewanella putrefaciens;chromium reduction mechanism;electron transport;biological metabolism
(責任編輯:李強)

