肉串制品中豬牛羊源性成分多重熒光PCR檢測方法研究

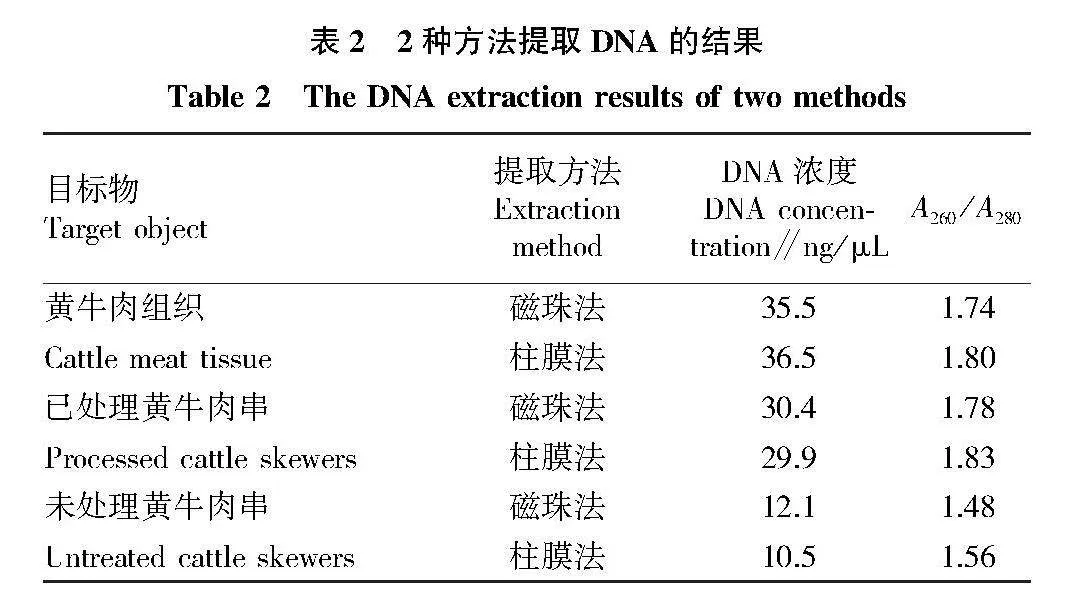
摘要 [目的]建立畜類肉串產品中常見的黃牛、綿羊和豬源性成分的多重熒光PCR檢測方法,實現肉串制品中動物源性成分的快速鑒別。[方法]比較磁珠法和柱膜法對肉糜組織中DNA的提取效果,優化實時熒光PCR多重檢測方法,比較58、60 ℃ 2個退火溫度下黃牛、綿羊、豬源性成分擴增效果。[結果]試驗采用的2種DNA提取方法效果相似,DNA溶液的A260/A280值均能滿足PCR檢測要求;58 ℃為最優退火溫度,此時黃牛、綿羊、豬源性成分均能有效擴增,且最低檢出的DNA濃度均為10-3 ng/μL。方法中用到的引物和探針特異性較好,均未產生非特異性擴增。[結論]試驗建立的黃牛、綿羊和豬源性成分的多重PCR檢測方法能為肉制品中動物源性成分的快速定性分析提供方法參考。
關鍵詞 黃牛;綿羊;豬;源性成分;實時熒光多重PCR
中圖分類號 TS251.7 文獻標識碼 A
文章編號 0517-6611(2024)18-0184-04
doi:10.3969/j.issn.0517-6611.2024.18.039
開放科學(資源服務)標識碼(OSID):
Study on Detection Method for Pig,Cow and Sheep Derived Components by Multiple Fluorescence PCR in Meat Skewer Products
YAO Yan-ling,ZHOU Yu-dong,WANG Wen-yu et al
(Jiaxing Testing Institute for Food,Drug and Product Quality Control,Jiaxing,Zhejiang 314050)
Abstract [Objective]To establish a multiple fluorescence PCR detection method for common cattle,sheep and pig derived components in animal meat skewer products,and to achieve rapid identification of animal derived components in meat skewer products.[Method]Compared the extraction effect of DNA from meat mince tissue using magnetic bead method and column membrane method,optimized the real-time fluorescence PCR multiple detection method,and compared the amplification effect of cattle,sheep,and pig derived components at two annealing temperatures of 58 and 60 ℃.[Result]The two DNA extraction methods used in the experiment had similar effects,and the A260/A280 values of the DNA solution could meet the requirements of PCR detection.58 ℃ was the optimal annealing temperature,at which point the cattle,sheep and pig derived DNA could be effectively amplified,and the lowest detected DNA concentration was 10-3 ng/μL.The primers and probes used in the method had good specificity and had not produced non-specific amplification.[Conclusion]The multiplex PCR detection method established by the application scope experiment for cattle,sheep and pig origin can provide a method reference for rapid qualitative analysis of animal origin components in meat products.
Key words Cattle;Sheep;Pig;Derived component;Real-time fluorescence multiplex PCR
基金項目 浙江省市場監督管理局雛鷹計劃培育項目(CY2023322)。
作者簡介 姚艷玲(1980—),女,浙江嘉興人,高級工程師,碩士,從事食品微生物及分子生物檢測研究。
收稿日期 2023-10-28
燒烤食品近年來備受年輕人喜愛,尤其以豬、牛、羊等畜肉類肉串最為常見,因其含有多種維生素、氨基酸,且燒烤口味鮮美,深受年輕人青睞,也豐富了人們的餐桌文化。隨著市場上豬肉、牛肉和羊肉價格差距的拉大,某些商販在肉制品加工過程中摻假售假,通過牛羊油浸泡,或者牛羊類香精香料及調味料添加等方式處理后,冒充牛、羊肉進行銷售,損害了消費者利益,也給食品安全帶來了風險。……

