生姜多糖的提取及抗氧化作用研究
孟憲偉 羅亮 孫源 趙志剛 王世會 張瑞 郭坤
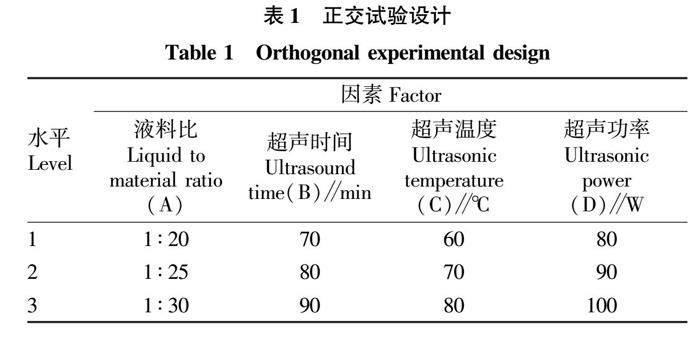
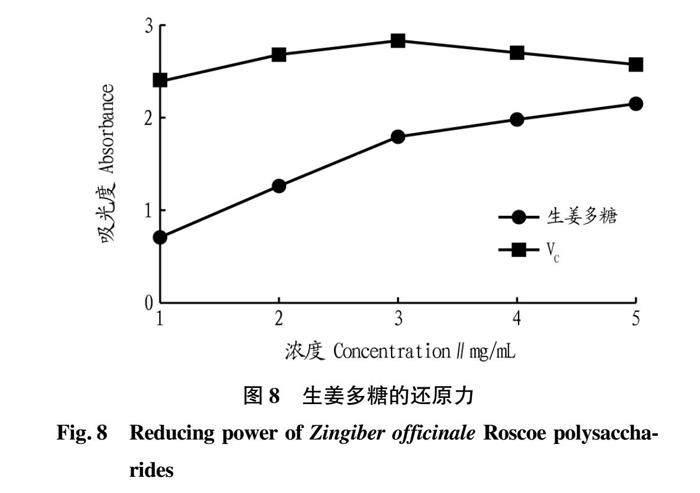
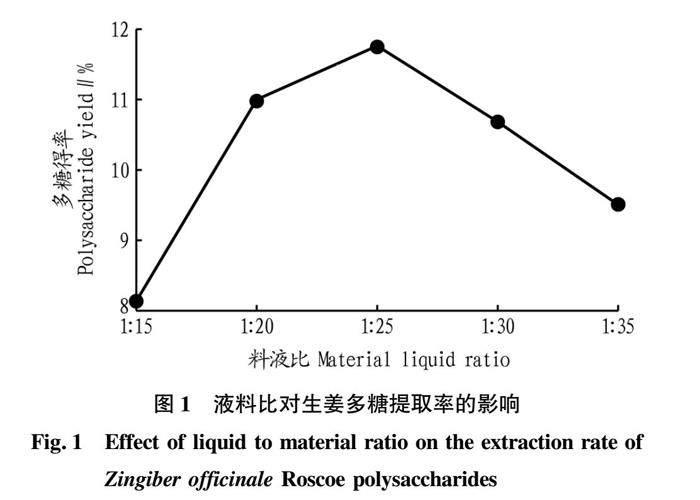
摘要 采用超聲輔助提取法從生姜中提取多糖,采用單因素和正交試驗(yàn)對生姜多糖提取工藝進(jìn)行優(yōu)化,結(jié)果發(fā)現(xiàn):生姜多糖最佳提取工藝為液料比1∶20,勻漿時間5 min,勻漿溫度70 ℃,超聲時間80 min為宜,超聲溫度80 ℃,超聲波功率為100 W,在該條件下多糖得率為12.56%。抗氧化活性測定結(jié)果表明,生姜多糖在5 mg/mL時對羥基自由基的清除能力可達(dá)到90.96%,且還原力最強(qiáng)。
關(guān)鍵詞 生姜多糖;提取;結(jié)構(gòu)表征;抗氧化作用
中圖分類號 R284? 文獻(xiàn)標(biāo)識碼 A? 文章編號 0517-6611(2024)11-0149-05
doi:10.3969/j.issn.0517-6611.2024.11.032
Study on Extraction and Antioxidant Effect of Polysaccharide from Zingiber officinale Roscoe
MENG Xian-wei1,2, LUO Liang2, SUN Yuan1 et al
(1. Research Center of Pharmaceutical Engineering, Harbin University of Commerce, Harbin, Heilongjiang 150076;2.Heilongjiang River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin, Heilongjiang 150070)
Abstract Ultrasonic assisted extraction method was used to extract polysaccharide from Zingiber officinale Roscoe. First, single factor and orthogonal test were used to optimize the extraction process of Zingiber officinale Roscoe polysaccharide. The experimental results showed that the optimal extraction process of Zingiber officinale Roscoe polysaccharide was as follows: liquid to material ratio 1∶20, homogenization time 5 min, homogenization temperature 70 ℃, ultrasonic time 80 min and ultrasonic temperature 80 ℃. Under the condition of ultrasonic power of 100 W, the yield of polysaccharide was 12.56%. Then, the antioxidant activity of the extracted Zingiber officinale Roscoe polysaccharide was determined. The experimental results showed that the hydroxyl radical scavenging ability of Zingiber officinale Roscoe polysaccharide reached 90.96% at 5 mg/mL, and the reducing power was the strongest.
Key words Zingiber officinale Roscoe polysaccharide;Extraction;Structural characterization;Antioxidation
基金項(xiàng)目 哈爾濱商業(yè)大學(xué)青年學(xué)術(shù)骨干支持計劃項(xiàng)目(2020CX10);黑龍江省省屬高等學(xué)校基本科研業(yè)務(wù)費(fèi)科研項(xiàng)目(2023-KYYWF-1036);黑龍江省博士后科研啟動金項(xiàng)目(BS0062)。
作者簡介 孟憲偉(1993—),女,黑龍江鶴崗人,碩士研究生,研究方向:中藥提取分離及活性。*通信作者,助理研究員,博士,從事環(huán)境微生物學(xué)研究。
收稿日期 2023-06-20;修回日期 2023-08-02
生姜(Zingiber officinale Roscoe)為多年生草本植物的新鮮根莖,作為傳統(tǒng)藥用和食用植物被人們廣泛熟知,也是屬于有價值的烹飪香料之一,具有廣泛的應(yīng)用前景。生姜包含多種化學(xué)成分,如黃酮、二苯基庚烷類化合物、姜黃素、姜辣素、姜精油、多糖等[1-2]。研究表明,生姜具有廣泛的生物活性,如抗氧化[3]、抗炎[4]、抗菌[5]、抗腫瘤[6]、免疫調(diào)節(jié)[7]、降血脂血糖[8]、調(diào)節(jié)腸道菌群[9]等藥理活性。多糖作為生姜活性化學(xué)成分之一,具有較高的研究價值。生姜多糖可通過調(diào)節(jié)腸道菌群,降低糖尿病小鼠的血糖[10],對腦缺血再灌注損傷具有保護(hù)作用[11],抑制癌細(xì)胞生長通過誘導(dǎo)其凋亡起到抗腫瘤作用[12-13]。……

