多不飽和脂肪酸對Δ15 Des轉基因小鼠睪丸結構和功能的影響及機制*
趙瑄, 鄭紅梅, 王雨虹, 巨佳曦, 朱貴明*
(貴州醫科大學 生物與工程學院&健康醫藥現代產業學院, 貴州 貴陽 550025)
游離脂肪酸(free fatty acids,FFAs)是機體內重要的能量來源,根據碳鏈的長度可以分為短鏈脂肪酸(short-chain fatty acids,SCFAs)、中鏈脂肪酸(medium-chain fatty acids,MCFAs)及長鏈脂肪酸(long-chain fatty acids,LCFAs)[1-2]。FFAs在各種生理條件下表現出信號傳導、基因表達及調節機體能量穩態等關鍵功能[3]。FFAs受體(FFAs receptors,FFARs)也稱為G蛋白偶聯受體(G protein-coupled receptor,GPCRs),FFARs根據激活的FFAs的碳鏈長度進行分類,游離脂肪酸受體2(free fatty acid receptor 2,FFAR2)與FFAR3可被SCFAs激活,MCFAs和LCFAs作為配體可激活膜受體FFAR1與FFAR4[4-6]。FFAR4可被天然配體以及非內源性激動劑激活,天然配體主要為多不飽和脂肪酸(polyunsaturated fatty acids,PUFAs),它是一類含有2個或2個以上的雙鍵且含碳原子個數>18的直鏈脂肪酸,通常分為歐米伽-6PUFAs(omega-6,ω-6或n-6)系和n-3系,其中n-3 PUFAs對高血壓、動脈粥樣硬化及心肌梗死等心血管疾病產生積極的影響[7-9]。研究發現,n-3 PUFAs激活FFAR4后在脂肪因子與細胞因子產生過程中發揮重要作用,過氧化物酶體增殖物激活受體γ(peroxisome proliferator-activated receptor γ,PPARγ)和核因子-κB(nuclear factor kappa-B,NF-κB)也參與了該途徑[10-12];在糖尿病小鼠(db/db)模型中,FFAR4激動劑可使脂肪組織胰島素增敏,達到抗糖尿病的效果[13];靜脈注射魚油脂乳劑(fish oil fat emulsion,FOLE)可預防小鼠腸外營養(parenteral nutrition,PN)誘導的肝損傷,逆轉PN誘導的小兒膽汁淤積;Fell等[14]研究顯示,FOLE能夠保護小鼠肝臟,部分是通過激活FFAR4、PPARγ及血小板反應蛋白受體(thrombospondin receptor,CD36)。因此,本研究利用能夠將n-6 PUFAs轉化為n-3 PUFAs的Δ15脂肪酸去飽和酶(Δ15 fatty acid desaturase,Δ15 Des)轉基因小鼠,探究PUFAs對小鼠睪丸結構和功能的影響及其機制,為后續研究PUFAs與雄性小鼠生殖功能的聯系提供實驗及理論基礎。
1 材料與方法
1.1 實驗材料
1.1.1動物來源 4周齡SPF級C57BL/6野生型(wild type,WT)雄性小鼠5只,實驗室前期使用PiggyBac轉座子系統構建表達Δ15 Des活性的轉基因4周齡雄性小鼠(即Δ15 Des轉基因小鼠)5只,體質量為18~22 g,飼養于學校實驗動物中心[SYXK(黔)2018-0001];飼養環境為日平均溫度22~26 ℃、濕度60%~80%、光照周期為12 h光照及12 h黑暗。
1.1.2主要儀器及試劑 HP5890氣相色譜儀(昆山塞特科學儀器有限公司),石蠟包埋機(武漢俊杰電子有限公司),病理切片機(上海徠卡儀器有限公司);定制小鼠飼料[6%花生四烯酸(arachidonic acid,ARA)]、動物組織總RNA提取試劑盒[天根生化科技(北京)有限公司]。
1.2 研究方法
1.2.1實驗分組及取樣 取C57BL/6 WT小鼠和Δ15 Des轉基因小鼠分別作為對照組(WT組)和實驗組(TG組),含6% ARA飼料飼喂8周,麻醉處死,于冰上迅速分離小鼠完整的睪丸組織及附睪組織,用于后續實驗。
1.2.2氣相色譜(gas chromatography,GC)檢測睪丸組織總脂肪酸的組成及含量 取“1.2.1”項下2組小鼠睪丸組織,采用三氟化硼/甲醇(boron trifluoride/methyl alcohol,CH3OH/BF3)法提取睪丸組織的總脂肪酸,GC檢測睪丸組織總脂肪酸的組成,標準品對照法對比待測樣品中的PUFAs組成,N2000色譜數據離線工作站計算脂肪酸的含量。
1.2.3小鼠精子運動活力檢測及精子超微結構分析 精子獲能液200 μL于胚胎培養皿中,37 ℃恒溫臺上預熱5 min;取“1.2.1”項下2組小鼠附睪組織的附睪尾快速放入精子獲能液中,刺破附睪尾,使精子充分游出;迅速把胚胎培養皿放于37 ℃培養箱內孵育10 min;取精子獲能液的上層懸液20 μL于載玻片上,置蓋玻片,載玻片置于顯微鏡載物臺處;計算機輔助精子分析(computer-aided sperm analysis,CASA)系統檢測小鼠的精子活力指標,包括精子總活力、直線運動精子活力、精子平均路徑速度(average path velocity,VAP)、精子曲線速度(curvilinear velocity,VCL)及精子直線速度(straight-line velocity,VSL),并截取精子3個不同視野的超微結構。
1.2.4蘇木精-伊紅(hematoxylin-eosin,HE)染色觀察睪丸組織的形態學特征 取“1.2.1”項下2組小鼠睪丸組織,置于4%多聚甲醛固定24 h,乙醇梯度脫水,二甲苯透明處理,石蠟包埋、切片、脫水、染色,顯微鏡下觀察腓腸肌組織結構變化。
1.2.5實時熒光定量PCR(real time fluorescence quantitative PCR,RT-qPCR)檢測睪丸組織中膜受體FFARs(FFAR1、FFAR2、FFAR3及FFAR4)、核受體PPARs(PPARα、PPARβ及PPARγ) 信使RNA(messenger RNA,mRNA)的表達 取“1.2.1”項下2組小鼠睪丸組織20 mg,利用Trizol法提取小鼠總RNA,定量為1 μg,將總RNA反轉錄成互補DNA(complementary DNA,cDNA)。RT-qPCR檢測在睪丸組織中膜受體FFARs(FFAR1、FFAR2、FFAR3、FFAR4)及核受體PPARs(PPARα、PPARβ、PPARγ)mRNA表達;反應體系為cDNA樣品1 μL、上下游引物各0.4 μL、TB Green 5 μL及超純(diethyl pyrocarbonate,DEPC)水3.2 μL;反應條件為預變性95 ℃ 30 s,變性95 ℃ 5 s、退火60 ℃ 30 s、延伸72 ℃ 30 s、40個循環;儀器上測出各個樣品的循環閾值(cycle threshold,Ct)后,根據2-ΔΔCt計算目的基因的相對表達量。
1.2.6蛋白質印跡法(Western blot)檢測睪丸組織中FFAR4與PPARγ的表達 取“1.2.1”項下2組小鼠睪丸組織提取總蛋白,利用二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量試劑盒以及酶標儀測定蛋白濃度。將蛋白置于100 ℃水浴5 min變性,-20 ℃冰箱保存備用;制備12%分離膠于5%濃縮膠進行電泳,于聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上蛋白轉移,5%脫脂牛奶室溫封閉2 h,洗膜后一抗孵育(β-tubulin、FFAR4、PPARγ)4 ℃過夜,β-tubulin、FFAR4以及PPARγ抗體的稀釋倍數均為1∶1 000,加1∶5 000比例配置的辣根過氧化物酶(horse radish peroxidase,HRP)二抗,室溫孵育40~60 min,進行凝膠成像分析。
1.3 統計學分析
2 結果
2.1 睪丸組織中脂肪酸的GC檢測
GC檢測結果顯示(圖1),與WT組相比,TG組小鼠睪丸組織中ARA(20∶4n-6)與二十二碳四烯酸(docosatetraenoic acid,DTA;22∶4n-6)含量降低(P<0.05或P<0.01),亞油酸(linoleic acid,LA;18∶2n-6)、二十碳五烯酸(eicosapentaenoic acid,EPA;20∶5n-3)、二十二碳六烯酸(docosahexaenoic acid,DHA;22∶6n-3)含量升高(P<0.05或P<0.01)。

注:A為WT組,B為TG組,C為脂肪酸的定量結果;與WT組比較,(1)P<0.01,(2)P<0.05。
2.2 精子形態
探究轉化的n-3 PUFAs與轉入小鼠體內的Δ15 Des基因是否對小鼠的精子形態及運動活力產生影響,通過顯微鏡觀察,選取同鼠附睪組織在3個不同視野下的精子形態,結果顯示2組小鼠的精子形態及數量無明顯差異(圖2)。

圖2 WT組和TG組小鼠精子的形態觀察(40×)Fig.2 Morphological observation of sperm in WT and TG groups(40×)
2.3 精子運動活力
CASA系統分析小鼠精子的運動活力,結果顯示(圖3),與WT組相比,TG組小鼠精子的直線運動精子活力、VSL升高,差異有統計學意義(P<0.05);精子總活力、VAP、VCL比較,差異無統計學意義(P>0.05)。

注:A為精子總活力、直線運動精子活力的定量結果,B為VAP、VCL及VSL的定量結果;(1)與WT組相比,P<0.05。
2.4 睪丸結構
睪丸組織的HE染色結果顯示(圖4),與WT組相比,TG組小鼠睪丸管腔內精子發生密集,靠近管腔的圓形精子及管腔內的長形精子數量增加;WT組小鼠可見生精小管排列松弛,管腔較大,間質松散,精原細胞和精母細胞較TG組有所減少,管腔內的長形精子數量有所減少。
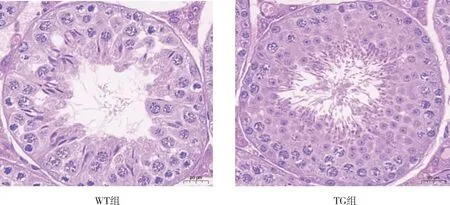
圖4 WT組和TG組小鼠睪丸組織的HE染色(40×)Fig.4 HE staining of testicular tissue in WT and TG groups(40×)
2.5 睪丸組織FFAR2、FFAR3、FFAR4及PPARα、PPARβ、PPARγ mRNA的表達
RT-qPCR結果顯示(圖5),與WT組相比,TG組小鼠睪丸組織中FFAR4、PPARα mRNA表達上調(P<0.01或P<0.05),PPARβ mRNA表達下調(P<0.05),FFAR1、FFAR2、FFAR3及PPARγ mRNA表達無差異(P>0.05)。

注:A為FFAR2、FFAR3、FFAR4 mRNA定量結果,B為 PPARα、PPARβ及PPARγ mRNA定量結果;與WT組相比,(1)P<0.001,(2)P<0.05。
2.6 睪丸組織中FFAR4與PPARγ蛋白的表達
采用Western blot分析小鼠睪丸組織中FFAR4、PPARγ蛋白的水平,結果表明(圖6),與WT組相比,TG組小鼠睪丸組織中FFAR4蛋白水平增加(P<0.05),PPARγ蛋白水平無變化(P>0.05)。

注:A為Western blot檢測結果,B為定量結果;(1)與WT組相比,P<0.01。
3 討論
作為n-3FFAs的受體,在人體與許多哺乳動物中FFAR4發揮著重要的生理作用,研究表明,2型糖尿病、肥胖、急性肝損傷及其他免疫疾病時,FFAR4是一個重要的治療靶點[15-18]。然而,FFAR4影響小鼠睪丸組織結構和功能的相關報道尚比較缺乏。本研究利用精子質量分析儀與CASA系統分析小鼠精子的運動活力,從精子的形態以及運動指標可看出,轉化的n-3PUFAs能使轉基因小鼠在不影響小鼠精子總動能的前提下,提高小鼠的直線運動精子活力及VSL,說明轉化的n-3PUFAs以及轉入的Δ15 Des基因的并不會影響精子的形態及總運動水平;通過HE染色分析發現,與WT組小鼠相比,TG組小鼠睪丸組織內的曲細精管排布規整,曲細精管內空泡較少,在曲細精管管腔處形成的成熟精子較多。根據上述現象可以認為,PUFAs影響小鼠睪丸組織內精子發生的途徑可能為FFAR4通路。有研究表明,n-3PUFAs或FFAR4激動劑激活FFAR4后,會刺激纖毛產生環磷酸腺苷(cyclic adenosine monophosphate,cAMP)直接激活交換蛋白(exchange proteins directly activated,EPAC),從而促進脂肪生成[19-21];Miyamoto等[22]研究顯示,MCFAs和LCFAs可同時激活FFAR1與FFAR4,SCFAs可以激活FFAR2與FFAR3;此外,FFAR1結合n-3 PUFAs配體的親和力和FFAR4相差不大[23-25]。本研究采取n-6系的ARA飼喂小鼠,TG組小鼠將其轉化為n-3系的EPA以及碳鏈更長的DHA后,可能通過激活FFAR4,影響下游基因的表達;與WT組小鼠相比,TG組小鼠睪丸組織中FFAR4 mRNA和蛋白的表達上升,PPARγmRNA和蛋白的表達無差異,表明在睪丸組織中n-3PUFAs不能以配體的形式結合PPARγ。
綜上所述,n-3PUFAs可能以配體-受體的方式結合FFAR4,激活下游信號分子,從而改善小鼠睪丸組織結構和功能,但FFAR4是否將胞外信號傳遞給cAMP,進而對睪丸組織產生影響,仍需進一步的研究。

