宮腔鏡冷刀技術在有生育要求子宮黏膜下肌瘤病人中的應用價值
張文莉,周秀芬
(1.蚌埠醫科大學 研究生院,安徽 蚌埠 233030;2.安徽醫科大學附屬六安醫院 婦科,安徽 六安 237005)
子宮肌瘤是由于子宮平滑肌細胞異常增生導致的發生率較高的一種良性腫瘤,也稱為子宮纖維瘤、纖維肌瘤等[1]。其在30~50歲女性中發病率較高,在育齡期發病率約為25%,圍絕經期更是達到了70%[2]。基于子宮肌瘤與肌壁間關系,將其分為黏膜下肌瘤、肌壁間肌瘤以及漿膜下肌瘤三種,其中黏膜下肌瘤發病率約為5%[3]。黏膜下肌瘤生長過程中會向宮腔內凸起,使子宮內膜面積增大,占據一定宮腔空間,可阻礙經血排出,并導致子宮收縮異常,此時會發生經量變多、經期延長等問題,嚴重還可能引發繼發性不孕或者失血性貧血,對女性病人身心健康產生極大威脅[4]。臨床治療子宮黏膜下肌瘤的標準術式是宮腔鏡電切術,但能量器械引起的熱損傷會一定程度破壞子宮內膜[5]。隨著醫療技術的發展,宮腔鏡冷刀技術通過機械切除宮腔病灶,因具有精準切割、保護子宮內膜功能層的優勢,逐漸受到臨床工作者的青睞[6]。本研究對90例育齡期子宮黏膜下肌瘤病人的臨床療效進行對比,旨在探究宮腔鏡冷刀技術在有生育要求黏膜下肌瘤病人中的應用價值。
1 資料與方法
1.1 一般資料
本次研究對象為2019年1月至2021年1月安徽醫科大學附屬六安醫院婦科收治的90例黏膜下肌瘤病人。納入標準:年齡20~40歲且有生育需求;術前彩超提示為子宮黏膜下肌瘤(根據肌瘤和肌壁的關系,將黏膜下肌瘤進行分型,FIGO 分類為:0型,有蒂黏膜下肌瘤;Ⅰ型,無蒂黏膜下肌瘤,向子宮肌層的擴展程度未超過50%;Ⅱ型,無蒂黏膜下肌瘤,向肌層擴展程度超過50%[2]);術后病理確定為子宮平滑肌瘤。排除標準:患有其他惡性腫瘤;急性生殖系統感染;影響受孕的其他婦科內分泌疾病;術前即有宮腔粘連;合并手術禁忌證(嚴重貧血、高血壓、心臟病、糖尿病、凝血功能障礙);拒絕配合研究或隨訪丟失。其中接受宮腔鏡冷刀技術治療的病人45例為觀察組,接受宮腔鏡電切術治療的病人45例為對照組。2組病人的年齡、孕次、產次、肌瘤大小、肌瘤數量及肌瘤分型等一般資料比較差異均無統計學意義(P>0.05),具有可比性(見表1)。此次研究得到醫院倫理委員會的許可,且參與研究的病人均知情,并簽署相應知情同意書。
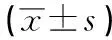
表1 2組病人一般資料的比較
1.2 方法
1.2.1 術前準備 選用法國HEOS宮腔鏡冷刀系統,手術時間為月經干凈3~7 d內,入院后完善相關檢查,排除手術禁忌,術前一天晚上以及術前2~4 h均給予病人400 μg米索前列醇對其宮頸進行軟化,便于手術操作。
1.2.2 手術方法 病人行靜脈麻醉或腰硬聯合麻醉。取膀胱截石位,對外陰及陰道進行常規聚維酮碘消毒,窺陰器擴開陰道暴露宮頸,再次消毒陰道宮頸,宮頸鉗鉗夾宮頸,擴宮棒依次將宮頸口逐漸擴張到9.5 mm。排空灌流管內氣體,直視下將宮腔鏡置入宮頸管及管腔中,以打開雙側宮角,暴露雙輸卵管開口為手術最佳標準,結合B超結果明確肌瘤位置和大小后行手術治療。切除后觀察宮腔及內膜形態,明確無出血后結束手術。所有手術操作均在超聲監控下進行,術中出血多時給予縮宮素靜滴促進子宮收縮。
觀察組采用宮腔鏡冷刀治療,用0.9%氯化鈉溶液作為膨宮介質,以100~120 mmHg 壓力充分膨宮,流速150~300 mL/min。具體步驟:針對0型黏膜下肌瘤,用HEOS剪刀將其蒂部直接剪斷,肌瘤較大者先將肌瘤剪成多個小塊,然后用卵圓鉗或者HEOS 3 mm抓鉗將肌瘤分別取出。對非0型的肌瘤,用HEOS剪刀將肌瘤包膜充分打開,適當分離肌瘤和假包膜,將肌瘤剪成多個小塊,分次取出[5]。
對照組運用宮腔鏡電切術,用5%葡萄糖溶液作為膨宮介質,采用120 W切割功率、90 W電凝功率。具體步驟:0型肌瘤,使用電切環從肌瘤蒂根部完整切除,肌瘤較大者,可切割成多塊,分次取出;非0型肌瘤,從肌瘤表面開始,順行多次切割肌瘤,直至基底部完全切除。對有出血的部位進行電凝止血。
1.2.3 術后處理 手術完成后,可給予病人縮宮素20單位或垂體后葉素6單位稀釋后靜脈滴注等促進子宮收縮,出血多必要時以球囊壓迫止血。術后均向2組病人宮腔內注射3 mL透明質酸鈉凝膠,預防發生宮腔粘連;術后連續服用3 d抗生素,預防感染。
1.3 觀察指標
(1)圍手術期指標:病人術中出血量、手術時間、并發癥(包括水中毒、子宮穿孔、宮腔粘連、早期妊娠終止術綜合征等)以及術后病率等;術前以及術后第1天白細胞介素(IL)-6、C反應蛋白(CRP)水平。(2)隨訪指標:病人術后需根據實際情況對其隨訪,根據復查情況了解病人術后3個月后發生宮腔粘連情況以及子宮內膜厚度,術后12個月對病人進行隨訪,了解其妊娠情況。
1.4 統計學方法
采用t(或t′)檢驗、χ2檢驗和Fisher′s確切概率法。
2 結果
2.1 圍手術期指標
與對照組比較,觀察組手術時間更短,差異有統計學意義(P<0.01);2組術中出血量比較差異無統計學意義(P>0.05)。2組術前IL-6、CRP差異均無統計學意義(P>0.05);與對照組比較,觀察組術后IL-6、CRP水平較低,差異均有統計學意義(P<0.01和P<0.05)(見表2)。觀察組病人僅發生宮腔粘連1例,對照組發生宮腔粘連6例、水中毒2例、術后病率2例,觀察組總并發癥發生率2.22%低于對照組的22.22%,差異有統計學意義(χ2=8.64,P<0.01)。
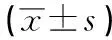
表2 2組圍手術期指標比較
2.2 隨訪指標
術后3個月復查B超,相較于對照組,觀察組子宮內膜厚度更厚,術后一年妊娠率更高,差異均有統計學意義(P<0.05)(見表3)。

表3 2組隨訪指標比較
3 討論
子宮肌瘤是子宮平滑肌組織增生形成的良性腫瘤,具體形成機制尚不明確,可能與年齡、種族、遺傳和激素等有關[2],也有學者認為與免疫反應和小分子代謝有關,其中γ-突觸核蛋白基因、半胱天冬酶1基因、造血前列腺素D合酶基因和羰基還原酶3基因等被證實在此類疾病的發病機制中起著重要的作用[7-8]。實際臨床治療時,需根據病人生育需求、年齡、肌瘤大小及癥狀部位等多種因素進行綜合性考量后選擇適宜的治療方案。
一般來說,傳統的宮腔鏡電切術因其可以快速電凝止血,治療效果已被臨床廣泛認可,但電切術存在熱輻射效應,其切割電流不發生電能衰減,對周圍正常組織也產生一定的影響,易致子宮深部組織變性、壞死,對子宮內膜造成不同程度的損傷,在愈合的過程中,可有炎癥反應和瘢痕形成,嚴重時可引起反復流產、不孕[9]。
隨著醫療器械不斷更迭換代,宮腔鏡冷刀系統孕育而生。HEOS宮腔鏡操作系統是一種新型管型非能量硬性手術器械,其套裝管鞘操作孔道可通過3 mm 的微型手術剪,避免了對子宮內膜的電熱損傷,保持子宮肌層的解剖學和功能完整性,對子宮內膜術后恢復有促進作用,同時能夠有效降低纖維組織增生,提高子宮內膜容受性[10-11],有效保護了病人的生育能力。
王莉等[12]研究表明,宮腔鏡冷刀技術可影響促炎因子和miR-29b在子宮內膜的表達水平,抑制機體炎癥反應,能較好地保護病人局部微循環。魏江霞等[13]研究結果顯示宮腔鏡冷刀切除子宮黏膜下肌瘤病人的術后局部微環境和炎癥反應指標檢測結果明顯低于宮腔鏡電切術。在本研究中,觀察組術后炎癥因子IL-6和CRP水平均低于對照組(P<0.01和P<0.05),提示炎癥水平顯著低于對照組,與上述研究結果一致,進一步證實宮腔鏡冷刀技術產生的創傷應激較小,可降低機體的炎癥反應,為病人提供更好的宮腔局部微環境,有效保護生育能力。
子宮黏膜下肌瘤的術后內膜修復情況和女性生殖密切相關,是病人受孕的必要條件。本研究中,觀察組術后宮腔粘連發生率(2.2%)明顯低于對照組(13.3%),子宮內膜厚度(8.02±1.95)mm明顯高于對照組(6.91±2.11)mm,術后一年妊娠率(64.4%)明顯高于對照組(24.4%),與朱元等[14]研究結果一致,其研究顯示電熱損傷子宮內膜表現為子宮內膜腺體數量顯著減少和內膜纖維化面積顯著增大及生育力的降低。楊凡等[15]也提到宮腔鏡冷刀切除子宮黏膜下肌瘤的術后宮腔粘連發生率更低,術后妊娠率更高,進一步證實宮腔鏡冷刀技術具有較高手術安全性,能有效減少對子宮內膜的損傷,更利于病人術后內膜修復,特別是為有生育要求的病人提供了一個更合理的手術選擇。
此外,本研究中2組病人手術均順利完成,但是相較于對照組而言,觀察組所需手術時間明顯較短,分析其原因,可能由于Heos宮腔鏡冷刀系統手術時采用平行視野操作系統,充分利用與發揮光學特點,使手術視野擴大,利于器械操作,且冷刀操作過程中不產生氣泡,可減少對操作者的視覺干擾,進而縮短手術時間[16]。
綜上所述,宮腔鏡冷刀技術作為宮腔病變的一種新型治療方式,以該方法治療黏膜下肌瘤病人,在手術時間、并發癥等方面均具有顯著優勢,可有效保護病人生育力,特別對于具有生育需求的病人而言具有良好應用價值,在臨床中值得進一步推廣和使用。

