藥品生產(chǎn)企業(yè)偏差管理的現(xiàn)狀分析與對策
胡俊 李茜 王凌 俞娟 聶希霖 胡菁
人用藥品注冊技術(shù)要求國際協(xié)調(diào)會(International conference on harmonization of technical requirements for registration of pharmaceuticals for human use,ICH)Q7 首次給出了偏差的定義,它指偏離已批準(zhǔn)的指令或規(guī)定標(biāo)準(zhǔn)[1]。我國《藥品生產(chǎn)質(zhì)量管理規(guī)范》(2010年修訂)[2]第十章第二百五十條第五節(jié)雖然沒有給出偏差的具體定義,但也給出了相關(guān)的闡釋,即“任何偏差生產(chǎn)工藝、物料平衡限度、質(zhì)量標(biāo)準(zhǔn)、檢驗方法、操作規(guī)程等的情況均應(yīng)當(dāng)有記錄”。偏差管理在藥品全生命周期質(zhì)量管理過程中是不可或缺的重要內(nèi)容,它是一種發(fā)現(xiàn)問題、分析問題、解決問題并促進(jìn)質(zhì)量體系持續(xù)改進(jìn)的強(qiáng)有力手段;同時也是藥品生產(chǎn)企業(yè)質(zhì)量體系要素執(zhí)行的難點。國內(nèi)外藥政監(jiān)管機(jī)構(gòu)均對藥品生產(chǎn)企業(yè)建立偏差管理程序和標(biāo)準(zhǔn)有相應(yīng)的要求,進(jìn)行現(xiàn)場檢查時也會重點關(guān)注企業(yè)偏差的識別上報、調(diào)查評估以及糾正和預(yù)防措施的制訂和實施跟蹤等情況[3]。文章總結(jié)分析藥品生產(chǎn)企業(yè)偏差管理存在的現(xiàn)狀和問題,分析問題產(chǎn)生的根本原因,并提出相應(yīng)的對策,以期為藥品生產(chǎn)企業(yè)的偏差管理工作提供參考,同時也為藥品監(jiān)管檢查工作中對偏差管理的高效檢查提供借鑒。
1 偏差管理存在的問題與分析
1.1 偏差識別與上報流程存在邏輯問題,偏差描述不符合要求
企業(yè)人員發(fā)現(xiàn)偏差時,應(yīng)立即通過口頭或電話方等方式報告給相應(yīng)的負(fù)責(zé)人及質(zhì)量保證部門,并采取應(yīng)急處理措施。偏差上報時需記錄發(fā)生的時間、地點、人員、工序/過程、偏離的標(biāo)準(zhǔn)以及相應(yīng)的緊急處理措施,這些信息首先應(yīng)客觀準(zhǔn)確地記載在相應(yīng)的生產(chǎn)記錄中,再根據(jù)企業(yè)制訂的偏差管理程序發(fā)起偏差處理流程。在實踐過程中,可能因為企業(yè)人員對偏差識別和上報的流程理解不充分、培訓(xùn)不足,導(dǎo)致偏差上報與處理存在邏輯問題,如在批生產(chǎn)記錄中對相應(yīng)偏差的描述過于簡單,未記載偏差發(fā)生的具體內(nèi)容,僅描述為“詳情見偏差報告”,忽視了生產(chǎn)記錄與偏差報告內(nèi)容的先后邏輯關(guān)系問題。
1.2 偏差調(diào)查評估不夠充分,導(dǎo)致未識別根本原因
企業(yè)開展偏差調(diào)查時若較少使用有效的偏差調(diào)查工具,在處理過程中常以時間軸作為主線,僅以“流水賬”的方式進(jìn)行回顧性描述,缺乏有效的調(diào)查過程,會導(dǎo)致支持調(diào)查結(jié)論的數(shù)據(jù)不充分或不合理。如發(fā)生一次性儲液袋破損漏液的偏差,對導(dǎo)致漏液的原因分析不夠充分,識別的可能原因為轉(zhuǎn)運過程中發(fā)生碰撞事件導(dǎo)致袋體破損漏液,但相應(yīng)的調(diào)查證據(jù)不足,沒有進(jìn)行確證性研究等。
根據(jù)《藥品GMP 指南》[4]推薦的做法,企業(yè)應(yīng)使用質(zhì)量風(fēng)險管理工具開展偏差根源調(diào)查[5-7]。常見根源分析工具包含頭腦風(fēng)暴法、故障樹分析法、魚骨圖分析法、5 Why法等。較少使用或沒有選擇適宜的調(diào)查工具時,可能導(dǎo)致調(diào)查評估不充分,表現(xiàn)為調(diào)查不深入,未對導(dǎo)致偏差現(xiàn)象產(chǎn)生的各種可能相關(guān)因素進(jìn)行調(diào)查。如世界衛(wèi)生組織(World Health Organization,WHO)對我國某生物制品生產(chǎn)企業(yè)進(jìn)行現(xiàn)場檢查,查看1 例因溶氧含量異常造成產(chǎn)品不合格的偏差記錄,企業(yè)分析偏差發(fā)生的直接原因為溶氧電極故障導(dǎo)致溶氧含量低于標(biāo)準(zhǔn),但未確定根本原因,也未評估影響,沒有對過往涉及生產(chǎn)批次的影響進(jìn)行充分評估。
偏差調(diào)查評估不充分通常關(guān)聯(lián)糾正和預(yù)防措施不完善等審計缺陷,采取糾正措施目的是消除不合格的原因,采取預(yù)防措施目的是為消除潛在不合格或其他潛在風(fēng)險,應(yīng)對缺陷時考慮對關(guān)聯(lián)偏差進(jìn)行全面充分的調(diào)查,確定根本原因并制訂適宜的糾正和預(yù)防措施,這不僅是減少審計缺陷的重要技巧,也是企業(yè)防止重復(fù)偏差發(fā)生的有力手段[8]。
1.3 偏差涉及產(chǎn)品/物料的質(zhì)量,影響評估不充分
《藥品生產(chǎn)質(zhì)量管理規(guī)范》[2]明確指示任何偏差都應(yīng)當(dāng)評估其對產(chǎn)品或物料質(zhì)量的潛在影響。偏差處理程序中,除調(diào)查根本原因外,另一個著重點在于對涉及產(chǎn)品/物料質(zhì)量的影響性評估。確認(rèn)偏差的根本原因后,基于已收集的相關(guān)證據(jù)材料,需對偏差的影響范圍和嚴(yán)重程度做出評估,偏差調(diào)查過程中匯總分析的相關(guān)數(shù)據(jù)用于支撐偏差評估的結(jié)論。評估需考慮經(jīng)調(diào)查確認(rèn)直接涉及偏差的產(chǎn)品/物料的質(zhì)量影響和其他批次產(chǎn)品/物料的質(zhì)量影響(如前后生產(chǎn)批次或已放行或已上市銷售批次的影響)。必要時需進(jìn)行文獻(xiàn)查閱和實驗研究,或結(jié)合已開展的相關(guān)驗證,采納其數(shù)據(jù)或結(jié)論,來確認(rèn)對產(chǎn)品/物料的質(zhì)量影響。通常可結(jié)合額外檢驗和穩(wěn)定性考察進(jìn)一步確證對涉及產(chǎn)品質(zhì)量的影響。《藥品生產(chǎn)質(zhì)量管理規(guī)范》[2]明確指示對于重大偏差,其評估還應(yīng)著重考慮是否需對涉及產(chǎn)品進(jìn)行額外檢驗,如果對涉及產(chǎn)品效期有影響,還需進(jìn)行長期穩(wěn)定性考察。
企業(yè)通常只對調(diào)查結(jié)果的影響進(jìn)行簡要分析,風(fēng)險評估結(jié)論的說服力不夠,或?qū)⒄{(diào)查結(jié)論與影響性評估混為一談。偏差的評估流于表面化、形式化,較少評估對質(zhì)量管理體系的影響,如對驗證狀態(tài)的影響、對注冊文件的影響、對質(zhì)量協(xié)議和其他已批準(zhǔn)程序的影響。《藥品GMP 指南》[4]中明確指示,調(diào)查偏差的根本原因和進(jìn)行偏差的影響性評估均可選擇風(fēng)險分析方法,因此導(dǎo)致影響性評估不具體、不深入、不系統(tǒng)的根源還是在于質(zhì)量風(fēng)險管理工具運用不夠。
2 偏差管理提升的對策
2.1 通過完善培訓(xùn)體系以及組建主題專家團(tuán)隊開展偏差根本原因調(diào)查
通過質(zhì)量大講堂、質(zhì)量月活動以及建立企業(yè)內(nèi)各層級偏差處理培訓(xùn)等機(jī)制,持續(xù)提升企業(yè)人員識別偏差、準(zhǔn)確描述偏差的能力,這不僅是良好偏差管理的基礎(chǔ),也是科學(xué)分析偏差原因的前提。
識別偏差產(chǎn)生的根本原因是偏差處理中最重要的環(huán)節(jié),充分徹底的調(diào)查是進(jìn)行系統(tǒng)性影響評估和制訂適宜有效的糾正和預(yù)防措施的基礎(chǔ)。為了提高偏差調(diào)查的科學(xué)性,應(yīng)組建跨職能主題專家團(tuán)隊并使用有效的分析工具進(jìn)行根本原因調(diào)查。主題專家團(tuán)隊通常由企業(yè)里具備相應(yīng)資質(zhì)和能力的各領(lǐng)域負(fù)責(zé)人組成,必要時可需求企業(yè)外部資源的支持。
企業(yè)跨職能主題專家團(tuán)隊運用魚骨圖分析、故障樹分析等方法開展偏差處理,取得了良好效果。問題產(chǎn)生的特性通常受到多種可能因素的影響,將這些可能因素采用關(guān)聯(lián)性整理而成層次分明、條理清晰的形式,類似于“魚骨”,魚骨圖分析法是發(fā)現(xiàn)問題根本原因的分析方法,其簡潔實用、直觀精煉,有利于全面分析探討問題產(chǎn)生的根源。如使用魚骨圖法對投訴類偏差(產(chǎn)品使用過程中發(fā)現(xiàn)單支預(yù)灌封注射劑破損)進(jìn)行調(diào)查,從該批次產(chǎn)品生產(chǎn)、儲運及發(fā)運等多方面展開分析。見圖1。列出所有潛在的影響因素并逐一展開調(diào)查,最終分析得出不排除該支注射劑在使用過程中由于碰撞或其他誤操作導(dǎo)致破損的可能性,對客戶進(jìn)行回復(fù)后滿意。
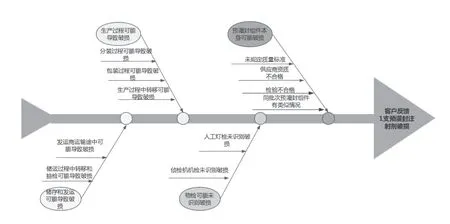
圖1 魚骨圖法分析單支預(yù)灌封注射劑破損的原因
故障樹采用由上往下的演繹式失效分析,用來查找系統(tǒng)失效的原因,并且探求合理方式降低風(fēng)險,在化工制藥等高風(fēng)險企業(yè)應(yīng)用廣泛。疫苗作為一種特殊藥品,其生產(chǎn)、貯存及運輸?shù)拳h(huán)節(jié)均對冷鏈有特殊要求[9]。某疫苗生產(chǎn)企業(yè)對2~8 ℃冷庫超溫的偏差采用故障樹分析法展開調(diào)查。見圖2。主題專家對該冷庫現(xiàn)場超溫故障進(jìn)行檢修,結(jié)合該冷庫維護(hù)維修情況的歷史回顧數(shù)據(jù),并對該冷庫近期運行的狀況進(jìn)行趨勢分析,認(rèn)為該偏差是由冷庫制冷機(jī)組偶發(fā)故障引起的制冷系統(tǒng)異常,從而導(dǎo)致冷庫溫度超標(biāo)。
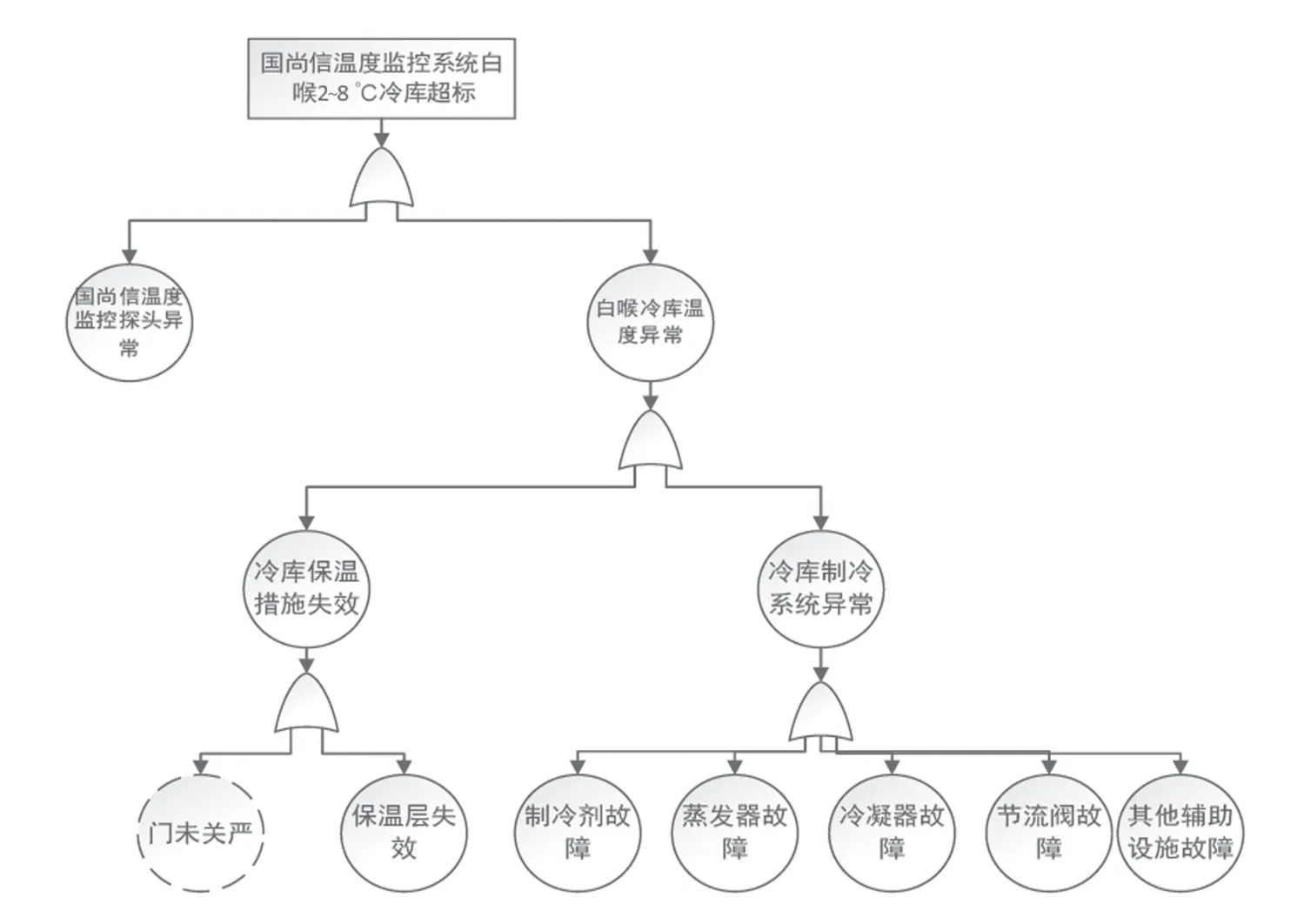
圖2 故障樹分析法調(diào)查2 ~8 ℃冷庫超溫的原因
對上述偏差調(diào)查的實例進(jìn)行總結(jié),得出只有采用有效的調(diào)查工具,才能深入挖掘?qū)е缕畎l(fā)生的各種可能相關(guān)因素,從而找出導(dǎo)致偏差發(fā)生的根本原因。
2.2 通過根本原因分析工具和思維導(dǎo)圖工具挖掘人員行為差錯偏差根源
人員行為差錯表現(xiàn)為計劃開展的活動偏離預(yù)期的目標(biāo),或操作超出工藝流程要求范圍,或要求進(jìn)行的活動出現(xiàn)缺失等情況。當(dāng)偏差原因被初步判斷為是人員行為差錯所造成時,應(yīng)對相關(guān)管理流程、設(shè)備、系統(tǒng)等方面可能存在的設(shè)計缺陷及漏洞進(jìn)一步確認(rèn),以確保潛在風(fēng)險未被忽視[10]。人為錯誤往往并非孤立事件,更可能源于體系管理上的缺陷或漏洞,若通過深入調(diào)查,可能會被識別為設(shè)備管理、工藝流程、操作程序或管理系統(tǒng)等根源類設(shè)計不足。應(yīng)重點調(diào)查這類人員行為差錯偏差的根源,簡單判斷為“人員行為差錯”并不可取,不利于質(zhì)量體系自我糾錯和持續(xù)改進(jìn)。
ISPE-PDA《Guide to Improving Quality Culture in Pharmaceutical Manufacturing Facilities》[11]指南中關(guān)于人為錯誤引發(fā)的偏差,推薦了具有指導(dǎo)意義的根源分析工具和方法。見表1。
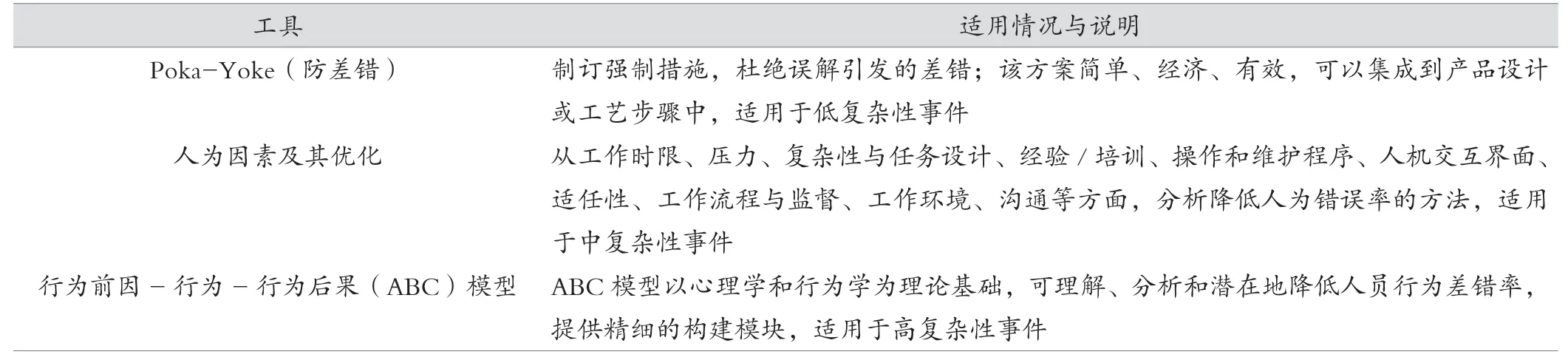
表1 人員行為差錯分析方法
除上述工具外,還可以采用思維導(dǎo)圖工具對導(dǎo)致人員/行為類錯誤進(jìn)行分析。見圖3。
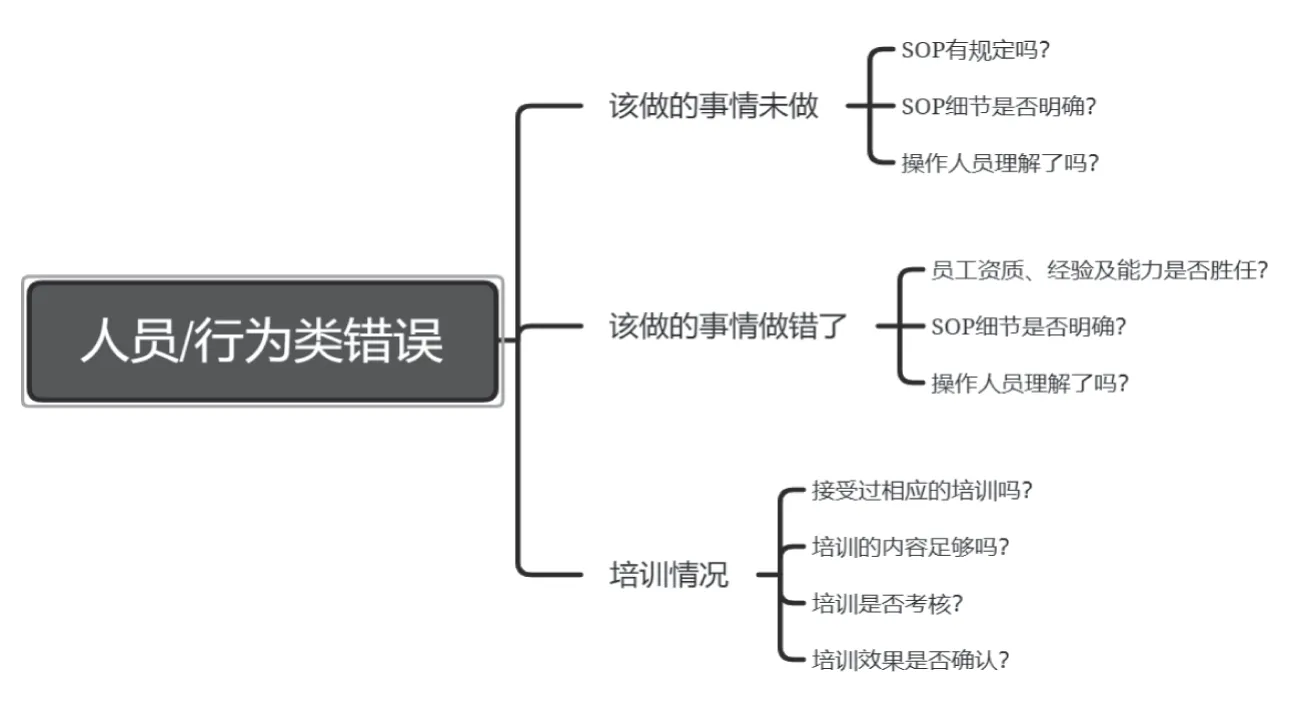
圖3 思維導(dǎo)圖對導(dǎo)致人為錯誤的根本原因進(jìn)行調(diào)查
影響人為差錯的因素包括但不限于標(biāo)準(zhǔn)作業(yè)流程規(guī)定不清晰、崗位職責(zé)不清晰、培訓(xùn)不全面或未確認(rèn)培訓(xùn)效果、人員資質(zhì)和能力與工作內(nèi)容不匹配、人機(jī)交互環(huán)境布局設(shè)計不合理及工作監(jiān)管、管理層級保障不夠等。只有基于根本原因分析結(jié)果制訂有效的糾正和預(yù)防措施,才能從根本上減少體系管理上的漏洞進(jìn)而降低人員行為差錯的發(fā)生率。
2.3 運用質(zhì)量風(fēng)險管理工具系統(tǒng)科學(xué)開展偏差影響性評估
針對偏差調(diào)查所識別出的風(fēng)險點,推薦使用失效模式與影響分析(failure mode and effects analysis,F(xiàn)MEA)工具進(jìn)行分析。結(jié)合相關(guān)文獻(xiàn),在防止差錯方面采用行動優(yōu)先級(action priority,AP)值的高、中、低水平對行動優(yōu)先級進(jìn)行確認(rèn)[12]。在評估系統(tǒng)性方面,既要考量涉及產(chǎn)品/物料質(zhì)量,還需評估對質(zhì)量體系的影響。在與產(chǎn)品/物料放行關(guān)聯(lián)性方面,放行前應(yīng)確認(rèn)相關(guān)偏差的處理情況。
近年來,WHO 對國內(nèi)藥品生產(chǎn)企業(yè)開展過的現(xiàn)場檢查缺陷中,“質(zhì)量控制與質(zhì)量保證”部分所列問題較多,尤以“偏差管理與糾正措施和預(yù)防措施(corrective action and preventive action,CAPA)”問題相對集中,表現(xiàn)為“偏差及CAPA 管理文件規(guī)定不完善,偏差識別上報能力不足,偏差調(diào)查評估不充分、分級不合理,CAPA 措施不合理、未跟蹤執(zhí)行情況,臺賬記錄不合理”等[13-14]。偏差重復(fù)發(fā)生率、偏差調(diào)查按時完成率以及CAPA 有效率均可以作為體現(xiàn)藥品生產(chǎn)企業(yè)質(zhì)量管理水平的重要指標(biāo),企業(yè)管理層應(yīng)重視偏差管理工作,支持建立良好的偏差管理程序并保證偏差管理體系規(guī)范運行,這不僅是順應(yīng)藥品監(jiān)管的要求,也是企業(yè)提高自身質(zhì)量管理水平,體現(xiàn)控制藥品質(zhì)量安全能力的有力手段。

