負性共刺激分子B7-H3和B7-H4在子宮內膜癌發生發展中的作用機制研究*
張曉露 李 蕾 吳 瓊
1 廣東省深圳市寶安區人民醫院婦科 518100; 2 廣東省深圳市第二人民醫院婦科
子宮內膜癌主要是指發生于女性子宮內膜的一類上皮性惡性病變,多見于圍絕經期以及絕經后女性,是臨床上最為常見的特發于女性的生殖系統惡性腫瘤之一[1]。手術聯合化療是當前臨床上治療該病的常規方案,盡管患者接受早期診治,但生存率仍較低,用藥相對局限[2]。腫瘤免疫微環境的形成介導了腫瘤的發生、發展、轉移等過程,故而針對腫瘤免疫微環境開展治療是當前國內外腫瘤研究的熱點[3]。隨著近年來有關研究的日益深入,越來越多的學者發現B7家族分子屬于免疫調控分子之一,于機體免疫微環境中起著至關重要的作用[4]。B7-H3和B7-H4是近年來新進發現的B7家族重要成員,已有研究報道證實二者在乳腺癌、前列腺癌、卵巢癌以及口腔癌等多種惡性腫瘤中存在異常表達,且和臨床預后轉歸息息相關[5-6]。鑒于此,本文通過研究負性共刺激分子B7-H3和B7-H4在子宮內膜癌發生發展中的作用機制,以期為子宮內膜癌的免疫微環境靶向治療提供新的思路,現報道如下。
1 資料與方法
1.1 一般資料 選擇我院2020年1月—2022年1月收治的60例子宮內膜癌患者開展研究,作為A組。年齡:≤50歲34例,>50歲26例;病理分級:G1級22例,G2+G3級38例;臨床分期:Ⅰ~Ⅱ期40例,Ⅲ~Ⅳ期20例;淋巴結轉移15例,無淋巴結轉移45例。另取同期收治的50例不典型增生子宮內膜患者作為B組。年齡≤50歲27例,>50歲23例。再取40例因子宮內膜病變切取正常子宮內膜組織患者作為C組。年齡≤50歲24例,>50歲16例。各組性別、年齡差異無統計學意義(P>0.05),可進行后續比較。納入標準:(1)所有受試者入院前均未接受過任何治療;(2)均為成年女性;(3)均經病理檢查確診;(4)臨床資料完整。排除標準:(1)合并其他惡性腫瘤;(2)神志異常;(3)同期參與其他研究。入組人員均已簽同意書,本研究經醫院醫學倫理委員會批準。
1.2 研究方法 (1)組織芯片制作:設計樣本數量合適、間距大小合適的組織芯片陣列;根據設計好的組織陣列對組織蠟塊進行編號。將相對應的組織病理蠟塊置于4℃冰箱中預冷30min,以提升組織蠟塊硬度,方便抽提。制備空白受體蠟塊,于實驗前進行預冷,借助組織陣列儀(Minicore軟件)涉及組織陣列,并抽提出病理蠟塊組織芯柱,促使其根據預定陣列排列在空白受體蠟塊上。將載入病理芯柱的受體蠟塊置于65~70℃恒溫烤箱中反復加熱5~19min,冷卻5~10min,持續3~4h,確保組織芯與受體蠟塊緊密相連。之后以切片機對組織芯片蠟塊實施適當的修整,進刀速度以10μm/r為宜,保證大部分組織芯柱露出蠟塊平面。以切片機對組織芯片蠟塊切片,進刀速度以4μm/r為宜,做連續切片,并遵循先后次序予以編號。(2)免疫組織化學法:具體操作按照說明書完成,其中B7-H3和B7-H4鼠單抗選用北京博奧森生物技術有限公司產品;白細胞介素-10(IL-10)、轉化生長因子-β1(TGF-β1)鼠單抗選用福建邁新生物技術有限公司產品。以PBS液替代一抗作為陰性對照,選用已知陽性切片作為陽性對照組。
1.3 結果判定 所有切片均于400倍視野下進行觀察,對視野下陽性細胞數量與染色情況實施評估。陽性細胞數量評分標準:陽性細胞占比<10%計為1分,陽性細胞占比10%~50%計為2分;陽性細胞占比>50%計為3分。染色情況評分:無著色計為0分;淡黃色計為1分;中度黃色計為2分;棕褐色計為3分。將陽性細胞數量評分和染色情況評分乘積作為最終結果,且將<3分視作陰性,≥3分視作陽性。

2 結果
2.1 三組B7-H3、B7-H4與IL-10、TGF-β1表達對比 A組B7-H3、B7-H4與IL-10、TGF-β1陽性率高于B組及C組(均P<0.05),見表1。

表1 三組B7-H3、B7-H4與IL-10、TGF-β1表達對比[n(%)]
2.2 B7-H3、B7-H4與IL-10、TGF-β1表達的相關性分析 經Spearman相關性分析發現:B7-H3、B7-H4與IL-10、TGF-β1表達均呈正相關關系(均P<0.05),見表2。

表2 B7-H3、B7-H4與IL-10、TGF-β1表達的相關性分析
2.3 B7-H3表達與子宮內膜癌患者臨床病理特征的關系分析 病理分級G2+G3、臨床分期Ⅲ~Ⅳ期及淋巴結轉移子宮內膜癌患者B7-H3陽性率高于病理分級G1、臨床分期Ⅰ~Ⅱ期及無淋巴結轉移患者(均P<0.05),見表3。
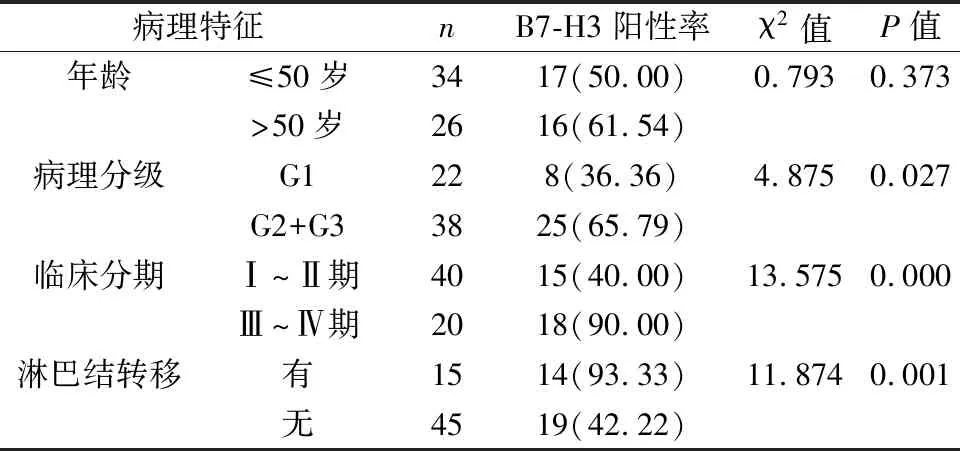
表3 B7-H3表達與子宮內膜癌患者臨床病理特征的關系分析[n(%)]
2.4 B7-H4表達與子宮內膜癌患者臨床病理特征的關系分析 病理分級G2+G3、臨床分期Ⅲ~Ⅳ期及淋巴結轉移子宮內膜癌患者B7-H4陽性率高于病理分級G1、臨床分期Ⅰ~Ⅱ期及無淋巴結轉移患者(均P<0.05),見表4。

表4 B7-H4表達與子宮內膜癌患者臨床病理特征的關系分析[n(%)]
3 討論
迄今為止,關于子宮內膜癌的具體發病機制尚未徹底闡明,目前普遍認為可能和遺傳、生活方式及精神壓力等因素有關[7]。根治性手術切除聯合化療是治療子宮內膜癌的有效方案,但患者仍有一定的復發率,且遠期生存率亦不十分理想[8]。免疫治療是當前國內外廣泛關注的前沿抗腫瘤手段,已有不少免疫治療藥物被批準用于肺癌、血液系統腫瘤等的治療中。另有研究表明[9-10],在機體出現免疫反應之時,T淋巴細胞會出現異常的增殖及活化,上述過程不但需要T淋巴細胞受體識別抗原提呈細胞或腫瘤細胞表面表達的組織相容性復合體所提供的信號,還需共刺激分子提呈信號。B7-H3和B7-H4均是免疫調控分子,在腫瘤的發生、發展過程中扮演著至關重要的作用,已成為近年來腫瘤研究的熱點指標。
本文結果顯示:A組B7-H3、B7-H4與IL-10、TGF-β1陽性率均高于B組以及C組。提示了B7-H3、B7-H4與IL-10、TGF-β1在子宮內膜癌患者中存在異常高表達。推敲原因,B7-H3與B7-H4均屬于B7家族成員之一,二者均是跨膜蛋白,可在腫瘤細胞以及抗原提呈細胞上表達,且兩者均可抑制T淋巴細胞的活動,進而影響機體內Th1、Th2以及Th17等多種免疫細胞的作用,促進腫瘤的免疫逃逸。相關研究表明[11],B7-H3蛋白可在前列腺癌以及卵巢癌等多種腫瘤組織中呈異常高表達,且和臨床不良預后密切相關。另有研究發現[12]:B7-H4具有抑制T淋巴細胞增殖以及活化的作用,進而影響白細胞介素-2(IL-2)以及白細胞介素-6(IL-6)等細胞因子的合成、分泌,發揮傳遞負性免疫信號作用。均為本研究結果提供了強有力佐證。IL-10則是由多種干細胞合成并分泌而來的一種多功能細胞因子,介導了細胞生長、分化的調控過程,并在炎性反應和免疫反應的發生過程中扮演著至關重要的角色,是目前國內外所公認的炎癥和免疫抑制因子。TGF-β1則是多肽類細胞因子之一,其在腫瘤發病早期可通過組織細胞生長周期進而起到抑癌作用,然而,在腫瘤晚期階段,該信號通路中的有關分子會出現突變或功能障礙,進而導致其對細胞的生長增殖調控作用喪失,促使腫瘤細胞反饋性增加TGF-β1的合成、分泌,刺激腫瘤新生血管的形成,同時抑制免疫細胞功能,為腫瘤細胞提供免疫抑制微環境,最終促進了腫瘤的增殖、分化以及侵襲轉移。此外,經Spearman相關性分析發現:B7-H3、B7-H4與IL-10、TGF-β1表達均呈正相關。說明B7-H3和B7-H4在子宮內膜癌發生、發展過程中的作用機制之一可能和調控IL-10、TGF-β1表達有關。考慮原因,可能是B7-H3和B7-H4的過表達可能會導致子宮內膜癌細胞中的JAK2-STAT3信號通路異常激活,進而促使上述信號通路磷酸化程度增加,進而激活多種經典蛋白質分子,導致IL-10以及TGF-β1的合成增多,最終促使子宮內膜癌細胞增殖加快、凋亡減少,且侵襲遷移能力增強。另外,病理分級G2+G3、臨床分期Ⅲ~Ⅳ期及淋巴結轉移子宮內膜癌患者B7-H3、B7-H4陽性率均高于病理分級G1、臨床分期Ⅰ~Ⅱ期及無淋巴結轉移患者。這充分證實了B7-H3和B7-H4表達與子宮內膜癌患者病情嚴重程度及淋巴結轉移有關。究其原因,可能和B7-H3、B7-H4通過激活JAK2-STAT3信號通路有關,激活的JAK可直接調控PI3K/AKT信號通路,而激活的STAT3可直接調控Ras以及PI3K/AKT信號通路,進而參與腫瘤的發生、發展以及侵襲、轉移過程。
綜上所述,負性共刺激分子B7-H3和B7-H4在子宮內膜癌中異常高表達,且介導了腫瘤的發生、發展及侵襲、轉移過程,其主要作用機制之一可能和調控IL-10、TGF-β1表達相關。

