PGE2、IL-6及乳酸水平對肝硬化合并消化道出血的診斷及預后預測價值
王 肖 李玲玲
山東省聊城市傳染病醫院消化內科 252000
肝硬化長期或反復作用形成的彌漫性肝損害,消化道出血是肝硬化常見的并發癥之一,經頸靜脈肝內分體分流術、食管靜脈曲張套扎術等方式進行治療,雖然能夠緩解患者臨床癥狀,但依然存在再出血的風險。因此,尋找相關指標盡早預測肝硬化合并消化道出血的預后情況,及時改善治療措施成為臨床研究的重點內容。研究發現[1],肝硬化合并消化道出血患者常伴隨急性炎癥發展過程。白細胞介素-6(Interleukin-6,IL-6)作為常見促炎因子的一種,可導致機體炎癥反應并加重器官損傷,在炎癥急性期可快速生成。前列腺素E2(Prostaglandin E2,PGE2)作為腸道黏膜保護因子的一種,可維持正常胃黏膜血流循環,從而避免消化道上皮出現損傷。另外有研究發現[2],血清乳酸與消化系統疾病的發生與發展具有一定相關性。因此,本研究選取我院收治的88例肝硬化合并消化道出血患者進行回顧性分析,探討PGE2、IL-6及乳酸水平對肝硬化合并消化道出血的診斷及預后預測價值,具體報道如下。
1 資料與方法
1.1 一般資料 選取我院2020年3月—2023年3月收治的88例肝硬化合并消化道出血患者進行回顧性分析,并將其作為消化道出血組,選取同期來我院接受治療的肝硬化未合并消化道出血的88例患者作為非消化道出血組,另選取同期來我院體檢的88例健康志愿者作為對照組,三組患者一般資料對比無明顯差異(P>0.05),見表1。88例消化道出血組患者依照30d內生存情況,將30d內死亡的21例患者分為死亡組,將其余67例患者分為存活組。

表1 兩組一般資料對比
1.2 選擇標準 納入標準:符合肝硬化診斷標準[3],且經上消化道造影或胃鏡診斷確診為消化道出血;年齡≥18歲;臨床資料完整;對本研究知情并簽署同意書。排除標準:合并消化道惡性腫瘤者;合并嚴重感染疾病者;合并心臟、腎臟等器官衰竭者;不能配合研究或中途退出者;合并嚴重心腦血管疾病者。
1.3 方法 收集所有患者一般臨床資料,患者入院后48h內的血液生化指標,其中包括白蛋白、血紅蛋白、AST、ALT、血小板、總膽紅素、凝血酶原時間、PGE2、IL-6、乳酸水平。PGE2、IL-6、乳酸檢測方法:采取患者空腹靜脈血4ml,離心后取上層清液,放置到-80℃的冰箱內待檢,應用酶聯免疫吸附試驗法檢測前列腺素E2(PGE2)、白細胞介素-6(IL-6)表達水平,檢測步驟嚴格依照試劑盒(生產企業:武漢華美生物工程有限公司)說明書進行。

2 結果
2.1 三組受檢者PGE2、IL-6及乳酸水平對比 消化道出血組PGE2水平明顯低于非消化道出血組和對照組,IL-6及乳酸水平明顯高于消化道出血組和對照組(P<0.05),見表2。

表2 三組受檢者PGE2、IL-6及乳酸水平對比
2.2 PGE2、IL-6及乳酸水平與肝硬化合并消化道出血的相關性 Spearman相關分析結果顯示:PGE2與肝硬化合并消化道出血呈負相關,IL-6及乳酸與肝硬化合并消化道出血呈正相關(P<0.05),見表3。

表3 PGE2、IL-6及乳酸水平與肝硬化合并消化道出血的相關性
2.3 PGE2、IL-6及乳酸對肝硬化合并消化道出血患者的診斷效能分析 PGE2、IL-6及乳酸水平三者聯合對肝硬化合并消化道出血的診斷效能優于單一檢測(P<0.05)。見表4、圖1。
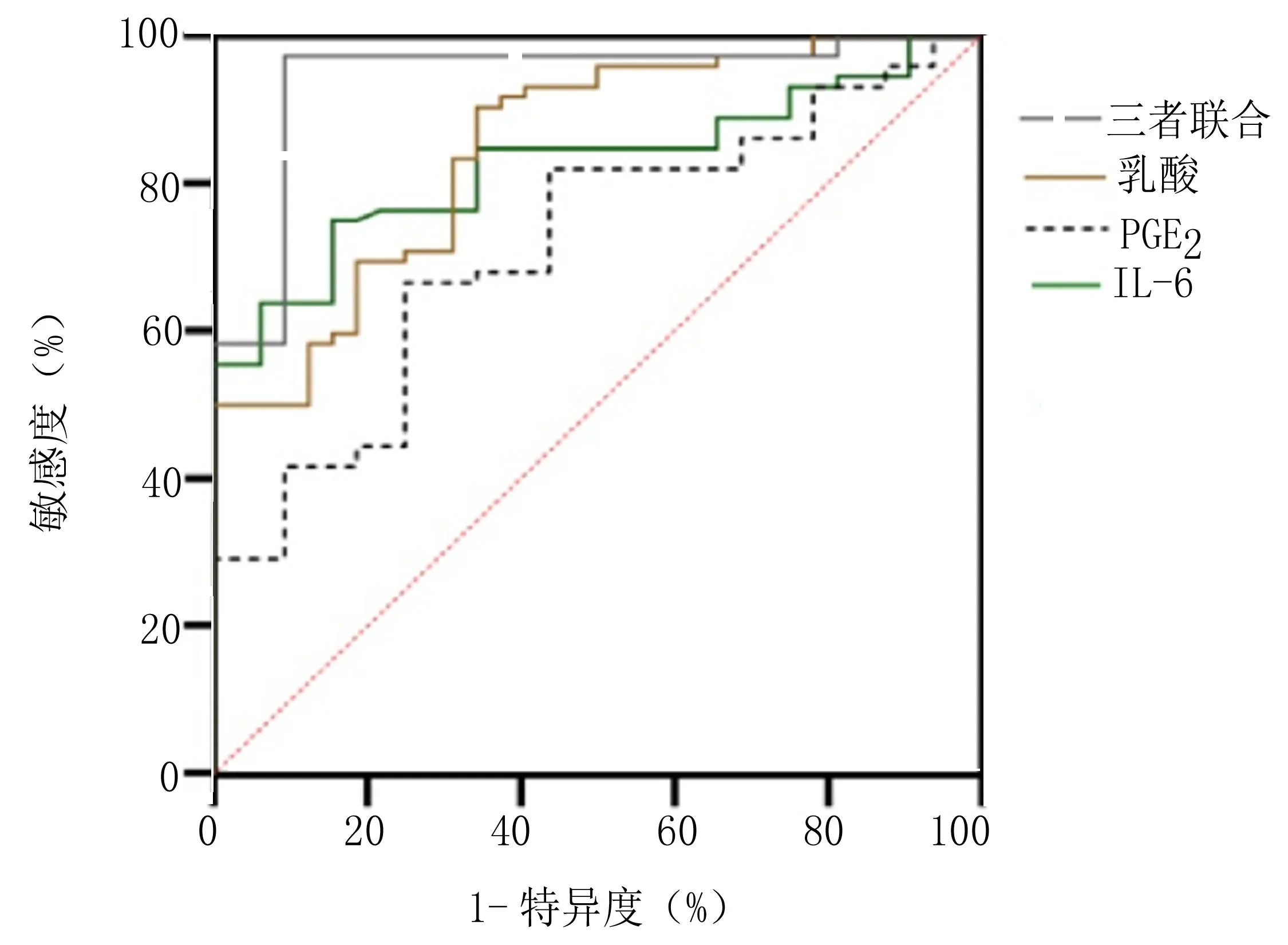
圖1 PGE2、IL-6及乳酸對肝硬化合并消化道出血的診斷效能ROC曲線
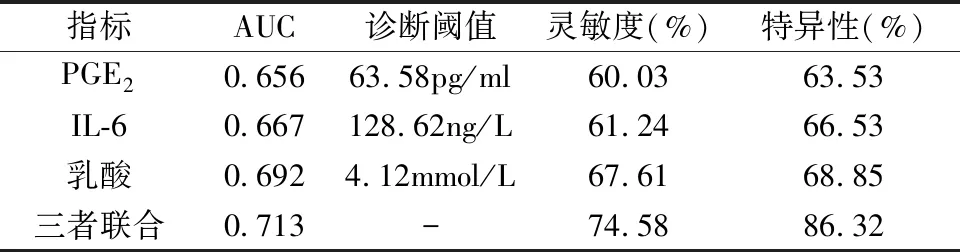
表4 PGE2、IL-6及乳酸水平對肝硬化合并消化道出血患者的診斷價值
2.4 死亡組與存活組一般情況對比 死亡組與存活組患者性別、年齡、BMI、肝硬化病因、合并基礎疾病、既往出血史、白蛋白、血紅蛋白、AST、ALT水平對比無明顯差異(P>0.05),死亡組與存活組患者肝腎綜合征、肝性腦病、自發性腹膜炎、肺部感染等并發癥發生率以及血小板、總膽紅素、凝血酶原時間、PGE2、IL-6、乳酸水平對比差異顯著(P<0.05),見表5。

表5 死亡組與存活組一般情況對比
2.5 肝硬化合并消化道出血的預后影響因素分析 對上述單因素分析中具有統計學差異的指標進行賦值,最終Logistic回歸分析結果表明:PGE2、IL-6及乳酸水平為肝硬化合并消化道出血的預后獨立影響因素(P<0.05),見表6。

表6 肝硬化合并消化道出血的預后影響因素分析
3 討論
肝硬化合并消化道出血臨床多表現為黑便、嘔血等現象,會加重肝功能損害,誘發肝腎綜合征、肝性腦病等并發癥,嚴重者會由大出血導致失血性休克現象,死亡率極高。據國外數據研究發現[4],肝硬化合并消化道出血首次發病死亡率高達25%~50%,雖然隨著內鏡治療技術的發展,肝硬化合并消化道出血的死亡率明顯下降,但是依然有部分患者預后較差,出現死亡情況。因此,本研究主要分析PGE2、IL-6及乳酸與肝硬化合并消化道出血的相關性,并分析其對患者的預后預測價值,希望能夠為臨床提供參考意見。
本研究結果顯示,消化道出血組PGE2水平明顯低于非消化道出血組和對照組,IL-6及乳酸水平明顯高于非消化道出血組和對照組(P<0.05);Spearman相關分析結果顯示:PGE2與肝硬化合并消化道出血呈負相關,IL-6及乳酸與肝硬化合并消化道出血呈正相關(P<0.05)。相關研究[5]顯示,PGE2、乳酸和消化系統疾病的發生具有明顯相關性,與本研究結果相符。這是因為,PGE2可以通過上調血管內皮生長因子表達,從而激活PGE2受體,刺激血管生成,對于消化道出血具有促進愈合作用。同時肝硬化合并消化道出血患者因為出血所導致的低血容量,會使機體呈現缺氧狀態,對葡萄糖三羧酸循環反應產生阻礙,葡萄糖參與糖酵解反應被還原成乳酸,導致厭氧條件下產生過量的乳酸。IL-6作為急性炎癥介質之一,能夠介導炎癥反應,加重小血管損傷,因此在肝硬化合并消化道出血患者機體內可快速生成;PGE2、IL-6及乳酸三者聯合對肝硬化合并消化道出血的診斷效能優于單一檢測(P<0.05)。提示臨床上可考慮應用PGE2、IL-6及乳酸水平作為肝硬化合并消化道出血的診斷。死亡組與存活組患者肝腎綜合征、肝性腦病、自發性腹膜炎、肺部感染等并發癥發生率以及血小板、總膽紅素、凝血酶原時間、PGE2、IL-6、乳酸水平對比差異顯著(P<0.05)。肝硬化存在多器官功能衰竭和易感性,當出現肝腎綜合征、肝性腦病、自發性腹膜炎、肺部感染等并發癥時,可能會影響肝硬化合并感染患者的臨床情況,與本研究結果相似。這是因為,若肝硬化合并消化道出血出現繼發感染患者,會增加器官衰竭等嚴重并發癥發生率,從而增加患者死亡率。另外本研究還發現,死亡患者與存活患者凝血酶原時間存在明顯差異,這是因為,肝細胞酶活性變化會對肝臟病理變化產生影響,肝臟也是凝血因子合成的重要場所,當出現肝功能損害之后,肝臟進行凝血因子合成時功能異常會降低肝臟內肝素滅活效果,從而降低凝血酶原活性,導致凝血酶原時間延長,增加消化道出血的嚴重性。高乳酸血癥多在器官功能障礙和組織缺氧等患者中出現,腸道對于低灌注情況比較敏感,肝硬化合并消化道出血患者由于腸系黏膜反射血管收縮,影響腸道氧攝入,由出血導致的低血容量容易導致組織缺氧,在厭氧條件下,丙酮酸會由乳酸脫氫酶轉化成大量乳酸,逐漸發展成高乳酸血癥,對肝硬化合并消化道出血患者各個器官功能代謝產生影響,導致休克、感染等不良事件發生,甚至影響患者預后水平[6]。Logistic回歸分析結果表明:PGE2、IL-6及乳酸水平為肝硬化合并消化道出血的預后獨立影響因素(P<0.05)。這主要是因為,IL-6作為多效性細胞因子,在急性期反應、炎癥反應、應激反應以及免疫應答中具有重要作用。在疾病發病之后IL-6水平會異常升高,而肝硬化合并消化道出血患者IL-6水平會明顯升高,而IL-6水平越高代表患者疾病越嚴重,同時可能會導致預后不良的發生。研究發現[7],阿司匹林所導致的PGE2水平降低,與阿司匹林后消化道出血具有一定相關性,同時PGE2水平越低患者出血風險越大,與本研究結果相似。
綜上所述,PGE2、IL-6及乳酸水平與肝硬化合并消化道出血具有明顯相關性,且三者聯合檢測對肝硬化合并消化道出血的診斷效能更高。另外,PGE2、IL-6及乳酸水平對于肝硬化合并消化道出血的預后情況具有獨立預測價值,因此臨床上需針對PGE2降低或IL-6、乳酸升高的患者采取相關措施,降低患者死亡率。

