解毒化瘀顆粒對急性肝衰竭大鼠NLRP3炎癥體調控作用的實驗研究*
唐秋媛 張榮臻 胡振斌 王挺帥 牙程玉 呂 超 陳月橋
廣西中醫藥大學第一附屬醫院,廣西南寧市 530023
急性肝衰竭(Acute liver failure)是一種在短時間內肝臟細胞出現大量變性壞死及凋亡,肝臟合成、解毒、排泄等功能受損,甚至引起機體代謝功能紊亂而出現嚴重的臨床綜合征,屬臨床上危重肝臟疾病之一[1-2]。該病發病急驟,進展迅速,預后多與患者肝臟儲備功能、凝血功能、肝病嚴重程度等多種因素相關,但至今發病機制尚未完全闡明,不少學者傾向于認同“二次打擊學說”,該學說以免疫炎癥損傷為核心,指出“內毒素→巨噬細胞→細胞因子風暴”為主要發病機制,認為HBV等因素通過直接損傷肝臟細胞,機體內毒素的增加從而誘導IL-6等多種細胞因子的產生,免疫炎癥系統異常出現過度免疫炎癥反應而對肝臟進行“二次打擊”,最終引發肝衰竭[3-4]。改善肝臟炎癥損傷是肝衰竭研究的熱點和難點,近年來研究發現NLRP3炎癥體及其上下游因子在固有免疫中發揮著重要作用,可通過激活Caspase-1,促使白介素等炎癥因子進行加工、釋放,引起炎癥反應,促使肝細胞壞死[5-7]。本研究通過觀察解毒化瘀顆粒對肝衰竭大鼠模型NLRP3炎癥體及其上下游相關因子的表達,探索其治療肝衰竭的作用機制。
1 材料與方法
1.1 實驗動物 SPF 級SD大鼠36只,雄性,7周齡,體重為(250±30)g,購于北京斯貝福生物技術有限公司,許可證號SCXK(京)2019-0010。飼養條件:溫度20~26℃,通風且濕度為40%~70%。進行適應性喂養(自由進食、飲水)1周。
1.2 藥物 解毒化瘀顆粒由茵陳30g,大黃15g,白花蛇舌草30g,赤芍50g,郁金15g,石菖蒲15g組成。采用配方顆粒(江陰天江藥業有限公司),由我院提供。一服藥使用雙蒸水27ml充分溶解藥物,藥物濃度設定為5.75g/ml,按照體重及給藥濃度稀釋到適宜濃度進行灌胃。D-半乳糖、脂多糖分別購于上海麥克林生化科技有限公司、北京索萊寶科技有限公司。
1.3 主要試劑和儀器 RIPA細胞裂解液(C1053,北京普利萊基因技術有限公司);BCA蛋白定量試劑盒(BCA Protein Assay Kit)(E-BC-K318-M,Elabscience);超純RNA提取試劑盒(CW0581M,CWBIO);Gsafe Red plus核酸染料(GK20002,GLPBIO);大鼠白細胞介素18(IL-18)ELISA試劑盒、大鼠白細胞介素1β(IL-1β)ELISA試劑盒(江蘇酶免實業有限公司);Marker(#26617,Thermo);Mouse Anti-GAPDH(HC301,TransGen Biotech,1/2 000);HRP conjugated Goat Anti-Mouse IgG (H+L) 、HRP conjugated Goat Anti-Rabbit IgG (H+L) (Servicebio,1/2 000);Rabbit Anti Caspase-1(Servicebio,1/1 000);Rabbit Anti NLRP3(Abcam,1/1 000);Rabbit Anti ASC(Bioss,1/1 000);ChamQ Universal SYBR qPCR Master Mix(Q711-02,Vazyme);紫外分光光度儀(NP80,NanoPhotometer);熒光PCR儀[CFX ConnectTM實時,伯樂生命醫學產品(上海)有限公司];全自動酶標儀(WD-2012B,北京六一儀器廠);蛋白垂直電泳儀(DYY-6C,北京市六一儀器廠);全自動化學發光圖像分析系統(Tanon-5200,上海天能科技有限公司)。
1.4 造模與給藥 采用隨機法將36只SPF級SD大鼠分為模型組、空白對照組和解毒化瘀顆粒組,每組12只,記錄各組大鼠體重。
采用腹腔聯合注射D-GalN+LPS致急性肝衰竭小鼠模型,使用前用生理鹽水將D-GalN 350mg稀釋成5ml,配制成的70mg/ml的溶液,LPS用無菌生理鹽水稀釋成7ml,配成5mg/ml的溶液,過濾除菌。腹腔注射D-GalN+LPS溶液(D-GalN溶液600mg/kg,LPS溶液20μg/kg)一次成膜。造模前1周按分組給藥:空白對照組:0.9%氯化鈉注射液(灌胃)+0.9%氯化鈉注射液(注射);模型組:0.9%氯化鈉注射液(灌胃)+造模藥物(注射);解毒化瘀顆粒組:解毒化瘀顆粒藥液(灌胃)+造模藥物(注射)。每只大鼠每次灌胃體積為10ml/kg,每天灌胃2次(8:00、22:00),給藥濃度57.55g/kg。
造模后48h進行取樣,用1%戊巴比妥鈉麻醉大鼠,腹主動脈采血,收集血清進行ELISA檢測,剖取肝臟,用PBS洗凈,濾紙吸干,稱重后分別予10%甲醛液固定及液氮保存,用于病理檢測、Western Blot及熒光定量PCR檢測。
1.5 病理檢測 取大鼠肝組織,包埋,切片,烤片,脫蠟,水化。蘇木精水溶液染色3min,鹽酸乙醇分化15s,返藍15s,流水沖洗,伊紅染色3min,沖洗,脫水,封片,鏡檢。
1.6 qPCR檢測大鼠肝組織中NLRP3、Caspase-1、ASC mRNA表達 提取各組大鼠肝組織總RNA,測定總RNA濃度,OD260×40=RNA ng/μl(濃度),1.8≤OD260/OD280≤2.2(純度),反轉錄合成cDNA,在RNase-free的PCR管中配制如下混合液20μl:Total RNA 1pg~1μg,4×gDNA wiper Mix 4μl,RNase-free ddH2O To 16μl,加入5×HiScript Ⅱ qRT SuperMix Ⅱ 4μl。上、下游引物各0.4μl,合成cDNA 1μl。引物序列見表1。95℃預變性10 min,95℃變性10s,58℃退火30s,72℃延伸30s(40個循環)。擴增反應在Roche Light Cycler 480 熒光定量PCR儀上進行,采用2-ΔΔCt法計算目的基因表達量。

表1 引物序列
1.7 Western Blot檢測肝組織中NLRP3、Caspase-1、ASC蛋白表達 提取各組大鼠肝組織總蛋白,測定蛋白濃度,配置SDS-PAGE膠,加入制膠板中,緩慢加入至板的2/3的位置,加入無水乙醇壓膠,待分離膠凝固后,加入濃縮膠,進行電泳,60V壓縮蛋白,80V分離蛋白。將樣本蛋白轉移至 PVDF膜。用1×轉膜液300mA恒流轉膜,用1×TBST配置3%的脫脂牛奶封閉液,封閉1h。洗膜,用1×TBST浸泡15min后棄掉,重復3次。分別加入一抗:Anti NLRP3(1/1 000),Anti Caspase-1(1/1 000),Anti ASC (1/1 000),4℃孵育過夜。加入相應的過氧化物酶標記的二抗,孵育2h,洗膜3次。配置發光液,成像,凝膠成像系統拍照分析。Image J軟件分析蛋白條帶灰度值。
1.8 ELISA檢測 按照試劑盒說明設置樣本孔和標準品孔,分別加入待測樣本及標準品各50μl,空白孔不加。除空白孔外,樣本孔和標準品孔每孔加入辣根過氧化物酶(HRP)標記的檢測抗體100μl,封板膜封閉反應孔,37℃水浴或恒溫箱溫育60min。棄去液體,吸水紙拍干,每孔加入洗滌液300μl,靜置1min,甩去洗滌液,吸水紙拍干,重復洗板5次。每孔加入底物A、B各50μl,37℃避光孵育15min。每孔加入終止液50μl,15min 內,在450nm波長處測定各孔的OD值。
1.9 統計學方法 所有數據均用IBM SPSS Statistics 19統計分析,兩組之間定量數值比較采用獨立樣本t檢驗,多組之間定量數值比較采用單因素方差分析,兩兩比較采用LSD法。檢驗水準α=0.05。以P<0.05作為顯著性差異。
2 結果
2.1 HE染色 如圖1所示,空白對照組:肝臟細胞圍繞中央靜脈排列呈放射狀,肝臟組織肝小葉結構清晰致密,未見明顯變性壞死、纖維組織增生及炎性細胞浸潤。模型組:肝臟組織肝小葉結構紊亂,肝索排列紊亂,肝細胞變性壞死嚴重,可見出血灶。解毒化瘀顆粒組:肝小葉、肝索結構稍紊亂,細胞壞死程度較輕。

空白對照組
2.2 qPCR檢測 如圖2所示,模型組大鼠肝組織中的ASC、NLRP3、Caspase-1 mRNA均較空白對照組升高,差異具有統計學意義(P<0.05);解毒化瘀顆粒組大鼠肝組織中的ASC、NLRP3、Caspase-1 mRNA的表達明顯低于模型組,具有統計學意義(P<0.05);結果顯示解毒化瘀顆粒可降低肝衰竭大鼠肝組織中NLRP3、Caspase-1 mRNA表達水平。
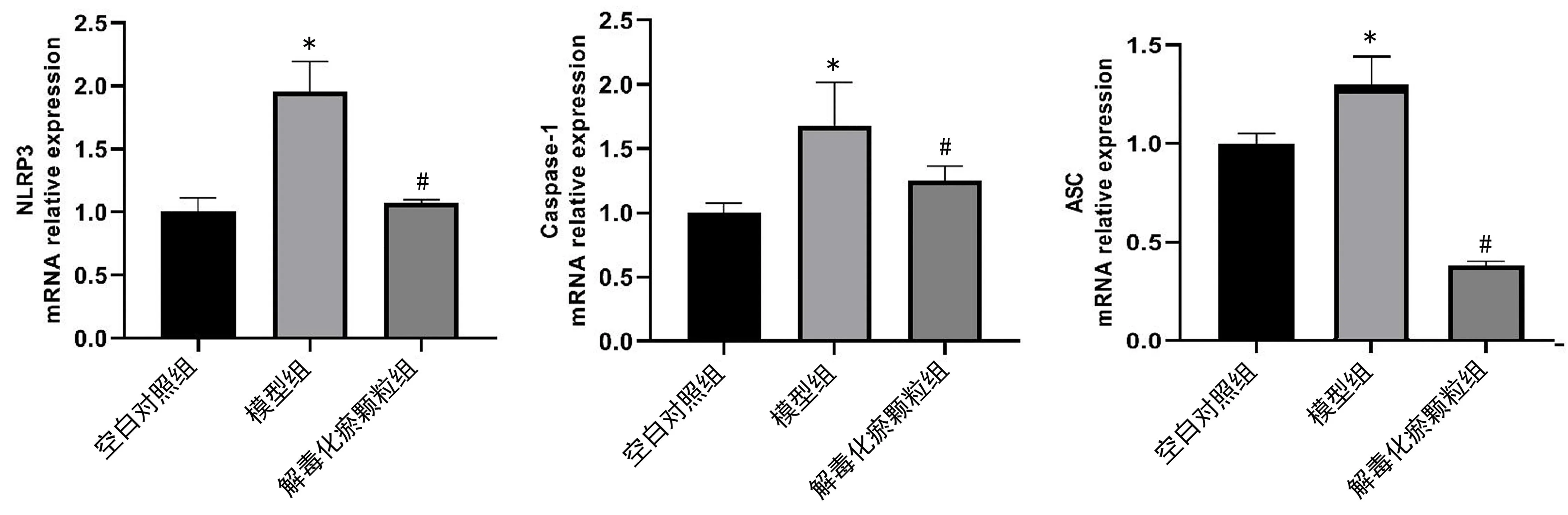
圖2 NLRP3、Caspase-1、ASC基因在各組的相對表達情況
2.3 WB檢測 如圖3所示,模型組、解毒化瘀顆粒組大鼠肝組織中的ASC、NLRP3、Caspase-1 蛋白表達均較空白對照組升高,差異具有統計學意義(P<0.05);解毒化瘀顆粒組大鼠肝組織中的ASC、NLRP3、Caspase-1 蛋白表達較模型組下降,差異具有統計學意義(P<0.05);結果顯示解毒化瘀顆粒可下調肝衰竭大鼠肝組織中NLRP3、Caspase-1 蛋白表達水平。
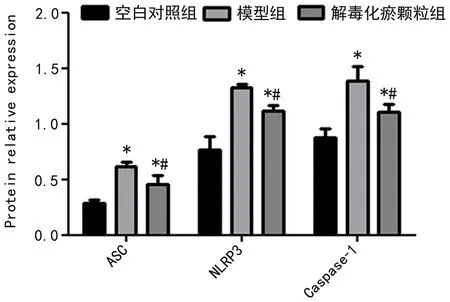
圖3 ASC、NLRP3、Caspase-1在各組的蛋白相對表達情況
2.4 ELISA檢測 如圖4所示,模型組大鼠血清中IL-1β、IL-18的表達均高于空白對照組,差異具有統計學意義(P<0.05);且解毒化瘀顆粒組大鼠血清中IL-1β、IL-18的表達較模型組下降,差異具有統計學意義(P<0.05);結果顯示解毒化瘀顆粒可下調肝衰竭大鼠血清中的IL-1β、IL-18表達水平。

圖4 ELISA檢測IL-1β、IL-18的含量
3 討論
肝衰竭是臨床病死率極高的嚴重肝病,具有起病急、進展迅速、并發癥多等特點,可導致多器官功能障礙,愈后極差。急性肝衰竭的病因復雜,發病機制尚未明確,結合現有的研究認為免疫炎癥損傷、腸道微生態失衡和肝臟微循環障礙在內的直接損傷和間接損傷多種因素等為其主要的發病機制[8-9]。近年來的研究陸續發現NLR家族成員(如NLRP1、NLRP3、IPAF和AIM-24等)能通過炎癥體多蛋白復合體激活Caspase-1,釋放多種炎癥因子和細胞因子,參與不同類型的炎癥反應[10]。
炎癥體是一種蛋白復合體,NLRP3參與形成的NLRP3炎癥體介導促炎因子IL-1β、IL-18的產生。
NLRP3炎癥體具有識別機體受損或危險信號,被證實參與痛風、重癥肌無力、急性腎損傷等多種自身免疫性疾病的發病機制。此外,NLRP3炎癥體還參與急慢性肝病的發病機制[11-13]。該炎癥體涵蓋有Caspase-1、IL-1β、IL-22、TNF-α和MCP-1等,被激活后,Caspase-1被活化,進一步促進IL-1β等促炎細胞因子等分泌,釋放至細胞外而發揮炎癥效應[14-16],進而促進肝細胞壞死。隨著研究的深入,人們逐漸意識到炎癥體在炎癥反應中扮演著重要角色,是炎癥反應的核心,在炎癥的啟動及維持上起關鍵性作用,作為一種極具應用潛力的治療新靶點,炎癥體正迅速成為國際研究的熱點。并且,隨著研究不斷深入,越來越多的研究表明,NLRP3炎癥體參與了急性肝衰竭的發病過程。因此,深入探索炎癥體參與的免疫應答分子機制,對闡明及豐富肝衰竭“免疫炎癥二次打擊學說”具有重要意義。
毛德文教授打破了因“濕熱發黃、瘀熱成毒” 形成肝衰竭的傳統中醫理念,首次提出以“毒邪致病”的新理念,形成了“毒邪病因”學說[17-18]。該學說認為 “熱毒內蘊、瘀血內阻”為核心病機, “毒”“瘀”“痰(濁)”膠結[19]為其主要的病理因素。由于毒邪多在各種急性傳染病后期治病,加之其發病急、病程短,往往不能及時控制病情發展,因此對于HBV所致的急性肝衰竭的早期診斷應從毒邪出發,為此,毛德文教授結合其多年臨床經驗,創制了解毒化瘀顆粒[組成:茵陳30g、大黃15g(后下)、白花蛇舌草30g、赤芍50g、郁金15g、石菖蒲15g],具有解毒化瘀、開竅醒神、生新見長之功效[20]。
本研究證實了解毒化瘀顆粒對急性肝衰竭大鼠NLRP3炎癥體NLRP3、ASC、Caspase-1、IL-1β和IL-18因子具有調控作用,能夠下調NLRP3炎癥體NLRP3、Caspase-1、ASC、IL-1β和IL-18等相關因子的表達,極大豐富及支撐肝衰竭“免疫炎癥二次打擊學說”的科學內涵,為肝衰竭的治療提供新的靶標,深刻揭示中藥解毒化瘀顆粒緩解肝臟炎癥損傷,拮抗肝衰竭的分子機制,對促進中醫藥發展具有重要意義。

