多重PCR毛細(xì)管電泳細(xì)菌快速鑒定方法的建立和臨床應(yīng)用研究
湯榮睿,陳 瑤,李 娟,李 蓉,王 芳,裴光德
重慶市沙坪壩區(qū)人民醫(yī)院醫(yī)學(xué)檢驗(yàn)科,重慶 400033
快速、準(zhǔn)確地為臨床提供細(xì)菌鑒定報(bào)告有利于臨床及時(shí)診斷感染性疾病、合理使用抗菌藥物、降低病死率、減少患者治療費(fèi)用、提高醫(yī)院感染防控能力。有研究表明,有效的抗菌藥物治療每延遲1 h,感染性休克患者出現(xiàn)低血壓后的存活率平均下降7.6%[1]。臨床實(shí)踐中,細(xì)菌鑒定采用的傳統(tǒng)方法為培養(yǎng)法,檢測(cè)周期一般為2~4 d,難以實(shí)現(xiàn)快速報(bào)告檢測(cè)結(jié)果。多重PCR技術(shù)是指通過(guò)一次PCR反應(yīng)同時(shí)對(duì)多個(gè)靶標(biāo)進(jìn)行擴(kuò)增,結(jié)合一定的檢測(cè)手段對(duì)擴(kuò)增產(chǎn)物進(jìn)行檢測(cè)從而實(shí)現(xiàn)對(duì)多個(gè)靶標(biāo)進(jìn)行診斷的技術(shù)[2]。該技術(shù)操作簡(jiǎn)便快速,靈敏度高,可直接提取標(biāo)本核酸進(jìn)行擴(kuò)增檢測(cè)[3-10]。省去了轉(zhuǎn)種分離培養(yǎng)的大部分時(shí)間,在時(shí)效上明顯優(yōu)于傳統(tǒng)培養(yǎng)法。本研究擬建立基于多重PCR毛細(xì)管電泳技術(shù)的細(xì)菌快速鑒定方法,與培養(yǎng)法進(jìn)行結(jié)果比對(duì),評(píng)估其臨床應(yīng)用價(jià)值,為提高細(xì)菌鑒定速度、提升臨床感染性疾病診療效果、推進(jìn)抗菌藥物合理使用提供參考。
1 材料與方法
1.1標(biāo)本來(lái)源 收集本院2022年1月至2023年2月臨床送檢的微生物培養(yǎng)標(biāo)本150例,包括血液44例(29.33%)、尿液52例(34.67%)、痰液41例(27.33%)、胸腹水8例(5.34%)、腦脊液5例(3.33%)。標(biāo)本的采集、送檢、接收均嚴(yán)格按照《全國(guó)臨床檢驗(yàn)操作規(guī)程》要求執(zhí)行,對(duì)痰標(biāo)本按照《WS/T 499-2017 下呼吸道感染細(xì)菌培養(yǎng)操作指南》進(jìn)行質(zhì)量篩查與評(píng)估,判定為可接收標(biāo)本的標(biāo)準(zhǔn)為鱗狀上皮細(xì)胞<10個(gè)/低倍視野,白細(xì)胞>25個(gè)/低倍視野。
1.2儀器與試劑 A100型PCR儀(杭州朗基科學(xué)儀器有限公司)、Qsep400型全自動(dòng)毛細(xì)管電泳儀[光鼎生物科技(江蘇)有限公司]、HH-1型恒溫水浴鍋(嘉興俊恩電子有限公司)、VORTEX-GENIE 2型渦旋混勻儀(美國(guó)Scientific Industries公司)、5424R型高速離心機(jī)(德國(guó)Eppendorf公司)、NanoDrop 1000型微量紫外可見(jiàn)分光光度計(jì)(美國(guó)Thermo Fisher公司)。High Resolution S1 cartridge(一種高分辨率卡夾,用于與Qsep系列儀器搭配進(jìn)行核酸片段的檢測(cè))、DNA標(biāo)記物1K Size marker、1K Alignment marker均為光鼎生物科技(江蘇)有限公司產(chǎn)品,Triton X-100(北京博遠(yuǎn)泰隆生物科技有限公司)、礦物油(美國(guó)BBI公司)、無(wú)核酸水(Invitrogen公司)。TDR-300BPLUS型全自動(dòng)細(xì)菌鑒定及藥敏分析儀(天地人公司)、TDR-Z200型細(xì)菌濁度儀(天地人公司)、DH-160Ⅰ型二氧化碳培養(yǎng)箱(上海三騰儀器有限公司),腸桿菌科細(xì)菌生化藥敏試驗(yàn)卡、非發(fā)酵菌生化藥敏試驗(yàn)卡、葡萄球菌生化藥敏試驗(yàn)卡、鏈球菌生化藥敏試驗(yàn)卡、奈瑟菌/嗜血桿菌生化藥敏試驗(yàn)卡均為天地人公司產(chǎn)品。
1.3方法
1.3.1檢測(cè)的病原菌 根據(jù)感染相關(guān)指南中感染病原譜[11-13]、全國(guó)細(xì)菌耐藥監(jiān)測(cè)網(wǎng)[14]以及一些大型三甲醫(yī)院的統(tǒng)計(jì)數(shù)據(jù)[15-16]。選取23種常見(jiàn)病原菌作為研究對(duì)象,分別是大腸埃希菌、肺炎克雷伯菌、金黃色葡萄球菌、銅綠假單胞菌、鮑曼不動(dòng)桿菌、醋酸鈣不動(dòng)桿菌、醫(yī)院不動(dòng)桿菌、皮特不動(dòng)桿菌、屎腸球菌、糞腸球菌、嗜麥芽窄食單胞菌、陰溝腸桿菌、流感嗜血桿菌、肺炎鏈球菌、化膿性鏈球菌、表皮葡萄球菌、無(wú)乳鏈球菌、普通變形桿菌、奇異變形桿菌、黏質(zhì)沙雷氏菌、產(chǎn)氣腸桿菌、脆弱類(lèi)桿菌、糞產(chǎn)堿桿菌。
1.3.2建立多重PCR毛細(xì)管電泳檢測(cè)體系 (1)引物設(shè)計(jì):通過(guò)細(xì)菌靶標(biāo)篩選軟件選出23種細(xì)菌特異性檢測(cè)靶標(biāo),用Primer5.0軟件設(shè)計(jì)其特異性引物并篩選出最優(yōu)的多重引物組。(2)引物驗(yàn)證:分別用每對(duì)引物對(duì)質(zhì)粒標(biāo)準(zhǔn)品和目標(biāo)菌株基因組DNA為模板進(jìn)行單引物單模板的PCR擴(kuò)增,將PCR擴(kuò)增產(chǎn)物進(jìn)行毛細(xì)管電泳檢測(cè),分析PCR產(chǎn)物是否單一特異性擴(kuò)增和PCR產(chǎn)物水平,并將PCR產(chǎn)物進(jìn)行Sanger測(cè)序,驗(yàn)證引物敏感性。除去待驗(yàn)證目標(biāo)菌株DNA,將非檢測(cè)范圍內(nèi)的菌株DNA和人基因組DNA混合,使用目標(biāo)菌株的特異性引物進(jìn)行單引物單模板的PCR擴(kuò)增,將PCR擴(kuò)增產(chǎn)物進(jìn)行毛細(xì)管電泳檢測(cè),分析PCR產(chǎn)物有無(wú)非特異性條帶驗(yàn)證引物特異性,建立各病原菌單重PCR檢測(cè)體系。(3)多重PCR檢測(cè)體系:在單重PCR檢測(cè)體系基礎(chǔ)上依次増加反應(yīng)重?cái)?shù),以質(zhì)粒標(biāo)準(zhǔn)品和標(biāo)準(zhǔn)菌株為模板(各模板拷貝數(shù)濃度保持一致),通過(guò)調(diào)整退火溫度和優(yōu)化引物濃度等方法,建立最優(yōu)的多重PCR檢測(cè)體系。每組多重PCR檢測(cè)體系在一個(gè)反應(yīng)管中進(jìn)行,每組中均含有需檢測(cè)病原菌的引物對(duì)。第1組檢測(cè)的病原菌為銅綠假單胞菌、表皮葡萄球菌、嗜麥芽窄食單胞菌、肺炎克雷伯菌和鮑曼不動(dòng)桿菌;第2組檢測(cè)的病原菌為流感嗜血桿菌、大腸埃希菌、肺炎鏈球菌和陰溝腸桿菌;第3組檢測(cè)的病原菌為金黃色葡萄球菌菌、化膿性鏈球菌、糞產(chǎn)堿桿菌、皮特不動(dòng)桿菌、屎腸球菌、普通變形桿菌和無(wú)乳鏈球菌;第4組檢測(cè)的病原菌為糞腸球菌、醫(yī)院不動(dòng)桿菌、黏質(zhì)沙雷菌、醋酸鈣不動(dòng)桿菌、產(chǎn)氣腸桿菌、奇異變形桿菌和脆弱類(lèi)桿菌。(4)多重PCR毛細(xì)管電泳法(以下簡(jiǎn)稱(chēng)多重PCR法)的檢測(cè)步驟。①核酸提取釋放:將1.5 mL離心管中的樣本吹打混勻,12 000 r/min離心10 min,棄上清;在沉淀中加入20~100 μL 0.1% TritonX-100,渦旋混勻,將沉淀懸浮液置于100 ℃沸水浴10 min;沸水浴后迅速冰浴5 min,然后8 000 r/min離心5 min,取上清液于新的1.5 mL離心管中,所得上清液即為檢測(cè)模板,置-80 ℃?zhèn)溆谩"赑CR反應(yīng)體系配制與檢測(cè):將反應(yīng)液分別加入8聯(lián)管或96孔板中,每孔加17.5 μL,并往反應(yīng)孔中分別依次加入2.5 μL的陰性質(zhì)控品、待測(cè)樣本和陽(yáng)性質(zhì)控品,最后加入10 μL礦物油后,蓋好蓋子,充分混勻并離心。上述配制好的試劑進(jìn)行PCR擴(kuò)增,擴(kuò)增程序如下,98 ℃預(yù)變性10 min,98℃ 10 s、60 ℃ 10 s、72 ℃ 30 s,循環(huán)35次,最后72 ℃延伸5min,4 ℃結(jié)束反應(yīng)。③毛細(xì)管電泳檢測(cè)及結(jié)果分析:按照儀器說(shuō)明書(shū)使用Qsep400全自動(dòng)毛細(xì)管電泳儀對(duì)PCR產(chǎn)物進(jìn)行電泳,根據(jù)預(yù)期PCR擴(kuò)增片段大小對(duì)結(jié)果進(jìn)行判定。
1.3.3臨床標(biāo)本檢測(cè) 將每例臨床標(biāo)本分成2份,一份采用培養(yǎng)法,嚴(yán)格按照《全國(guó)臨床檢驗(yàn)操作規(guī)程(第4版)》進(jìn)行細(xì)菌培養(yǎng)鑒定,采用TDR-300BPLUS全自動(dòng)細(xì)菌鑒定分析系統(tǒng)及配套細(xì)菌鑒定卡;一份采用多重PCR法進(jìn)行細(xì)菌鑒定。
1.4統(tǒng)計(jì)學(xué)處理 使用SPSS22.0進(jìn)行統(tǒng)計(jì)學(xué)分析,計(jì)數(shù)資料采用頻數(shù)或百分率表示,組間比較采用χ2檢驗(yàn),P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié) 果
2.1培養(yǎng)法檢測(cè)結(jié)果 150例臨床標(biāo)本中,細(xì)菌培養(yǎng)檢測(cè)出陽(yáng)性標(biāo)本105例,分離出14種共105株細(xì)菌,陽(yáng)性率為70.0%(105/150),其中大腸埃希菌34株、流感嗜血桿菌12株、肺炎克雷伯菌10株、肺炎鏈球菌9株、奇異變形桿菌8株、金黃色葡萄球菌6株、糞腸球菌6株、屎腸球菌6株,其他細(xì)菌7種14株。
2.2多重PCR法檢測(cè)結(jié)果 在150例標(biāo)本中,多重PCR法檢測(cè)出陽(yáng)性標(biāo)本110例,分離出15種138株細(xì)菌,陽(yáng)性率為73.3%(110/150),其中大腸埃希菌35株、肺炎鏈球菌24株、流感嗜血桿菌16株、肺炎克雷伯菌10株、屎腸球菌9株、金黃色葡萄球菌8株、奇異變形桿菌8株、糞腸球菌8株、鮑曼不動(dòng)桿菌6株,其他細(xì)菌6種14株。
2.3兩種方法檢測(cè)的陽(yáng)性率比較 培養(yǎng)法和多重PCR法檢測(cè)的陽(yáng)性率比較,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),見(jiàn)表1。
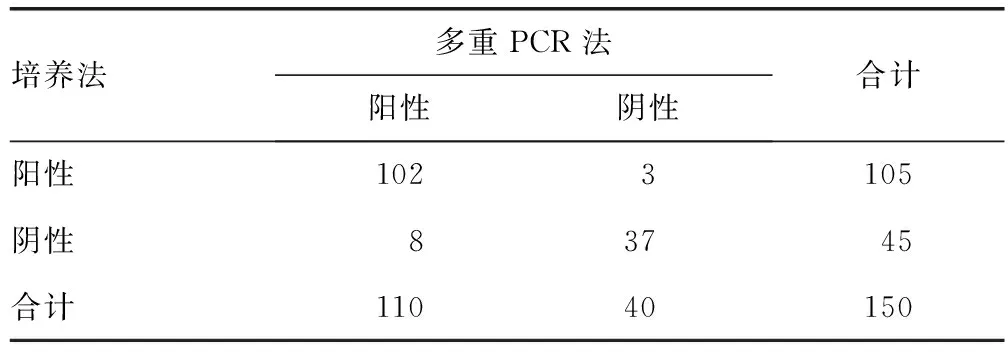
表1 培養(yǎng)法和多重PCR法檢測(cè)結(jié)果的比較(n)
2.4兩種方法檢出病原菌的檢出率和構(gòu)成比 培養(yǎng)法和多重PCR法檢測(cè)出的菌株種類(lèi)構(gòu)成情況和檢出率見(jiàn)表2。

表2 病原菌檢出率與構(gòu)成比[n(%)]
2.5兩種方法對(duì)5種病原菌檢測(cè)結(jié)果的比較 選取臨床常見(jiàn)苛養(yǎng)菌及多重PCR法檢出率前三的細(xì)菌,對(duì)其兩種方法的檢出率進(jìn)行對(duì)比,見(jiàn)表3。多重PCR法對(duì)肺炎鏈球菌的檢出率[16.0%(24/150)]高于培養(yǎng)法[6.0%(9/150)],差異有統(tǒng)計(jì)學(xué)意義(P<0.05);兩種方法對(duì)流感嗜血桿菌、大腸埃希菌、肺炎克雷伯菌、屎腸球菌四種病原菌的檢出率比較,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。

表3 兩種方法對(duì)5種致病菌檢測(cè)結(jié)果的對(duì)比(n)
2.6多重PCR法的檢測(cè)效能評(píng)價(jià) 以培養(yǎng)法為參考標(biāo)準(zhǔn),多重PCR法檢測(cè)效能的評(píng)價(jià)指標(biāo)見(jiàn)表4。以培養(yǎng)法為參考標(biāo)準(zhǔn),對(duì)150例臨床標(biāo)本的檢測(cè)中,多重PCR法的符合率為79.3%;對(duì)血液標(biāo)本檢測(cè)的符合率最高,為100.0%,其次為體液標(biāo)本,符合率為84.6%,痰液標(biāo)本符合率為48.8%。

表4 多重PCR法檢測(cè)效能的評(píng)價(jià)(%)
2.7多重PCR對(duì)混合菌標(biāo)本的檢出情況 多重PCR法共檢出23例混合菌標(biāo)本,其中痰標(biāo)本有16例,尿液標(biāo)本有7例,多重PCR對(duì)混合菌標(biāo)本的檢出率為15.3%,培養(yǎng)法未檢出混合菌標(biāo)本。見(jiàn)表5。

表5 多重PCR對(duì)混合菌標(biāo)本檢出情況(n=150)
2.8檢測(cè)時(shí)效性 培養(yǎng)法需將樣品接種在平板培養(yǎng)純化后,再通過(guò)微生物鑒定儀進(jìn)行鑒定。檢測(cè)時(shí)間需要2~4 d;多重PCR法檢測(cè)時(shí)間為3~6 h。可見(jiàn)用多重PCR法進(jìn)行細(xì)菌鑒定,可明顯縮短檢測(cè)周期。
3 討 論
目前,各醫(yī)療機(jī)構(gòu)微生物室細(xì)菌鑒定采用的方法大多為培養(yǎng)法,其優(yōu)點(diǎn)是成本較低,適合基層醫(yī)院開(kāi)展,缺點(diǎn)是耗時(shí)長(zhǎng),從標(biāo)本接種、分純、鑒定結(jié)果報(bào)告一般需要2~4 d甚至更長(zhǎng)時(shí)間,難以實(shí)現(xiàn)臨床細(xì)菌鑒定結(jié)果的快速報(bào)告[17],而且實(shí)驗(yàn)室的培養(yǎng)條件、采集標(biāo)本前患者是否使用抗菌藥物、技術(shù)人員操作因素等都會(huì)影響培養(yǎng)結(jié)果。雖然近幾年基質(zhì)輔助激光解析電離-飛行時(shí)間質(zhì)譜(MALDI-TOF)技術(shù)已經(jīng)逐步在三甲醫(yī)院中應(yīng)用,可在一定程度上縮短鑒定時(shí)間,但該方法目前還不能直接檢測(cè)臨床標(biāo)本,在鑒定前仍需進(jìn)行細(xì)菌培養(yǎng)和分純,因此耗時(shí)一般也在24 h以上。近年來(lái)國(guó)內(nèi)外基于多重PCR技術(shù)對(duì)病原體鑒定的相關(guān)研究取得了一定進(jìn)展,多重PCR具有高靈敏度、高通量、快速高效等優(yōu)勢(shì),有利于臨床快速鑒定感染病原體,及時(shí)診斷并啟動(dòng)靶向治療,從而縮短有效治療的時(shí)間[18-21]。
本研究建立的多重PCR法和培養(yǎng)法的結(jié)果比對(duì)顯示,多重PCR對(duì)肺炎鏈球菌檢出率為16.0%,培養(yǎng)法為6.0%,兩者之間比較,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。本研究中,多重PCR對(duì)兒童社區(qū)獲得性肺炎首要病原菌肺炎鏈球菌檢測(cè)的靈敏度達(dá)到100.0%,檢出率是培養(yǎng)法的2.7倍,優(yōu)于培養(yǎng)法,且檢測(cè)時(shí)間僅為3~6 h,比傳統(tǒng)細(xì)菌培養(yǎng)快很多,對(duì)臨床早期使用抗菌藥物具有重要的指導(dǎo)意義。由于抗菌藥物濫用等原因,老人和兒童等免疫力低下患者更容易發(fā)生混合菌感染,因多重PCR技術(shù)在單次反應(yīng)中可以同時(shí)檢測(cè)多個(gè)病原菌,能快速檢測(cè)出潛在的混合菌感染,對(duì)臨床及時(shí)診斷和治療混合感染具有重要意義[4],本研究結(jié)果顯示,在150例標(biāo)本中,多重PCR對(duì)混合菌標(biāo)本的檢出率達(dá)到15.3%,而傳統(tǒng)培養(yǎng)法未檢出,也顯示多重PCR相比培養(yǎng)法對(duì)混合菌標(biāo)本具有更高的檢出率,但檢出的混合菌是致病菌還是定植菌,還需要進(jìn)一步加強(qiáng)臨床符合率的調(diào)查。
以培養(yǎng)法為參考標(biāo)準(zhǔn),多重PCR法檢測(cè)符合率為79.3%。其差異可能是因?yàn)榕囵B(yǎng)法必須先通過(guò)培養(yǎng)進(jìn)行菌落提取和純化,而實(shí)驗(yàn)室的培養(yǎng)條件、細(xì)菌本身的結(jié)構(gòu)特性以及技術(shù)人員操作因素等都會(huì)影響培養(yǎng)的結(jié)果,尤其是對(duì)混合感染檢測(cè)結(jié)果的影響較大。多重PCR法因?yàn)閷?duì)肺炎鏈球菌和混合菌檢測(cè)具有較高的靈敏度,也可能導(dǎo)致與培養(yǎng)法結(jié)果不一致的情況,對(duì)于不一致的結(jié)果,還需要進(jìn)一步加強(qiáng)臨床符合率調(diào)查。本研究對(duì)不同類(lèi)型臨床標(biāo)本的檢測(cè)數(shù)量還不夠充足,在后續(xù)的研究中,會(huì)進(jìn)行更大規(guī)模的測(cè)試,篩選出不同標(biāo)本類(lèi)型的常見(jiàn)菌譜,設(shè)計(jì)并建立針對(duì)不同類(lèi)型標(biāo)本的多重PCR檢測(cè)體系,評(píng)價(jià)其檢測(cè)性能,以進(jìn)一步評(píng)估和優(yōu)化本方法。
 國(guó)際檢驗(yàn)醫(yī)學(xué)雜志2024年5期
國(guó)際檢驗(yàn)醫(yī)學(xué)雜志2024年5期
- 國(guó)際檢驗(yàn)醫(yī)學(xué)雜志的其它文章
- 游離DNA甲基化在非腫瘤性疾病中的應(yīng)用研究進(jìn)展
- LINC_00355通過(guò)miR-15a-5p調(diào)節(jié)PHF19在肺癌侵襲轉(zhuǎn)移中的作用機(jī)制研究
- 再生障礙性貧血患者外周血miR-155-5p、miR-1260b水平及臨床意義
- HPV DNA負(fù)荷量、輔助性T細(xì)胞17、FoxP3+調(diào)節(jié)性T細(xì)胞及炎癥因子與高危型HPV感染的相關(guān)性分析
- 膀胱癌患者血清miR-124、miR-320a水平與臨床病理特征及生存預(yù)后的關(guān)系
- BRAF、TP53、Pax8-PPARγ在甲狀腺癌中的表達(dá)及療效預(yù)測(cè)價(jià)值
