HPV DNA負荷量、輔助性T細胞17、FoxP3+調節(jié)性T細胞及炎癥因子與高危型HPV感染的相關性分析
吳淑霞,李金珠,劉迎光
濰坊醫(yī)學院附屬濟南市第五人民醫(yī)院婦科,山東濟南 250022
人乳頭瘤病毒(HPV)感染是宮頸癌發(fā)生的主要因素,HPV可根據(jù)致病能力差異分為低危型和高危型;多項研究表明,持續(xù)性高危型HPV16/18感染與宮頸病變發(fā)生、進展聯(lián)系密切[1-3]。HPV DNA檢測已由基因分型初篩拓展至更精準的特異性檢驗,但HPV感染并非宮頸病變的唯一原因,宮頸局部免疫微環(huán)境的免疫細胞功能和炎癥反應具有高度組織特異性,可通過免疫應答、免疫逃逸等機制促使高危型HPV持續(xù)感染、宮頸病變程度加重,故備受關注[4-5]。輔助性T細胞17(Th17)屬T淋巴細胞亞群,在腫瘤細胞與機體免疫水平的分析中發(fā)揮重要作用;叉頭狀轉錄因子3陽性(FoxP3+)調節(jié)性T細胞(Treg)參與腫瘤免疫應答整個調控過程,對機體免疫狀態(tài)十分關鍵[6-7]。宮頸灌洗液中炎癥因子表達異常與宮頸菌群及微環(huán)境改變有關,可直觀反映宮頸感染狀態(tài)[8]。本研究分析了HPV DNA負荷量、FoxP3+Treg、Th17及宮頸灌洗液中炎癥因子與高危型HPV感染、宮頸病變的相關性,以期為高危型HPV持續(xù)感染臨床防治提供新的思路。現(xiàn)報道如下。
1 資料與方法
1.1一般資料 將2020年9月至2021年2月本院收治的高危型HPV感染患者100例納入研究作為研究組,進一步將其中50例高危型HPV16/18陽性患者作為HPV16/18組,50例其他12種高危型陽性患者作為其他亞型組(HPV31、33、35、39、45、51、52、56、58、59、66、68亞型中有一個以上為陽性)。研究組納入標準:(1)經病理檢查確診為宮頸上皮內瘤變或宮頸癌且均有高危型HPV感染;(2)自身免疫功能正常;(3)近3個月無抗HPV治療史、性激素用藥史、抗感染治療史;(4)無宮頸手術史、放化療史。排除標準:(1)內分泌異常;(2)處于哺乳、妊娠狀態(tài);(3)伴有結締組織疾病;(4)存在婦科惡性腫瘤病史;(5)蒙特利爾認知評估異常;(6)存在活動性陰道感染;(7)肝腎功能障礙。另外,選取同期健康體檢女性50例作為對照組。研究組和對照組一般資料比較,差異均無統(tǒng)計學意義(P>0.05),具有可比性,見表1。本研究符合《赫爾辛基宣言》要求并經本院倫理委員會審批通過。納入研究者及家屬對本研究知情同意,愿意接受本研究相關檢測。
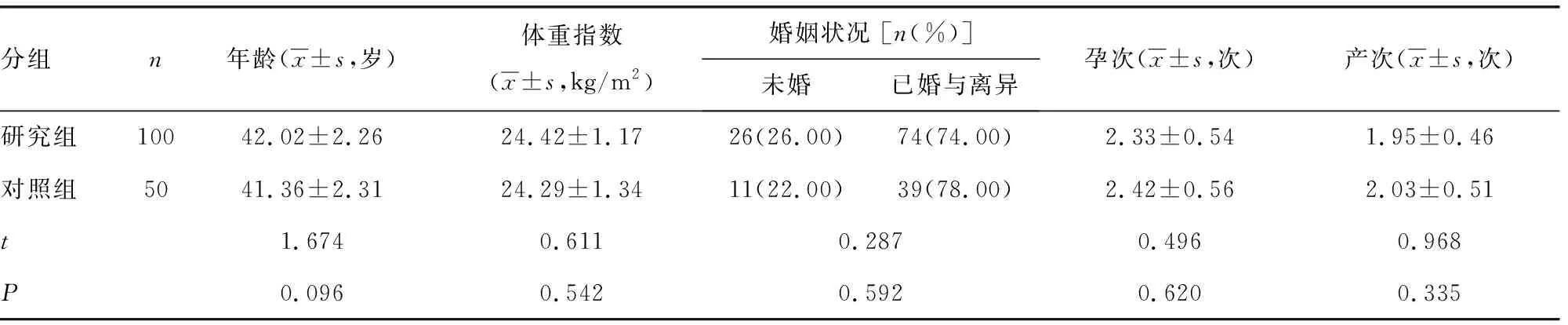
表1 一般資料比較
1.2方法
1.2.1標本采集 檢測標本均于納入研究者經期結束后3 d采集,采用宮頸刷在宮頸口鱗柱交接處逆時針輕微旋轉3圈并停留10 s,收集宮頸脫落細胞,置于細胞保存液中送檢。
1.2.2液基薄層細胞學檢查、HPV檢測 將合格標本采用液基薄層制片儀(愛爾蘭Cellslide系統(tǒng))完成制片,進行巴氏染色后閱片。閱片結果包括以下類型:正常細胞、未確定意義的非典型鱗狀上皮細胞、宮頸上皮內瘤變Ⅰ級、宮頸上皮內瘤變Ⅱ級、宮頸上皮內瘤變Ⅲ級、鱗狀細胞癌。將細胞標本采用蘇州華益美生物科技有限公司生產的HPV核酸分型檢測試劑盒以PCR-熒光法進行檢測,觀察檢測結果,若可見清晰的藍紫色圓點為陽性,否則為陰性;根據(jù)膜條HPV分型分布圖進行亞型區(qū)分。
1.2.3HPV DNA負荷量檢測 無需陰道沖洗,將所收集的合格標本采用HC-Ⅱ雜交捕獲試驗試劑盒(美國Digene公司,第2代)進行HPV DNA負荷量檢測。
1.2.4Th17檢測 采集受試者4 mL肘靜脈血,EDTA抗凝,室溫靜置15 min,離心(1 000 r/min,10 min),取下沉部分的血細胞與磷酸鹽緩沖液(PBS)等比例稀釋,再加入等體積的人淋巴細胞分離液,離心(1 500 r/min,15 min)吸取分層液云霧層,PBS洗滌后采用RPMI-1640培養(yǎng)液吹打混勻,采用流式細胞儀[廠家:艾森生物(杭州)有限公司,型號:NovoCyte D1040]檢測外周血Th17水平。
1.2.5FoxP3+Treg檢測 將100 μL血液標本加入100 μL RPMI-1640培養(yǎng)液稀釋,將其加入96孔平板,使用離子霉素、丙二醇甲醚醋酸酯及莫能霉素工作液進行混合,在CO2培養(yǎng)箱(5%)中培養(yǎng)5 h,棄上清液,加入10 μL CD4 FITC單克隆抗體。在避光狀態(tài)下保存15 min,PBS清洗,加入破膜劑,避光放置15 min,PBS再次清洗,采用流式細胞儀檢測FoxP3+Treg水平。
1.2.6宮頸灌洗液中炎癥因子檢測 采用無菌鹽水(10 mL)注入宮頸后穹窿灌洗(受試者處于非月經期且3 d內無性生活),收集宮頸灌洗液,采用Luminex多重分析檢測宮頸灌洗液中炎癥因子白細胞介素(IL)-10、腫瘤壞死因子α(TNF-α)、IL-17A水平。
1.3觀察指標 (1)比較研究組和對照組HPV DNA負荷量、Th17、FoxP3+Treg及宮頸灌洗液中炎癥因子(IL-10、TNF-α、IL-17A)水平情況。(2)比較HPV16/18組、其他亞型組HPV DNA負荷量、Th17、FoxP3+Treg、炎癥因子水平。(3)比較不同宮頸病變(包括宮頸上皮內瘤變Ⅰ級、宮頸上皮內瘤變Ⅱ級、宮頸上皮內瘤變Ⅲ級、宮頸癌)患者HPV DNA負荷量、FoxP3+Treg、Th17及炎癥因子水平。(4)分析HPV DNA負荷量、FoxP3+Treg、Th17及炎癥因子水平與高危型HPV感染及宮頸病變的相關性。(5)分析HPV DNA負荷量與Th17、FoxP3+Treg及炎癥因子的相關性。(6)分析HPV DNA負荷量、Th17、FoxP3+Treg及炎癥因子對宮頸病變患者高危型HPV16/18陽性的診斷價值。
2 結 果
2.1研究組和對照組HPV DNA、Th17、FoxP3+Treg及炎癥因子水平比較 兩組HPV DNA負荷量、Th17、FoxP3+Treg及宮頸灌洗液中IL-10、TNF-α、IL-17A水平比較,差異均有統(tǒng)計學意義(P<0.05)。見表2。
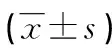
表2 研究組和對照組HPV DNA、Th17、FoxP3+ Treg及炎癥因子水平比較
2.2HPV16/18組、其他亞型組HPV DNA、Th17、FoxP3+Treg、炎癥因子水平比較 HPV16/18組HPV DNA負荷量、Th17、FoxP3+Treg及宮頸灌洗液中IL-10、TNF-α、IL-17A水平均高于其他亞型組(P<0.05),見表3。
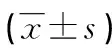
表3 HPV16/18組、其他亞型組HPV DNA、Th17、FoxP3+ Treg、炎癥因子水平比較
2.3不同宮頸病變患者HPV DNA、FoxP3+Treg、Th17及炎癥因子水平 不同宮頸病變患者HPV DNA負荷量、FoxP3+Treg、Th17及宮頸灌洗液中IL-10、TNF-α、IL-17A水平比較,差異均有統(tǒng)計學意義(P<0.05),見表4。
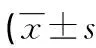
表4 不同宮頸病變患者HPV DNA、FoxP3+ Treg、Th17及炎癥因子水平
2.4HPV DNA、FoxP3+Treg、Th17及炎癥因子水平與高危型HPV感染、宮頸病變的相關性分析 HPV DNA負荷量、FoxP3+Treg、Th17及宮頸灌洗液中IL-10、TNF-α、IL-17A水平與高危型HPV感染分型(HPV16/18=1,其他亞型=2)均呈負相關(P<0.05),與宮頸病變(宮頸上皮內瘤變Ⅰ級=1,宮頸上皮內瘤變Ⅱ級=2,宮頸上皮內瘤變Ⅲ級=3,宮頸癌=4)均呈正相關(P<0.05),見表5。

表5 相關性分析結果
2.5HPV DNA負荷量與Th17、FoxP3+Treg及炎癥因子的相關性分析 HPV DNA負荷量與Th17、FoxP3+Treg及宮頸灌洗液中IL-10、TNF-α、IL-17A水平均呈正相關(r=0.692、0.724、0.605、0.587、0.631,P<0.05)。
2.6HPV DNA負荷量、Th17、FoxP3+Treg及炎癥因子診斷宮頸病變患者高危型HPV16/18陽性的ROC曲線分析 以HPV16/18陽性作為陽性樣本,其他亞型陽性作為陰性樣本,繪制ROC曲線,結果顯示,HPV DNA負荷量、Th17、FoxP3+Treg、IL-10、TNF-α、IL-17A單獨診斷高危型HPV16/18陽性的曲線下面積(AUC)分別為0.704(95%CI:0.604~0.791)、0.732(95%CI:0.634~0.816)、0.773(95%CI:0.679~0.851)、0.781(95%CI:0.687~0.858)、0.741(95%CI:0.644~0.823)、0.795(95%CI:0.703~0.869)。各項指標聯(lián)合診斷高危型HPV16/18陽性的AUC為0.911(95%CI:0.837~0.959),大于各指標單獨診斷(P<0.05),見圖1、2。
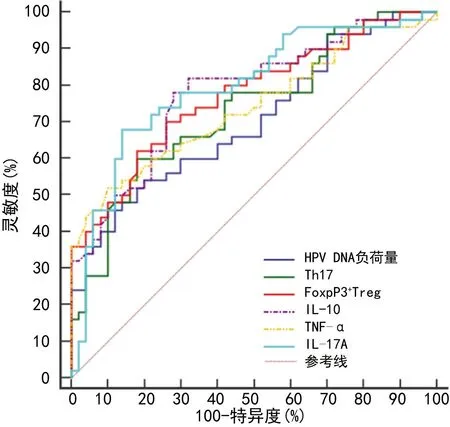
圖1 各指標單獨診斷高危型HPV16/18陽性的ROC曲線
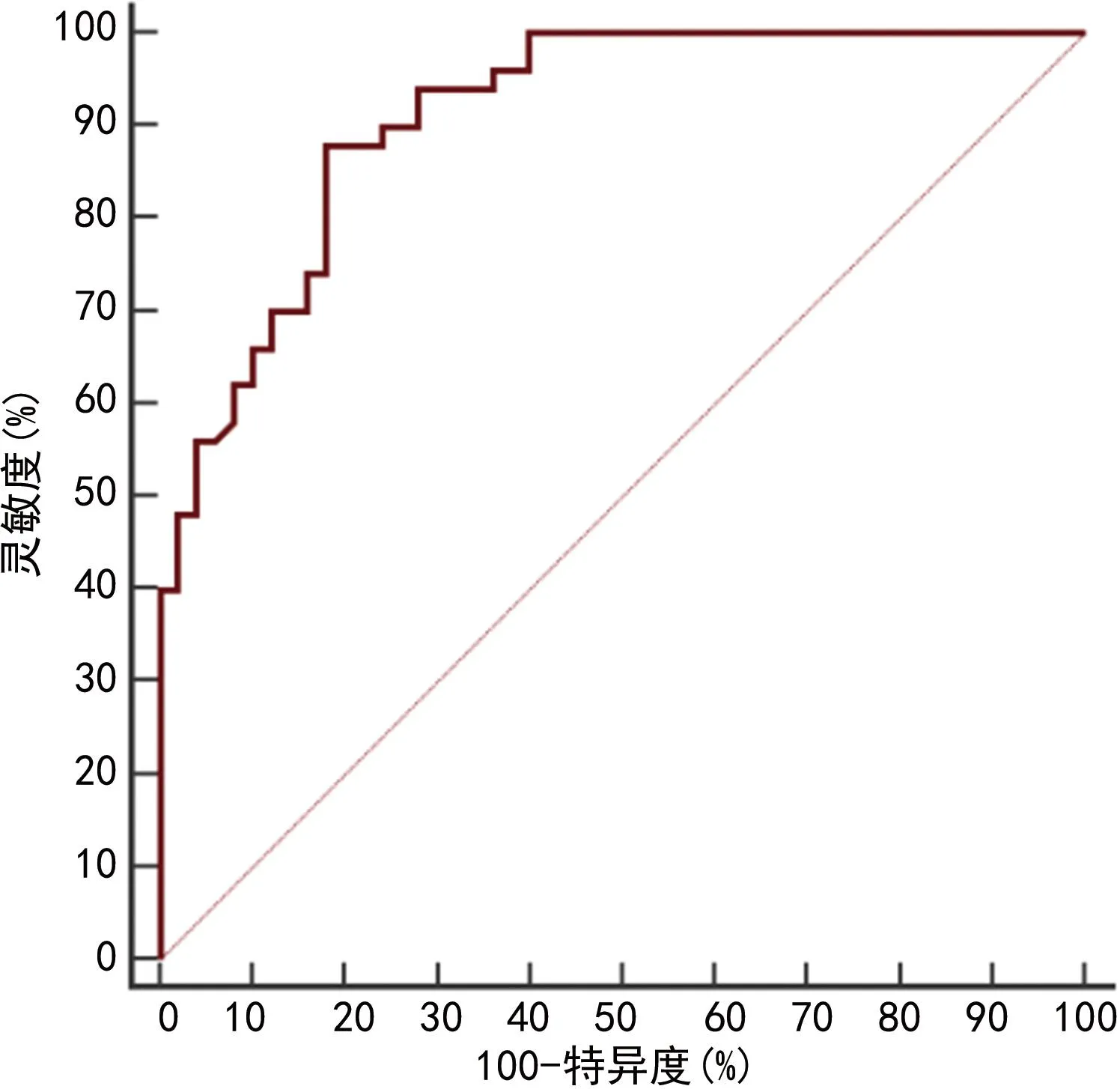
圖2 各指標聯(lián)合診斷高危型HPV16/18陽性的ROC曲線
3 討 論
高危型HPV持續(xù)感染是導致宮頸癌的危險因素,宮頸上皮細胞發(fā)生高危型HPV感染后,HPV遺傳物質進入宿主細胞的基因組DNA,改變癌基因、抑癌基因表達,激活癌細胞生長、侵襲活性,改變免疫調節(jié)基因表達,導致免疫應答紊亂[9-10]。HPV DNA負荷量與宮頸癌、宮頸病變程度的關系尚不十分明確,武振宇等[11]研究顯示,HPV DNA單獨檢測用于宮頸癌診斷的特異度、陽性預測值不足,需HPVE6/E7 mRNA檢測輔助診斷。本研究結果顯示,HPV DNA負荷量、FoxP3+Treg、Th17及炎癥因子水平隨宮頸病變程度加深而升高。分析原因:高危型HPV持續(xù)感染影響機體免疫耐受,Th17/Treg介導的免疫應答失衡是宮頸病變患者體內重要特征[12]。Treg作為輔助性T細胞亞群發(fā)揮機體免疫抑制功能,叉頭狀轉錄因子3(FoxP3)是Treg的特征性分子標志,廣泛存在于細胞生物中,參與FoxP3+Treg新陳代謝[13-14]。既往研究證實,Treg與多種急慢性病毒感染、腫瘤疾病有關,FoxP3+Treg水平在非小細胞肺癌、乳腺癌、肝細胞癌患者中明顯上升[15-17]。有報道指出,Treg可通過抑制T細胞殺傷作用或抑制抗體產生等協(xié)助腫瘤免疫逃逸[18]。HPV感染早期,FoxP3+Treg在宮頸病變進展的免疫調節(jié)、免疫逃避機制中發(fā)揮重要作用[19]。FoxP3+Treg水平升高表示病毒在免疫系統(tǒng)中的逃逸風險升高,可一定程度反映患者預后,對監(jiān)測腫瘤進展具有指導意義。
陳國艷等[20]的研究表明,宮頸病變患者外周血Th17水平與HPV感染有關,可影響疾病進展。Th17與Treg有同源性,Th17分泌的IL-17可促使癌細胞侵襲,Treg分泌的轉化生長因子-β1可以導致抗腫瘤免疫耐受,增加癌細胞免疫逃逸機會[21]。研究組HPV DNA負荷量、Th17、FoxP3+Treg及宮頸灌洗液中IL-10、TNF-α、IL-17A水平均高于對照組,HPV16/18組各項指標水平均高于其他亞型組,表明HPV DNA負荷量、Th17、FoxP3+Treg及炎癥因子共同參與了HPV感染發(fā)生、進展,影響高危型HPV持續(xù)感染情況,分析可能與Th17、FoxP3+Treg異常表達打破機體免疫功能平衡有關。正常狀態(tài)下Th17、Treg在分化過程中互相影響、共同保持平衡,維持生殖道微生態(tài)環(huán)境穩(wěn)態(tài);在宮頸病變過程中,二者平衡被打破,引起免疫功能紊亂[22]。另一方面,局部病灶部位炎癥級聯(lián)反應也可上調Treg水平,導致機體免疫系統(tǒng)紊亂,減弱機體對HPV的殺傷能力,增大持續(xù)感染風險[23]。
本研究分析了FoxP3+Treg、Th17及宮頸灌洗液中炎癥因子水平分別與HPV感染、宮頸病變的相關性,發(fā)現(xiàn)HPV DNA負荷量、FoxP3+Treg、Th17及炎癥因子水平與高危型HPV感染分型相關,與宮頸病變類型相關,而且HPV DNA負荷量與Th17、FoxP3+Treg及炎癥因子水平呈正相關。ROC分析顯示,HPV DNA負荷量、Th17、FoxP3+Treg及宮頸灌洗液中炎癥因子對宮頸病變患者高危型HPV16/18感染的診斷價值較高,而且聯(lián)合預測的AUC達0.911,進一步證實高危型HPV16/18感染與上述指標介導的免疫功能紊亂密切相關,臨床可通過檢測各項指標來預測、評估宮頸病變患者高危型HPV16/18持續(xù)感染情況。
綜上所述,HPV DNA、Th17、FoxP3+Treg及炎癥因子表達與高危型HPV感染分型、宮頸病變聯(lián)系密切,HPV DNA負荷量與Th17、FoxP3+Treg、炎癥因子具有相關性,各項指標聯(lián)合檢測有利于臨床篩查宮頸惡性病變高危患者、防治高危型HPV持續(xù)感染,對改善患者預后具有指導意義。

