BRAF、TP53、Pax8-PPARγ在甲狀腺癌中的表達及療效預測價值
蘇鎮軍,趙艷春,李 娟,國方娜,溫麗莎
河北工程大學附屬醫院核醫學科,河北邯鄲 056002
甲狀腺癌平均年增長率約6.6%,現已躍居為發病率升高最快的實體腫瘤[1]。手術聯合131I是目前治療甲狀腺癌重要手段,可有效延緩病情進展,但其療效具有較明顯個體差異性,部分患者易出現復發、轉移,甚至死亡。基因突變、異位及甲基化可刺激腫瘤相關信號通路,誘發甲狀腺癌細胞癌變[2-3]。絲氨酸/蘇氨酸蛋白激酶(BRAF)可通過刺激BRAF/MEK/ERK信號轉導通路參與腫瘤形成,僅在甲狀腺癌與甲狀腺癌起源的未分化癌中發生突變[4]。腫瘤蛋白P53(TP53)突變影響細胞生長、凋亡、DNA修復,促進腫瘤形成,在甲狀腺癌發生、發展中扮演重要角色[5]。配對盒基因8-過氧化物酶體增殖物激活受體γ(Pax8-PPARγ)是配對盒基因編碼區染色體2q13斷裂點與過氧化物酶體增殖物激活受體γ編碼區3q13斷裂處融合形成新基因,在甲狀腺良惡性結節中均有表達,但關于其在甲狀腺癌鑒別及療效評估中研究報道較少[6]。本研究擬分析TP53、BRAF、Pax8-PPARγ在甲狀腺癌中的表達及131I治療中的價值,以期為臨床確定合理診治方案提供參考,現報道如下。
1 資料與方法
1.1一般資料 將2020年4月至2022年4月本院收治的150例甲狀腺癌患者納入研究,男52例,女98例,年齡20~65歲,平均(49.92±4.41)歲。納入標準:(1)符合甲狀腺癌診斷標準[7],結合細胞病理學檢查證實為甲狀腺乳頭狀癌(甲狀腺惡性腫瘤中最常見的病理類型);(2)行甲狀腺癌根治術且于術后擬行首次131I治療。排除標準:(1)患其他惡性腫瘤;(2)有其他甲狀腺疾病;(3)有嚴重心腦血管疾病;(4)有凝血功能障礙;(5)臨床資料缺失。患者及家屬均對本研究知情同意并簽署知情同意書。本研究經醫院倫理委員會審核批準。
1.2方法
1.2.1組織TP53、BRAF、Pax8-PPARγ表達水平檢測 取甲狀腺癌組織及癌旁組織約30 mg,采用Trizol法提取總RNA,反轉錄為cDNA,采用SYBR Green Ⅰ染料行實時熒光定量PCR(qPCR)擴增反應。TP53引物序列為F:5′-TTGCCGTCCCAAGCAATGGATGA-3′,R:5′-TCTGGGAAGGGACA GAAGATGAC-3′;擴增程序為95 ℃ 5 min,95 ℃ 30 s、53 ℃ 30 s、72 ℃ 30 s,共35個循環。BRAF引物序列為F:5′-TCATAATGCTTGCTCTGATAGGA-3′,R:5′-GGCCAAAAATTTAATCAGTGGA-3′;擴增程序為95 ℃ 10 min,95 ℃ 30 s、56 ℃退火30 s、72 ℃ 45 s,共38個循環。Pax8-PPARγ引物序列為F:5′-GTCCGGACTCAGATCTCGAGCTATGCCTCAACAACTCCATCAG-3′,R:5′-GATCCCGGG CCCGCGGTACCGTACAAGTCCTTGTAGATCTC CTG-3′;擴增程序為95 ℃ 10 min,94 ℃ 30 s、55 ℃ 30 s、72 ℃ 60 s 共30個循環。U6為內參基因,反轉錄引物序列為5′-CGCTTCACGAATTTGCGTGTCAT-3′。PCR引物序列為F:5′-GCTTCGGCAGCACATATACTAAAAT-3′,R:5′-CGCTTC ACGAATTTGCGTGTCAT-3′。采用2-ΔΔCt法計算TP53、BRAF、Pax8-PPARγ的相對表達水平。Trizol試劑盒由美國Invitrogen公司提供。qPCR檢測試劑盒及TP53、BRAF、Pax8-PPARγ引物由廣州復能基因有限公司提供。7500熒光定量PCR儀由美國ABI公司提供。
1.2.2采用放射性131Ⅰ清除術后殘留的正常甲狀腺組織(簡稱清甲) 治療前,停服甲狀腺激素、低碘飲食4周,待促甲狀腺激素(TSH)>30 μIU/mL接受首次131I治療。術后4周,口服131I(安盛科興藥業有限公司,國藥準字H20057721),劑量(350~650)×1010Bq,治療7 d后服用左甲狀腺素鈉片(德國默克公司,國藥準字H20090234),100 mg/d,結合血漿TSH調整服藥劑量,確保臨床分期Ⅰ期患者TSH始終低于0.10 mol/L,Ⅱ、Ⅲ期患者TSH維持在0.05~0.10 mol/L。
1.2.3首次清甲成功標準 首次131I治療后1周進行全身碘掃描及局部斷層融合顯像檢查,無甲狀腺殘留或放射性濃聚。
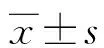
2 結 果
2.1甲狀腺癌及癌旁組織TP53、BRAF、Pax8-PPARγ mRNA表達水平比較 甲狀腺癌組織TP53、BRAF、Pax8-PPARγ mRNA表達水平高于癌旁組織,差異均有統計學意義(P<0.05)。見表1。
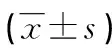
表1 甲狀腺癌及癌旁組織TP53、BRAF、Pax8-PPARγ mRNA相對表達水平比較
2.2甲狀腺癌患者臨床病理因素與TP53、BRAF、Pax8-PPARγ mRNA表達水平的關系 甲狀腺癌患者淋巴結轉移、腫瘤最大徑、包膜浸潤均與TP53、BRAF、Pax8-PPARγ mRNA表達水平有關(P<0.05)。見表2。
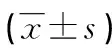
表2 甲狀腺癌患者臨床病理因素與TP53、BRAF、Pax8-PPARγ mRNA表達水平的關系
2.3清甲成功和失敗患者TP53、BRAF、Pax8-PPARγ mRNA表達水平比較 甲狀腺癌患者經首次131I治療后,61例清甲失敗,89例清甲成功。清甲失敗患者組織TP53、BRAF、Pax8-PPARγ mRNA表達水平均高于清甲成功患者(P<0.05)。見表3。
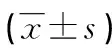
表3 清甲成功和失敗患者組織TP53、BRAF、Pax8-PPARγ mRNA相對表達水平比較
2.4ROC曲線分析 將甲狀腺癌患者131I治療的效果作為狀態變量(1=清甲失敗,0=清甲成功),組織TP53、BRAF、Pax8-PPARγ mRNA表達水平作為檢驗變量,繪制ROC曲線,結果顯示TP53 mRNA、BRAF mRNA、Pax8-PPARγ mRNA、三者聯合預測甲狀腺癌患者清甲失敗的AUC分別為0.726(95%CI:0.647~0.796)、0.822(95%CI:0.752~0.880)、0.743(95%CI:0.666~0.811)、0.916(95%CI:0.860~0.955),其中三者聯合的預測價值最高(P<0.05)。見圖1。
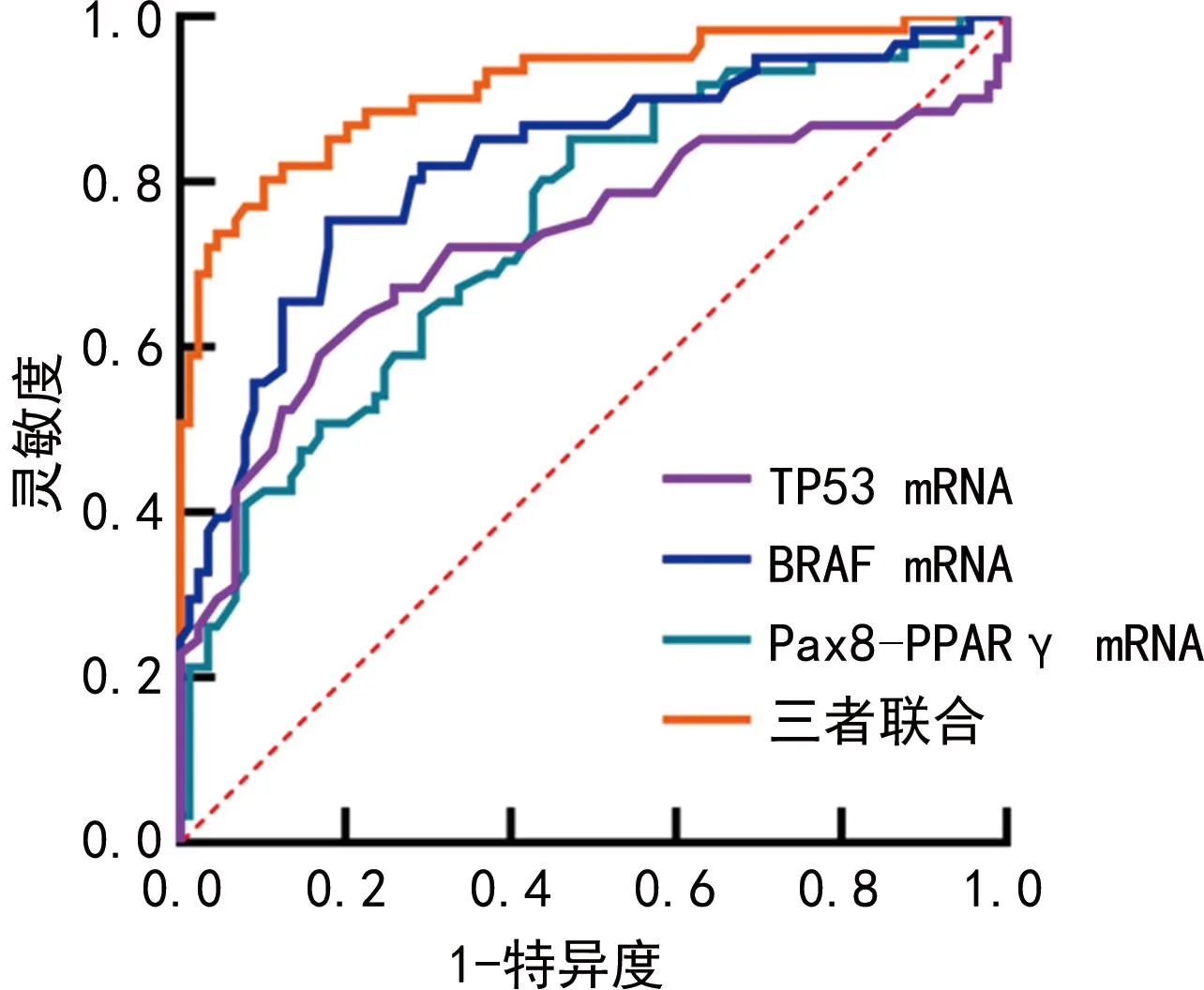
圖1 TP53 mRNA、BRAF mRNA、Pax8-PPARγ mRNA單獨及聯合預測甲狀腺癌患者清甲失敗的ROC曲線
2.5決策曲線分析 以凈收益率為縱坐標,高風險閾值為橫坐標,繪制決策曲線,當高風險閾值為0.2~0.9時,三者聯合預測甲狀腺癌清甲失敗的凈收益率優于TP53、BRAF、Pax8-PPARγ(P<0.05)。見圖2。
3 討 論
甲狀腺腫瘤分子病理學研究取得較大進展,多分子聯合檢測可在超聲引導下細針穿刺細胞學基礎上準確劃分結節惡性風險,提高甲狀腺癌診斷效能,有助于患者預后的改善。Pax8-PPARγ、BRAF、TP53均為甲狀腺腫瘤分子病理學研究的熱點分子,但上述分子與甲狀腺癌療效的關系研究較少。
Pax8-PPARγ是配對盒基因8(Pax8)與過氧化物酶體增殖物激活受體γ(PPARγ)基因重排融合結果,其中Pax8可通過調控甲狀腺球蛋白、甲狀腺過氧化物酶表達促進甲狀腺細胞分化。PPARγ可調控細胞增殖分化、促細胞凋亡及腫瘤形成,在甲狀腺細胞生長、分化、轉錄過程中發揮關鍵作用。盡管目前已有Pax8-PPARγ在甲狀腺癌中的研究[8],但關于其致癌作用機制尚未完全闡明,本研究發現甲狀腺癌組織中Pax8-PPARγ mRNA表達水平高于癌旁組織,Pax8-PPARγ可抑制PPARγ被噻唑烷二酮激活,參與細胞周期調控,增強細胞增殖能力,干擾細胞正常分化,抑制甲狀腺特異性基因表達[9]。本研究發現Pax8-PPARγ與淋巴結轉移、腫瘤最大徑、包膜浸潤有關,說明該融合基因表達的患者甲狀腺癌惡性程度高,更易出現淋巴結轉移、包膜浸潤,但上述結果與陳慶毫等[10]的研究結果存在一定差異,考慮與患者異質性、病例數量較少有關,具體原因及機制有待后續研究。既往研究顯示,Pax8過表達可抑制甲狀腺癌細胞增殖,促進鈉/碘轉運(NIS)蛋白表達,增強攝碘能力,改善其預后[11]。然而本研究結果顯示,清甲失敗患者Pax8-PPARγ表達水平高于清甲成功患者,與上述觀點相悖,推測原因:Pax8-PPARγ融合基因可影響Pax8、PPARγ功能,隨著其表達增加,可促進腫瘤細胞增殖分化,抑制NIS蛋白表達,降低攝碘能力及131I治療效果。ROC曲線分析顯示,Pax8-PPARγ預測甲狀腺癌清甲失敗AUC為0.743,說明Pax8-PPARγ或許不能作為臨床實際工作中的單一預測因子,建議與其他指標聯合應用。
BRAF屬于特異性較強甲狀腺癌基因,BRAF基因突變是甲狀腺癌常見基因突變,以第15位外顯子上單個堿基因錯義突變為主,可引起翻譯蛋白600位密碼子所對應的纈氨酸由谷氨酸代替,生成活化蛋白激酶,促進甲狀腺癌發病[12-13]。動物實驗表明,BRAF基因突變可介導小鼠甲狀腺細胞轉化,誘發甲狀腺癌[14]。本研究結果顯示,甲狀腺癌組織BRAF mRNA表達水平高于癌旁組織,而且與淋巴結轉移、腫瘤最大徑、包膜浸潤密切有關,表明BRAF參與甲狀腺癌發生、發展,其過表達可增加酶活性,刺激下游信號通路,促使腫瘤細胞過度增殖、分化,最終導致腫瘤癌變[15]。本研究還發現,清甲失敗患者BRAF mRNA水平高于清甲成功患者,其預測甲狀腺癌患者清甲失敗的AUC為0.822,可為臨床學者評估甲狀腺癌131I治療效果提供有利參考依據,有助于后續治療方案的調整。
TP53突變是指該基因第72位密碼存在G/C多態性。既往的研究探討了TP53基因突變與甲狀腺癌關系,但研究結果極具爭議性,有學者認為TP53基因突變與甲狀腺癌無關[16],有學者則認為TP53基因Arg72Pro位點突變與甲狀腺癌密切相關[17],特別是在亞洲人群中。在此背景下,本研究分析了TP53在甲狀腺癌患者中的表達,發現甲狀腺癌組織TP53 mRNA表達水平高于癌旁組織,其表達水平與包膜浸潤、腫瘤最大徑等有關。分析原因:TP53基因突變可刺激Wnt-5α信號轉導通路,引起細胞增殖特征性變化,進而出現增殖失控,促進腫瘤發生、發展,積極有效治療顯得十分重要[18]。有研究表明,甲狀腺癌患者預后大多良好,但仍有10%~15%患者復發,約5%患者對131I治療無反應,最終死亡[19]。本研究探討了TP53與甲狀腺癌131I治療效果關系,發現TP53 mRNA預測甲狀腺癌患者清甲失敗的AUC僅為0.726,可見TP53單獨預測甲狀腺癌131I治療效果的價值有限。
由于TP53、BRAF、Pax8-PPARγ mRAN單獨預測甲狀腺癌131I療效的價值不高,本研究采用三者聯合預測甲狀腺癌患者清甲失敗的價值,AUC高達0.916,接近于1,提示三者聯合預測效能好,可為本病療效評估提供參考。然而ROC曲線著重關注各檢測指標的靈敏度、特異度,針對低靈敏度、高特異度指標,雖具有較大AUC,但在早期篩查中可能會出現假陰性,無法直接代表臨床患者受益[20-21]。因此,本研究引入決策曲線,發現三者聯合預測甲狀腺癌清甲失敗發生的凈收益率優于單獨預測,后續治療中可通過檢測TP53、BRAF、Pax8-PPARγ mRAN表達來預測清甲失敗風險,結合具體情況加強治療強度,提高131I治療效果。
綜上所述,TP53、BRAF、Pax8-PPARγ在甲狀腺癌組織中呈高表達,聯合檢測有助于預測131I治療效果,為臨床確定合理治療方案及時機提供參考。受限于臨床實際,本研究病例源自同一家醫院,病例數少,同時三者均突變是否會造成更差預后尚不得知,日后仍需開展多中心、大樣本的前瞻性研究。

