LINC_00355通過miR-15a-5p調節(jié)PHF19在肺癌侵襲轉移中的作用機制研究
徐柯楠,劉 靜,夏 麗,周 平,楊海龍
衡水市人民醫(yī)院胸外科,河北衡水 053000
非小細胞肺癌(NSCLC)是導致肺癌的主要危險因素,數(shù)據(jù)顯示其發(fā)病率為80%至85%,是全球癌癥相關死亡的主要原因之一[1]。手術、化療、放療是NSCLC治療的常規(guī)方式。由于耐藥和腫瘤轉移,NSCLC患者的5年生存率仍然很低,尤其是晚期患者[2-3]。雖然NSCLC的診斷和治療取得了很大進展,但預后仍然較差。因此,需要確定有效的生物標志物來預測NSCLC的進展和預后,從而推動其他靶向治療的進展。長鏈非編碼RNA(lncRNA)是一種長度超過200 nt的非編碼RNA。lncRNA在癌癥的發(fā)展過程中充當腫瘤誘導劑或抑制劑,已發(fā)現(xiàn)LINC_00355在膀胱移行細胞癌中高表達[4],LINC_00355參與競爭性內源性RNA(ceRNA)網(wǎng)絡的調控,并在結直腸癌的多個病理階段差異表達,先前的研究結果表明LINC_00355在癌癥發(fā)展中起著至關重要的作用[5]。然而,LINC_00355是否在肺癌的發(fā)展中發(fā)揮作用仍然未知。lncRNA可以通過競爭性結合microRNA(miRNA)來調控靶基因的表達,研究發(fā)現(xiàn)發(fā)現(xiàn)LINC_00355在肝癌中高表達,LINC_00355通過與miR-195競爭性結合促進肝癌細胞增殖和集落形成,抑制細胞周期停滯和凋亡[6-7];LINC_00355作為miR-195海綿通過增加同源框A10表達來增強頭頸部鱗狀細胞癌(HNSCC)細胞的活力、侵襲、遷移和抑制細胞凋亡[8]。本研究擬探討lncRNALINC_00355在肺癌中的作用,探索LINC_00355通過調節(jié)miRNA/mRNA軸參與肺癌的發(fā)展的機制,以期為肺癌的發(fā)病機制提供理論依據(jù)。
1 材料與方法
1.1細胞來源 人NSCLC細胞系A549購自美國典型培養(yǎng)物保藏中心(ATCC)。
1.2儀器與試劑 MTT溶液(默克公司),Annexin V-FITC,碘化丙啶(BioLegend公司),PYr-MirTarget螢光素酶載體(Ambion公司),小鼠單克隆抗人PHF19(1∶1 000,Santa Cruz公司),小鼠單克隆抗人GAPDH(1∶5 000,Santa Cruz公司),HRP綴合的山羊抗小鼠IgG(1∶5 000,Santa Cruz公司),轉染試劑HiPerFect Transfection Reagent(Qiagen公司),實時熒光定量PCR(qPCR)檢測試劑購自BioRad公司。由上海吉瑪制藥技術有限公司設計和合成引物。FACScan流式細胞儀(美國BD公司),Eclipse Ti-U倒置顯微鏡(日本奧林巴斯公司),NanoDrop紫外分光光度計(Thermo Scientific公司),Realplex4 Mastercycler PCR儀(Eppendorf公司),BioRad成像系統(tǒng)(BioRad公司)。
1.3.1細胞培養(yǎng) 所有細胞均在添加了10%胎牛血清(FBS)的Dulbecco改良Eagle培養(yǎng)基中培養(yǎng),培養(yǎng)環(huán)境為37 ℃、5%CO2,根據(jù)細胞的生長速度,使用胰蛋白酶-EDTA進行細胞消化后傳代。
1.3.2細胞分組及處理 將細胞分為A549肺癌細胞組、lncRNA-NC組、LINC_00355 mimics組、LINC_00355 inhibitor組,進行不同處理后用于后續(xù)實驗。A549肺癌細胞組:不進行任何處理;lncRNA-NC組:加入空白載體;LINC_00355 mimics組:加入LINC_00355過表達載體;LINC_00355 inhibitor組:加入LINC_00355低表達載體。A549細胞用于轉染時,按照試劑說明書使用轉染試劑進行瞬時轉染。使用qPCR評估轉染效率,轉染72 h后采用qPCR檢測LINC_00355表達,各組設6個平行檢測標本,培養(yǎng)72 h。
1.3.3肺癌細胞A549細胞活力的MTT法檢測及癌細胞單克隆形成數(shù)檢測 轉染72 h后使用MTT分析細胞細胞活力。將細胞以每孔3 000個細胞的密度接種在96孔板中。維持72 h后,每孔加入20 μL MTT,37 ℃ 孵育4 h。然后,去除培養(yǎng)基,每孔加入150 μL二甲基亞砜(DMSO),搖勻后,使用多孔板讀數(shù)器在490 nm處測量吸光度(A)值。每個實驗一式3份進行5次重復,并計算平均值作為最終結果。測量每個孔的A值。將各組肺癌細胞A549用0.25%胰蛋白酶消化成單細胞,并以4×105細胞個細胞/孔的密度接種到6孔培養(yǎng)板中,24 h后,將50個細胞接種于6孔組織培養(yǎng)板中,繼續(xù)培養(yǎng)2周。然后將細胞用結晶紫-福爾馬林溶液染色10 min并計數(shù)。
1.3.4肺癌細胞A549凋亡率測定 轉染72 h后收獲細胞,將細胞置于6孔板中,密度為4×105個細胞/孔,AnnexinV-FITC(5 μL)和碘化丙啶(PI,10 μL) 處理,采用流式細胞儀進行檢測,計算凋亡細胞的百分率。
1.3.5肺癌細胞A549侵襲遷移水平測定 使用包含聚碳酸酯膜的Boyden室進行侵襲測定。培養(yǎng)結束細胞重懸于無血清培養(yǎng)基中,在6孔板(5×104)中孵育24 h(孵育后細胞第2天用一層培養(yǎng)板覆蓋)。在室溫下孵育24 h后,用200 μL無菌移液器吸頭刮擦細胞并用PBS洗滌3次。觀察細胞遷移,并使用光學顯微鏡拍攝圖像。
1.3.6螢光素酶報告基因檢測 通過生物信息學網(wǎng)站(www.Targetscan.org)檢索,初步確定LINC_00355與miR-15a-5p,miR-15a-5p與PHF19是否有潛在的結合位點。為了構建螢光素酶報告載體,通過PCR擴增含有預測的潛在LINC_00355結合位點的miR-15a-5p cDNA片段的3′-UTR,并亞克隆到PYr-MirTarget螢光素酶載體中的螢光素酶基因的下游。螢光素酶活性測定:A549細胞在24孔板中培養(yǎng),與50 ng含有螢火蟲螢光素酶的相應載體以及25 ng LINC_00355或對照共轉染。使用Lipofectamine?2000試劑進行轉染。在轉染后48 h,使用雙螢光素酶報告分析系統(tǒng)計算螢光素酶相對活性。
1.3.7雙螢光素酶報告基因系統(tǒng)驗證靶向調節(jié)作用 使用在線StarBase軟件(http://starbase.sysu.edu.cn/)預測PHF19的miR-15a-5p 3′UTR區(qū)域的結合位點。使用Lipofectamine 2000試劑將上述載體共轉染到細胞中。轉染24 h后,使用雙螢光素酶報告基因系統(tǒng)檢測螢光素酶活性,以驗證PHF19和miR-15a-5p 3′UTR區(qū)域的結合位點。
1.3.8肺癌細胞A549 LINC_00355、miR-15a-5p、PHF19 mRNA表達水平檢測 使用TRIzol試劑分離總RNA,進行反轉錄。使用SYBR?Green Ⅰ Supermix在20 μL的最終反應體積中進行qPCR。所有檢測均在iCycler IQ多色檢測系統(tǒng)上運行3次,循環(huán)參數(shù)如下:95 ℃ 10 s,然后94 ℃ 15 s,55 ℃ 30 s,最后70 ℃ 延伸30 s,40個循環(huán)。PCR反應體系:5 μL SsoFast EvaGreen Supermix、0.5 μL正向引物(10 μmol/L)、0.5 μL 反向引物(10 μmol/L)和4 μL cDNA。所有定量都以人GAPDH為內參。采用2-ΔΔCt法計算相對表達水平。
在冬小麥的全生育期間,平均氣溫偏高一點,其降水量也比較多,雨水的分布比較集中。在冬小麥的種植期間,其平均氣溫為8.3℃,比常年高0.5℃;降水量為243.4 mm,比常年多3.8 mm;日照的時間為2531 h,比去年少126 h。在這期間其極端最高氣溫為35.7℃,出現(xiàn)在7月19日,極端最低氣溫為-15.7℃,出現(xiàn)在12月31日。
1.3.9肺癌細胞A549 PHF19蛋白表達水平檢測 使用含有蛋白酶抑制劑的RIPA裂解緩沖液從細胞中提取蛋白質,使用BCA蛋白質測定試劑盒測定蛋白質濃度,使用10% SDS-PAGE凝膠分離等量的蛋白質裂解物(每條泳道20 μg),然后電印跡轉移到硝酸纖維素膜上,用含有0.1% Tween-20的Tris緩沖鹽水中的5%脫脂奶粉封閉膜2 h,并與以下一抗在4 ℃下孵育過夜:小鼠單克隆抗人PHF19抗體(1∶1 000)、小鼠單克隆抗人GAPDH抗體(1∶5 000)。GAPDH用作蛋白質上樣的內部對照,將膜與HRP結合的山羊抗小鼠IgG(1∶5 000)在室溫下進一步孵育1 h,通過ECL試劑盒檢測免疫復合物,條帶的整合密度由 Quantity One 軟件 (Bio-Rad) 量化。
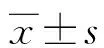
2 結 果
2.1各組細胞A值、存活率比較 與A549肺癌細胞組、lncRNA-NC組比較,LINC_00355 mimics組A值、存活率升高(P<0.05),LINC_00355 inhibitor組A值、存活率降低(P<0.05);與LINC_00355 mimics組比較,LINC_00355 inhibitor組A值、存活率降低(P<0.05)。見表1。
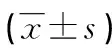
表1 各組細胞A值、存活率比較
2.2各組細胞單克隆形成數(shù)的比較 與A549肺癌細胞組、lncRNA-NC組比較,LINC_00355 mimics組單克隆形成數(shù)增加(P<0.05),LINC_00355 inhibitor組單克隆形成數(shù)減少(P<0.05);與LINC_00355 mimics組比較,LINC_00355 inhibitor組單克隆形成數(shù)減少(P<0.05)。見表2。

表2 各組細胞單克隆形成數(shù)的比較個)
2.3各組細胞凋亡率比較 與A549肺癌細胞組、lncRNA-NC組比較,LINC_00355 mimics組細胞凋亡率降低(P<0.05),LINC_00355 inhibitor組細胞凋亡率升高(P<0.05);與LINC_00355 mimics組比較,LINC_00355 inhibitor組細胞凋亡率升高(P<0.05)。見表3、圖1。
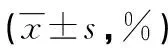
表3 各組細胞凋亡率比較
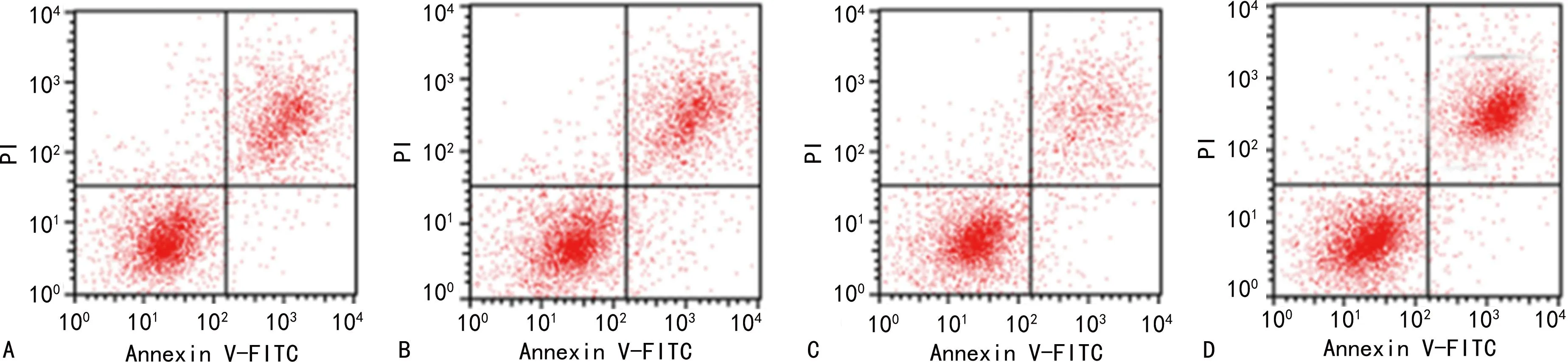
注:A為A549肺癌細胞組;B為lncRNA-NC組;C為LINC_00355 mimics組;D為LINC_00355 inhibitor組。
2.4各組細胞侵襲能力比較 與A549肺癌細胞組、lncRNA-NC組比較,LINC_00355 mimics組穿膜數(shù)增加(P<0.05),LINC_00355 inhibitor組穿膜數(shù)減少(P<0.05);與LINC_00355 mimics組比較,LINC_00355 inhibitor組穿膜數(shù)減少(P<0.05)。見表4、圖2。

表4 各組A549肺癌細胞穿膜數(shù)的比較個)

注:A為A549肺癌細胞組;B為lncRNA-NC組;C為LINC_00355 mimics組;D為LINC_00355 inhibitor組。
2.5各組細胞遷移能力比較 與A549肺癌細胞組、lncRNA-NC組比較,LINC_00355 mimics組遷移距離增加(P<0.05),LINC_00355 inhibitor組遷移距離縮短(P<0.05);與LINC_00355 mimics組比較,LINC_00355 inhibitor組遷移距離縮短(P<0.05)。見表5、圖3。
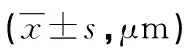
表5 各組A549肺癌細胞遷移能力的比較

注:A為A549肺癌細胞組;B為lncRNA-NC組;C為LINC_00355 mimics組;D為LINC_00355 inhibitor組。
2.6LINC_00355對miR-15a-5p的靶向調節(jié)作用 通過生物信息學網(wǎng)站(www.Targetscan.org)檢索發(fā)現(xiàn),LINC_00355與miR-15a-5p有潛在的結合位點;螢光素酶報告基因實驗顯示,LINC_00355過表達可降低miR-15a-5p-wt(wt表示野生型)的熒光素酶活性(P<0.05),LINC_00355低表達可提高miR-15a-5p-wt的熒光素酶活性(P<0.05);LINC_00355過表達或低表達對miR-15a-5p-mut(mut表示突變型)均無有影響,差異均無統(tǒng)計學意義(P>0.05)。表明LINC_00355與miR-15a-5p存在靶向調節(jié)作用。見表6、圖4。
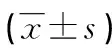
表6 螢光素酶報告基因實驗驗證LINC_00355對miR-15a-5p的靶向調節(jié)作用

圖4 Targetscan網(wǎng)站預測LINC_00355與miR-15a-5p的互補配對序列
2.7miR-15a-5p對PHF19的靶向調節(jié)作用 通過生物信息學網(wǎng)站(www.Targetscan.org)檢索發(fā)現(xiàn),miR-15a-5p與PHF19有潛在的結合位點;螢光素酶報告基因實驗顯示,miR-15a-5p過表達可降低PHF19-wt的熒光素酶活性(P<0.05),miR-15a-5p低表達可明顯提升PHF19-wt的熒光素酶活性(P<0.05);miR-15a-5p過表達或低表達對PHF19-mut沒有影響,差異無統(tǒng)計學意義(P<0.05)。表明miR-27a-3p與PHF19存在靶向調節(jié)作用。見表7、圖5。
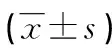
表7 螢光素酶報告基因實驗驗證miR-15a-5p對PHF19的靶向調節(jié)作用

圖5 Targetscan預測miR-15a-5p與PHF19 mRNA>的互補配對系列
2.8各組A549肺癌細胞LINC_00355、miR-15a-5p、PHF19表達水平比較 與A549肺癌細胞組、lncRNA-NC組比較,LINC_00355 mimics組細胞LINC_00355、PHF19 mRNA表達上調(P<0.05),miR-15a-5p表達降低(P<0.05),LINC_00355 inhibitor組細胞LINC_00355、PHF19 mRNA表達降低(P<0.05),miR-15a-5p表達升高(P<0.05);與LINC_00355 mimics組比較,LINC_00355 inhibitor組細胞LINC_00355、PHF19 mRNA表達降低(P<0.05),miR-15a-5p表達升高(P<0.05)。見表8。
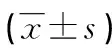
表8 各組細胞LINC_00355、miR-15a-5p mRNA相對表達水平比較
2.9各組細胞PHF19蛋白表達水平比較 與A549肺癌細胞組、lncRNA-NC組比較,LINC_00355 mimics組細胞PHF19蛋白表達上調(P<0.05),LINC_00355 inhibitor組細胞PHF19蛋白表達降低(P<0.05);與LINC_00355 mimics組比較,LINC_00355 inhibitor組細胞PHF19蛋白表達降低(P<0.05)。見表9、圖6。
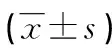
表9 各組細胞PHF19蛋白表達水平比較
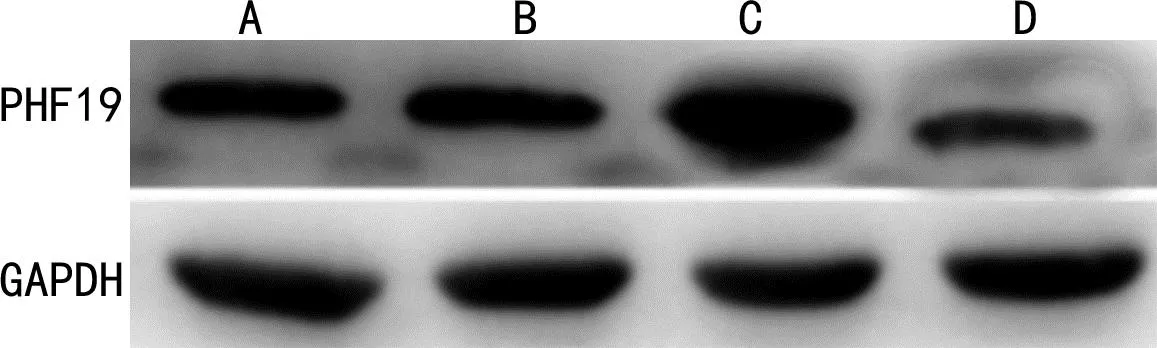
注:A為A549肺癌細胞組;B為lncRNA-NC組;C為LINC_00355 mimics組;D為LINC_00355 inhibitor組。
3 討 論
本研究首次探討了LINC_00355在肺癌發(fā)展中的作用及其潛在機制,證明了LINC_00355過表達促進肺癌細胞的增殖、遷移和侵襲并誘導細胞凋亡,敲低LINC_00355則出現(xiàn)相反的效果;LINC_00355通過競爭性抑制miR-15a-5p的結合來增加PHF19的表達,PHF19被確定為肺癌發(fā)展的促進者。因此,本研究表明LINC_00355可能通過抑制miR-15a-5p表達進而誘導PHF19表達來促進肺癌的發(fā)展。
研究表明,lncRNA在調節(jié)細胞過程中起著至關重要的作用,包括細胞周期、生長和細胞凋亡。lncRNA在轉錄或轉錄后水平的變化直接或間接導致不受控制的腫瘤生長。臨床研究顯示,LINC_00355與結直腸癌的臨床特征相關,與生存率呈負相關[9];此外,LINC_00355在前列腺癌中高表達,并且與癌癥患者的存活率相關;在胃癌組織和細胞中也觀察到高表達的LINC_00355,表明LINC_00355可能在胃癌的發(fā)生發(fā)展中起到促進作用[10-11]。本研究結果表明,與A549肺癌細胞組、lncRNA-NC組比較,LINC_00355 mimics組A值、細胞活力、單克隆形成數(shù)、穿膜數(shù)、遷移距離增加,凋亡率降低,差異均有統(tǒng)計學意義(P<0.05);LINC_00355 inhibitor組A值、細胞活力、單克隆形成數(shù)、穿膜數(shù)、遷移距離減少,凋亡率升高,差異均有統(tǒng)計學意義(P<0.05);與LINC_00355 mimics組比較,LINC_00355 inhibitor組A值、細胞活力、單克隆形成數(shù)、穿膜數(shù)、遷移距離減少,凋亡率升高,差異均有統(tǒng)計學意義(P<0.05)。這表明,LINC_00355過表達促進肺癌細胞的增殖、遷移和侵襲并誘導細胞凋亡,敲低LINC_00355則出現(xiàn)相反的效果。相關研究顯示,LINC_00355抑制還可改善其他癌癥的惡性表型,例如,LINC_00355敲低抑制了膀胱癌細胞的增殖和侵襲;LINC_00355的下調抑制了HNSCC中癌癥干細胞的活力、侵襲、遷移和上皮-間質轉化,并促進了腫瘤干細胞的凋亡[12]。這些研究與本研究結果一致。
miR-15a-5p在多種癌癥的發(fā)展中發(fā)揮負調節(jié)作用,包括胃癌、膀胱癌和宮頸癌。具體而言,miR-15a-5p在胃癌中的表達患者顯著減少,miR-15a-5p過表達抑制了胃癌細胞增殖和腫瘤侵襲;證明miR-15a-5p下調與晚期腫瘤分級和轉移有關[13-14]。生物信息學分析表明LINC_00355與miR-15a-5p之間存在結合位點,雙螢光素酶報告基因檢測證實了這一點。單個lncRNA通常通過吸收多個miRNA在癌癥中發(fā)揮作用。例如,LINC_00355通過結合miR-195促進HNSCC進展;在肝細胞癌(HCC)中,LINC_00355作為ceRNA海綿化miR-6777-3p并進一步促進HCC進展[15];這些發(fā)現(xiàn)表明LINC_00355通過多種途徑調節(jié)癌癥發(fā)展并突出了LINC_00355在癌癥進展中的重要作用。本研究證明LINC_00355通過負調控miR-15a-5p促進肺癌進展,表明LINC_00355/miR-15a-5p軸可能是LINC_00355調控肺癌發(fā)展的方式之一。
PHF19是多梳狀蛋白的成員,可以調節(jié)多梳抑制復合物2(PRC2)的酶活性和募集。PHF19表達的失調與多種癌癥的發(fā)展有關。先前的研究發(fā)現(xiàn)PHF19表達與膠質母細胞瘤進展呈正相關;PHF19沉默減少了卵巢癌細胞的增殖,并誘導細胞凋亡和細胞周期停滯;此外,PHF19的過表達與胃癌患者的紫杉醇耐藥性相關[16-17];此外,最近的一項研究表明,PHF19的下調可以抑制胃癌細胞的增殖和遷移[18]。這些該研究結果突出了PHF19在癌癥發(fā)展中的正向調節(jié)作用。本研究結果顯示:與A549肺癌細胞組、lncRNA-NC組比較,LINC_00355 mimics組細胞LINC_00355、PHF19 mRNA升高,miR-15a-5p降低,差異均有統(tǒng)計學意義(P<0.05),LINC_00355 inhibitor組細胞LINC_00355、PHF19 mRNA和蛋白降低,miR-15a-5p升高,差異均有統(tǒng)計學意義(P<0.05);與LINC_00355 mimics組比較,LINC_00355 inhibitor組單細胞LINC_00355 mRNA、PHF19 mRNA和蛋白降低,miR-15a-5p升高,差異均有統(tǒng)計學意義(P<0.05)。這說明LINC_00355負調控miR-15a-5p上調肺癌細胞中PHF19的表達。
綜上所述,LINC_00355過表達促進肺癌細胞的增殖、遷移和侵襲并誘導細胞凋亡,敲低LINC_00355則出現(xiàn)相反的效果;其機制可能與LINC_00355負調控miR-15a-5p進而上調肺癌細胞中PHF19的表達有關。

