鼻咽癌組織中GPX4和SLC7A11的表達(dá)及臨床意義
王春艷,趙興泉,徐 鑫
四川綿陽四0四醫(yī)院/綿陽市第一人民醫(yī)院耳鼻咽喉科,四川綿陽 621000
鼻咽癌(NPC)是頭頸部常見惡性腫瘤,全世界每年新發(fā)12.8萬例,死亡5萬例[1]。對于早期NPC患者可通過放療聯(lián)合化療提高生存率,但對于晚期患者,已錯失最佳治療機(jī)會,5年生存率僅50%[2]。谷胱甘肽過氧化物酶4(GPX4)具有催化過氧化物、脂質(zhì)氫過氧化物還原的功能,保護(hù)細(xì)胞免受氧化及脂質(zhì)過氧化損傷,與精子及骨骼正常發(fā)育過程有關(guān)[3]。既往研究發(fā)現(xiàn),GPX4在前列腺癌、乳腺癌等惡性腫瘤組織中表達(dá)水平升高,其通過清除腫瘤細(xì)胞內(nèi)活性氧,避免脂質(zhì)過氧化,抑制腫瘤細(xì)胞鐵死亡的發(fā)生[4]。溶質(zhì)載體家族7成員11(SLC7A11)是一種多通道跨膜蛋白,能夠不依賴鈉離子逆向轉(zhuǎn)運氨基酸,調(diào)節(jié)細(xì)胞外胱氨酸的攝取[5]。有研究發(fā)現(xiàn),SLC7A11在膠質(zhì)瘤中表達(dá)水平升高,其通過促進(jìn)腫瘤細(xì)胞胱氨酸攝取,抑制腫瘤細(xì)胞鐵死亡,促進(jìn)腫瘤的發(fā)生發(fā)展及耐藥性形成[6]。目前NPC中GPX4、SLC7A11的表達(dá)情況及臨床意義尚不清楚。本研究檢測NPC中GPX4、SLC7A11的表達(dá),探討兩者的臨床意義。
1 資料與方法
1.1一般資料 將2016年3月至2017年3月于本院診治的98例NPC患者納入研究作為NPC組。其中男61例、女37例,年齡34~77歲,平均(63.4±6.1)歲,有吸煙史者40例,病理類型包括角化性鱗狀細(xì)胞癌20例、非角化性(分化型)28例、非角化性(未分化型)50例,臨床分期包括Ⅰ~Ⅱ期32例、Ⅲ~Ⅳ期66例,高分化程度30例、中分化程度33例、低分化程度36例,合并淋巴結(jié)轉(zhuǎn)移43例。納入標(biāo)準(zhǔn):(1)經(jīng)病理活檢明確為NPC;(2)初發(fā)且首次診治,既往無抗腫瘤治療史;(3)臨床資料完整。排除標(biāo)準(zhǔn):(1)合并其他器官的惡性腫瘤或鼻咽部其他類型腫瘤;(2)合并精神障礙性疾病;(3)合并嚴(yán)重的肝、腎衰竭。另選取同期于本院治療的60例因鼻中隔偏曲接受手術(shù)治療的患者作為對照組。對照組和NPC組性別、年齡等一般資料比較,差異無統(tǒng)計學(xué)意義(P>0.05)。本研究經(jīng)本院倫理委員會審核批準(zhǔn)通過。納入研究者或直系親屬家屬能夠配合本研究,對本研究知情同意并簽署知情同意書。
1.2方法
1.2.1免疫組化檢測GPX4、SLC7A11表達(dá) 取NPC組織和對照組正常組織,采用常規(guī)的甲醛溶液固定及石蠟包埋,切片機(jī)切片,制作成石蠟切片后進(jìn)行免疫組化染色。兔抗兩步法免疫組化試劑盒購自北京中杉金橋公司,貨號PV-6000。簡要步驟:二甲苯脫蠟后梯度乙醇水化,采用檸檬酸鈉溶液進(jìn)行抗原熱修復(fù),過氧化氫阻斷內(nèi)源性過氧化物酶,3%羊血清封閉,一抗4 ℃孵育過夜,一抗GPX4、SLC7A11稀釋比均為1∶1 000,一抗均購自美國Abcam公司,貨號分別為ab125066、ab37185。鏡下觀察免疫組化染色情況,然后進(jìn)行染色強(qiáng)度評分:未染色為0分,淺黃色1分,棕褐色顆粒2分。染色面積評分:陽性面積<25%為1分,陽性面積介于25%~50%為2分,陽性面積>50%為3分。通過計算染色強(qiáng)度和染色面積評分的乘積得到免疫組化染色評分[7],評分≥2分判定為染色陽性,<2分判定為陰性。
1.2.2治療、療效評價及隨訪 所有患者均接受調(diào)強(qiáng)放射治療,原發(fā)灶放療總劑量66~72 Gy,轉(zhuǎn)移淋巴結(jié)區(qū)64~70 Gy,每日1次,每周5次,共30次或31次。Ⅲ~Ⅳ期患者同時接受順鉑為基礎(chǔ)的誘導(dǎo)+同步化療或輔助化療。誘導(dǎo)或輔助化療方案為多西他賽70 mg·m-2/d(第1天)+順鉑25 mg·m-2·/d (第1~3天)+5氟尿嘧啶500 mg·m-2/d(第1~4天)。同步化療方案為順鉑25 mg·m-2/d(第1~3天)。療效評價參照Recist1.1標(biāo)準(zhǔn)[8],完全緩解(CR):鼻咽部腫塊消失,陽性淋巴結(jié)縮小到<10 mm;部分緩解(PR):鼻咽部腫塊直徑縮小30%;疾病進(jìn)展(PD):鼻咽部腫塊直徑增大20%或出現(xiàn)新發(fā)病灶;疾病穩(wěn)定(SD):鼻咽部腫塊直徑變化介于PR和PD之間。所有患者同步放化療結(jié)束后第6個月采用電子鼻腔鏡、鼻咽頸部MRI等影像學(xué)檢查進(jìn)行復(fù)查,對CR或PR者定義為放療敏感組(n=60),對SD或PD者定義為放療抵抗組(n=38)。所有患者在治療后的第1年內(nèi)每3個月隨訪1次,第2年開始每隔1年進(jìn)行1次隨訪,以門診或電話方式進(jìn)行隨訪,最后隨訪截止時間為2022年4月1日。隨訪內(nèi)容為患者的生存狀態(tài)、臨床癥狀、影像學(xué)檢查結(jié)果等。
1.3統(tǒng)計學(xué)處理 采用SPSS20.0軟件進(jìn)行數(shù)據(jù)分析。計數(shù)資料以例數(shù)或百分率表示,組間比較采用χ2檢驗。采用Spearman秩相關(guān)分析NPC組織中GPX4、SLC7A11表達(dá)的相關(guān)性。Kaplan-Meier法分析GPX4、SLC7A11表達(dá)對NPC患者生存預(yù)后的影響(Log-rank檢驗)。Cox回歸分析影響NPC患者預(yù)后的因素。P<0.05為差異有統(tǒng)計意義。
2 結(jié) 果
2.1NPC組織與正常鼻黏膜組織中GPX4、SLC7A11的表達(dá)情況 NPC組織中GPX4、SLC7A11棕黃色的陽性染色位于細(xì)胞質(zhì)和細(xì)胞膜。NPC組織中GPX4、SLC7A11表達(dá)陽性率分別為75.51%(74/98)、73.47%(72/98),分別高于正常鼻黏膜組織的11.67%(7/60)、13.33%(8/60),差異均有統(tǒng)計學(xué)意義(χ2=60.715、57.632,P<0.001)。見圖1。
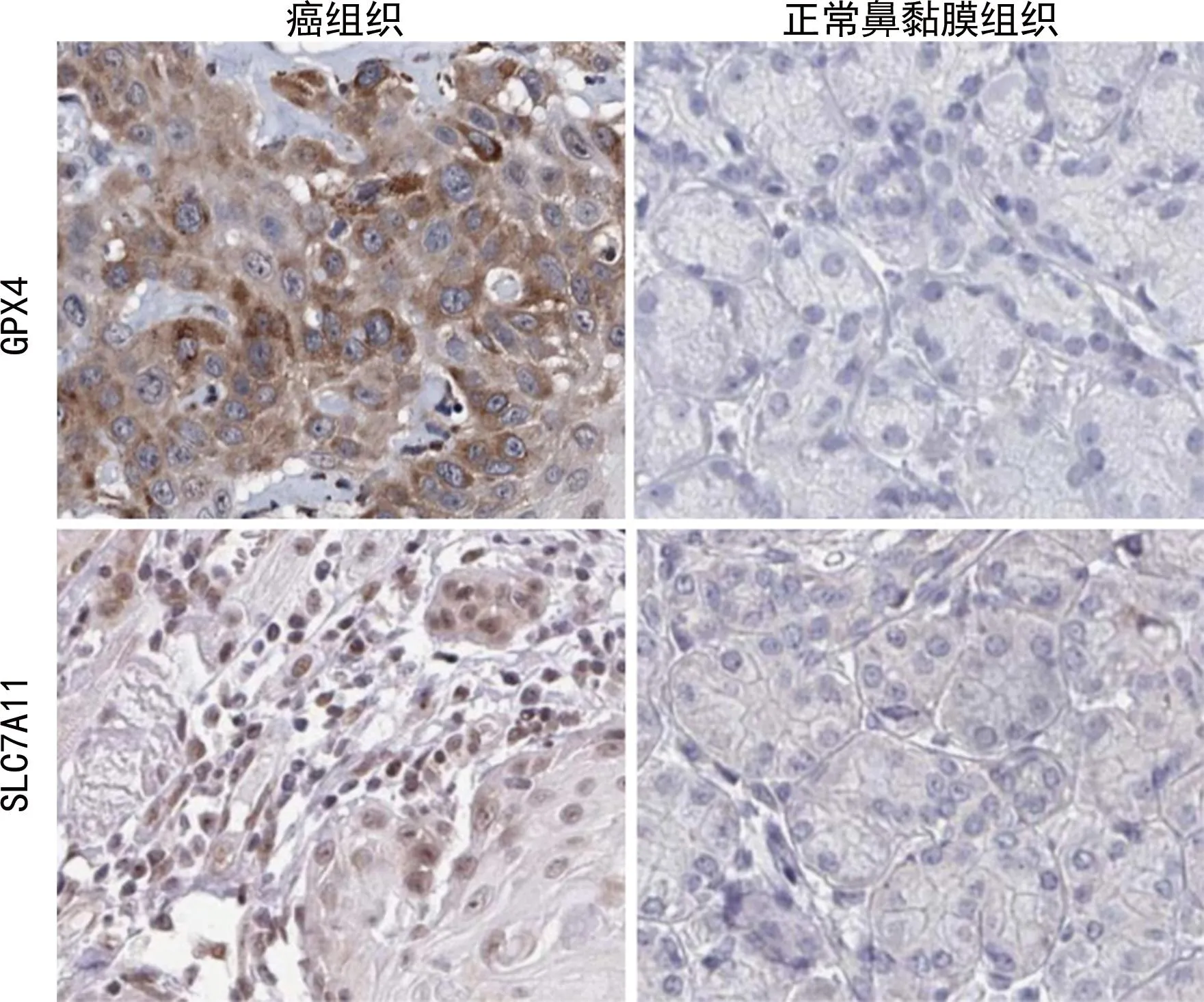
圖1 NPC組織與正常鼻黏膜組織中GPX4、SLC7A11的表達(dá)(×200)
2.2NPC組織中GPX4、SLC7A11表達(dá)的相關(guān)性 Spearman秩相關(guān)分析顯示,NPC組織中GPX4與SLC7A11表達(dá)呈正相關(guān)(r=0.724,P<0.001)。
2.3不同臨床病理特征患者NPC組織中GPX4、SLC7A11表達(dá)陽性率比較 不同臨床分期、腫瘤分化程度、淋巴結(jié)轉(zhuǎn)移情況及放療敏感性NPC患者癌組織中GPX4、SLC7A11表達(dá)陽性率比較,差異均有統(tǒng)計學(xué)意義(P<0.05),見表1。
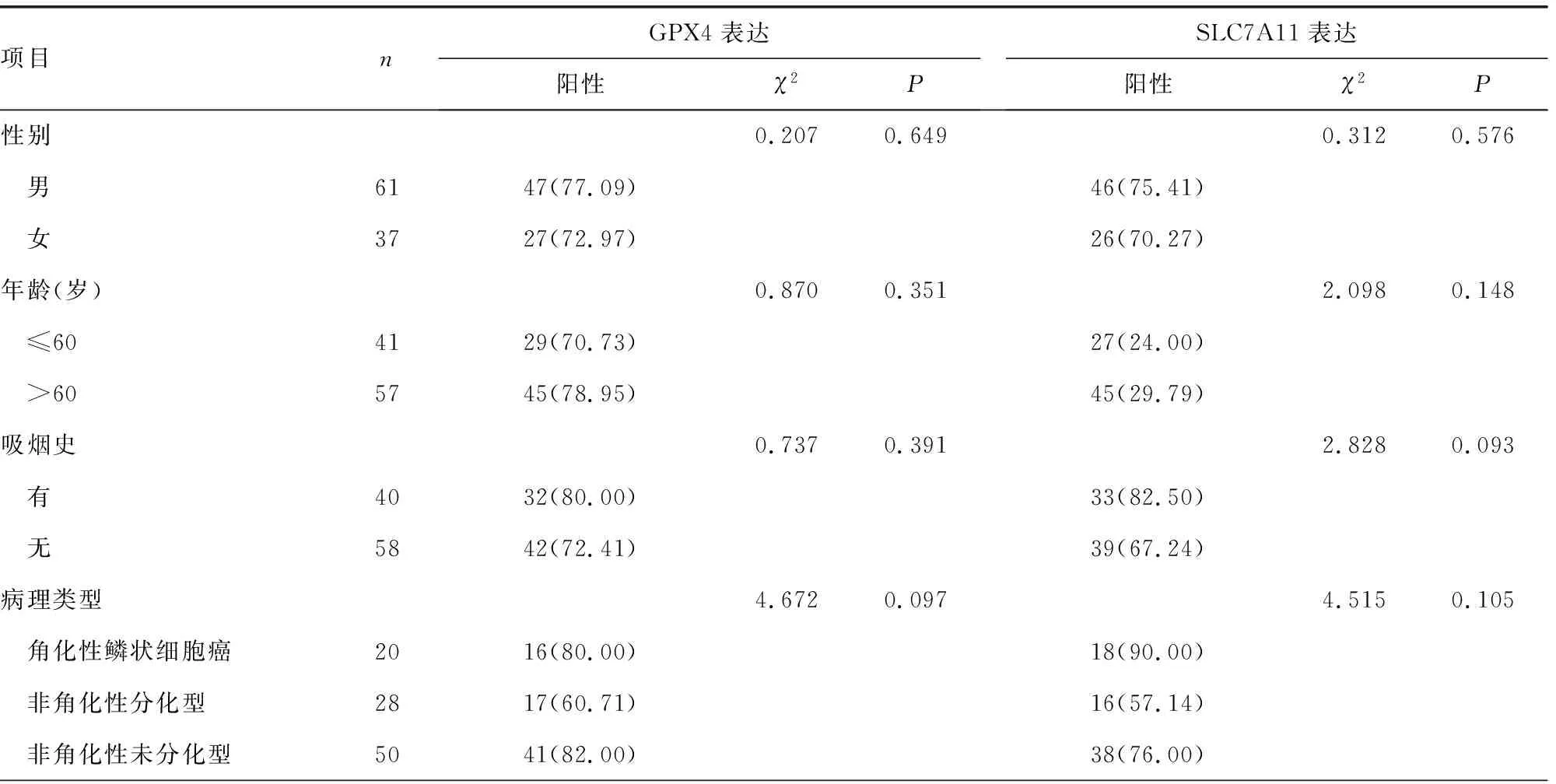
表1 不同臨床病理特征NPC中GPX4、SLC7A11表達(dá)陽性率比較[n(%)]
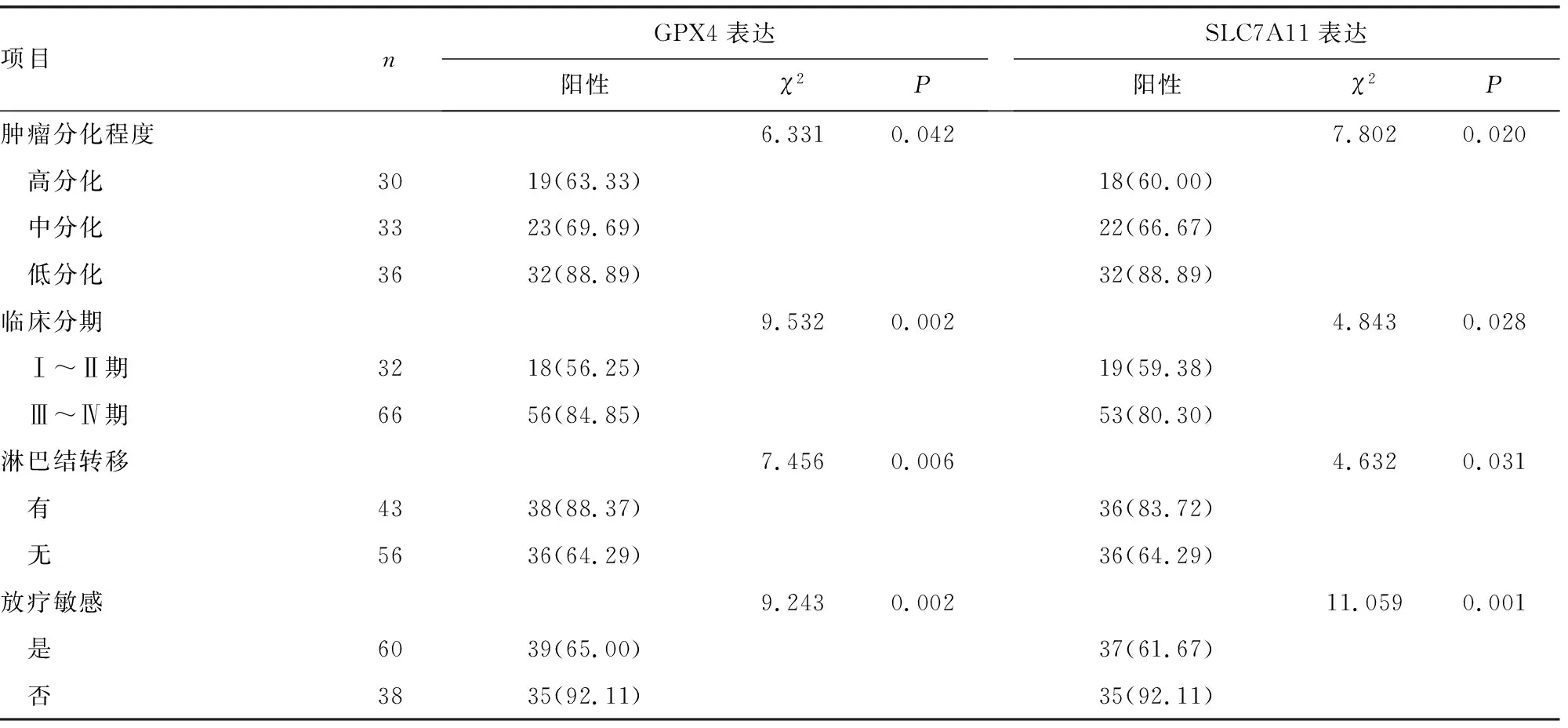
續(xù)表1 不同臨床病理特征NPC中GPX4、SLC7A11表達(dá)陽性率比較[n(%)]
2.4GPX4、SLC7A11表達(dá)對NPC患者生存預(yù)后的影響 截至隨訪結(jié)束(共6個月),患者的中位隨訪時間為54個月(7~60個月),死亡27例,5年總體生存率為72.45%(71/98)。GPX4陽性及陰性表達(dá)組的5年總體生存率分別為66.22%(49/74)、91.67%(22/24);Kaplan-Meier法分析顯示,GPX4陽性表達(dá)組累積生存率低于陰性表達(dá)組(Log-rankχ2=5.822,P<0.001)。SLC7A11陽性及陰性表達(dá)組5年總體生存率分別為66.67%(48/72)、88.46%(23/26);SLC7A11陽性表達(dá)組累積生存率低于陰性表達(dá)組(Log-rankχ2=5.041,P=0.012)。見圖2。
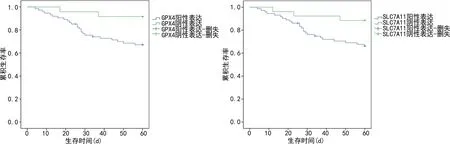
圖2 Kaplan-Meier法分析GPX4、SLC7A11表達(dá)對NPC患者預(yù)后的影響
2.5影響NPC患者預(yù)后的因素分析 以NPC患者預(yù)后為因變量,包括生存狀態(tài)(1=死亡,0=生存)、生存時間(d)。將年齡(1=≥60歲,0=<60歲)、性別(1=男,0=女)、吸煙史(1=有,0=無)、腫瘤分化程度(1=低分化,0=高中分化)、病理類型(1=非角化性未分化型及分化型,0=角化性鱗狀細(xì)胞癌)、淋巴結(jié)轉(zhuǎn)移(1=有,0=無)、臨床分期(1=Ⅲ~Ⅳ期,0=Ⅰ~Ⅱ期)、GPX4(1=陽性,0=陰性)、SLC7A11(1=陽性,0=陰性)作為自變量。單因素Cox回歸分析顯示,臨床分期、淋巴結(jié)轉(zhuǎn)移、GPX4、SLC7A11是影響NPC患者預(yù)后的因素(P<0.05)。將單因素分析中差異有統(tǒng)計學(xué)意義的因素納入多因素Cox回歸分析,結(jié)果顯示,臨床分期Ⅲ~Ⅳ期、淋巴結(jié)轉(zhuǎn)移、GPX4、SLC7A11是NPC患者生存預(yù)后的獨立影響因素。見表2、3。

表2 單因素Cox回歸分析影響NPC患者預(yù)后的因素
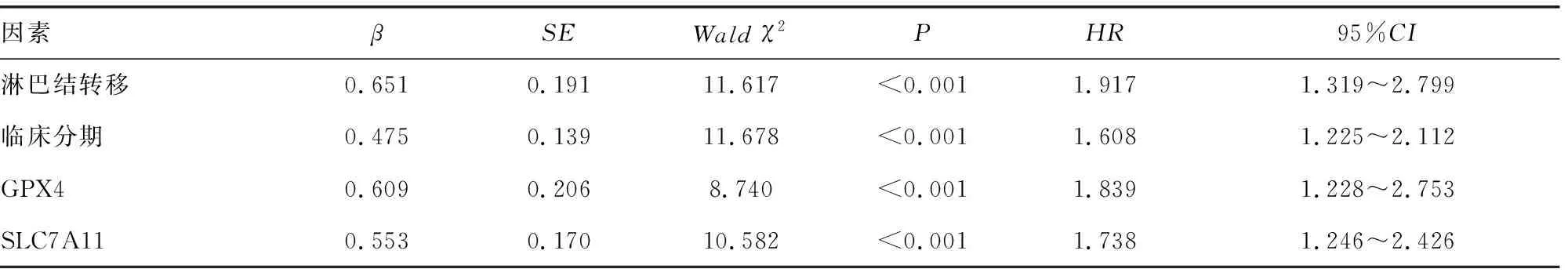
表3 多因素Cox回歸分析影響NPC患者預(yù)后的因素
3 討 論
NPC是鼻咽腔的惡性腫瘤。NPC解剖位置隱匿,惡性程度高,容易出現(xiàn)淋巴結(jié)轉(zhuǎn)移,多數(shù)患者初診時已為局部晚期。NPC對放療敏感,放療是NPC的首選治療方案,但由于不同患者對放療的敏感度存在差異,部分患者對放療存在抵抗,表現(xiàn)為放療后仍有部分腫瘤組織未完全消退,短時間內(nèi)會發(fā)生腫瘤復(fù)發(fā)或轉(zhuǎn)移,嚴(yán)重影響患者的生存率[9]。深入研究NPC的病理機(jī)制,尋找新的能夠評估放療敏感性及預(yù)后的生物標(biāo)志物,對于選擇合適的個體化治療方案,具有重要意義。
GPX4屬于谷胱甘肽過氧化物酶家族成員,具有含硒半胱氨酸的亞硒蛋白催化中心,能夠還原過氧化氫,抑制脂質(zhì)過氧化等生物學(xué)功能。YEE等[10]發(fā)現(xiàn),膠質(zhì)瘤中GPX4的表達(dá)上調(diào)能夠通過抑制腫瘤細(xì)胞脂質(zhì)過氧化,促進(jìn)腫瘤中性粒細(xì)胞浸潤,導(dǎo)致腫瘤免疫逃逸及惡性進(jìn)展。本研究中,NPC組織中GPX4的表達(dá)升高,并與臨床分期、分化程度及淋巴結(jié)轉(zhuǎn)移有關(guān),表明GPX4的表達(dá)上調(diào)促進(jìn)NPC的發(fā)生發(fā)展。NPC中GPX4表達(dá)上調(diào)的機(jī)制可能與Wnt信號通路的激活有關(guān)[11]。WANG等[12]研究發(fā)現(xiàn),胃癌中Wnt信號通路的激活能夠促進(jìn)β-連環(huán)蛋白/TCF4轉(zhuǎn)錄復(fù)合物直接結(jié)合GPX4的啟動子區(qū)并誘導(dǎo)GPX4的表達(dá)。ZOU等[13]發(fā)現(xiàn),腫瘤細(xì)胞的缺氧微環(huán)境導(dǎo)致糖脂代謝紊亂,腫瘤細(xì)胞內(nèi)產(chǎn)生大量脂質(zhì)過氧化物,GPX4通過還原脂質(zhì)過氧化物及活性氧,將其轉(zhuǎn)化為無毒的產(chǎn)物蓄積于腫瘤細(xì)胞內(nèi),避免腫瘤細(xì)胞鐵死亡的發(fā)生,促進(jìn)腫瘤細(xì)胞的增殖及侵襲。本研究中,GPX4表達(dá)與NPC患者放療敏感性有關(guān),提示GPX4有助于評估NPC患者放療的敏感性。分析其原因,可能是GPX4的表達(dá)上調(diào)抑制放療誘導(dǎo)的鐵死亡的發(fā)生。有研究表明,放射治療能夠誘導(dǎo)活性氧產(chǎn)生,導(dǎo)致脂質(zhì)過氧化,而GPX4的表達(dá)上調(diào)消除了放射治療誘導(dǎo)的鐵死亡,提高腫瘤的抗輻射能力,而用鐵死亡誘導(dǎo)劑抑制腫瘤細(xì)胞中GPX4的表達(dá)后,能夠恢復(fù)放療抵抗性腫瘤細(xì)胞的放療敏感性[14]。本研究發(fā)現(xiàn),GPX4陽性表達(dá)NPC患者生存預(yù)后較差,是患者預(yù)后不良的獨立危險因素,提示GPX4是一種新的評估NPC預(yù)后的生物標(biāo)志物。YUAN等[15]報道,GPX4與轉(zhuǎn)化生長因子β激活激酶結(jié)合形成復(fù)合物,促進(jìn)下游絲裂原活化蛋白激酶和核因子κB通路的激活,促進(jìn)NPC腫瘤細(xì)胞的惡性增殖和化療耐藥性的形成。
鐵死亡是由Xc胱氨酸/谷氨酸反轉(zhuǎn)運蛋白系統(tǒng)失活引起鐵依賴性脂質(zhì)過氧化導(dǎo)致的,是一種新的程序性非凋亡性細(xì)胞死亡。SLC7A11又稱為xCT,是Xc氨基酸逆向轉(zhuǎn)運系統(tǒng)的重要組成單位,其通過攝取胱氨酸并將谷氨酸轉(zhuǎn)運到細(xì)胞外。越來越多的研究表明,SLC7A11在肺癌等惡性腫瘤中表達(dá)上調(diào),導(dǎo)致細(xì)胞內(nèi)谷胱甘肽水平升高,促進(jìn)腫瘤細(xì)胞的侵襲遷移及化療耐藥性的形成[16]。本研究中,NPC組織中SLC7A11表達(dá)水平升高,并與臨床分期、分化程度及淋巴結(jié)轉(zhuǎn)移有關(guān),提示SLC7A11的表達(dá)上調(diào)促進(jìn)NPC腫瘤的發(fā)生及疾病進(jìn)展。NPC中SLC7A11表達(dá)上調(diào)與EB病毒感染有關(guān)。YUAN等[15]研究發(fā)現(xiàn),NPC中EB病毒感染通過激活p62/核因子E2相關(guān)因子2信號通路,在轉(zhuǎn)錄水平上調(diào)SLC7A11表達(dá),抑制腫瘤鐵死亡的發(fā)生。此外,SLC7A11還能夠通過促進(jìn)胱氨酸攝取和谷胱甘肽生物合成,抑制腫瘤細(xì)胞氧化應(yīng)激損傷,避免鐵死亡的發(fā)生,促進(jìn)腫瘤細(xì)胞的增殖[17]。本研究中,SLC7A11表達(dá)與放療敏感性有關(guān)。其原因可能是SLC7A11的表達(dá)上調(diào)抑制放療誘導(dǎo)鐵死亡的發(fā)生。有研究發(fā)現(xiàn),肝癌中SLC7A11的N端結(jié)構(gòu)域能夠被細(xì)胞因子信號轉(zhuǎn)導(dǎo)抑制因子2的SH2結(jié)構(gòu)域特異性識別及泛素化降解,而細(xì)胞因子信號轉(zhuǎn)導(dǎo)抑制因子2的表達(dá)缺失導(dǎo)致SLC7A11蛋白穩(wěn)定性增加,抑制腫瘤鐵死亡并導(dǎo)致腫瘤放射抵抗性的發(fā)生[18]。本研究還發(fā)現(xiàn),SLC7A11陽性表達(dá)的NPC患者生存預(yù)后較差,是NPC患者不良預(yù)后的獨立危險因素,提示檢測NPC組織中SLC7A11的表達(dá)有助于NPC患者臨床預(yù)后預(yù)測,是新的預(yù)后判斷的標(biāo)志物。ZHANG等[19]報道,利用小分子藥物抑制SLC7A11的表達(dá)后,通過抑制雷帕霉素靶蛋白通路,促進(jìn)腫瘤細(xì)胞鐵死亡的發(fā)生,并增強(qiáng)對放化療治療的敏感性。因此,以SLC7A11為靶點的治療可能是新的NPC治療策略,有助于改善患者的臨床預(yù)后。本研究中,NPC組織中GPX4與SLC7A11的表達(dá)呈正相關(guān),提示兩者共同參與NPC的腫瘤進(jìn)展過程。其原因是兩者共同參與抑制NPC腫瘤細(xì)胞鐵死亡。SLC7A11作為氨基酸轉(zhuǎn)運蛋白,其表達(dá)升高能促進(jìn)谷胱甘肽合成,谷胱甘肽在GPX4催化下,還原腫瘤細(xì)胞內(nèi)活性氧,避免腫瘤細(xì)胞鐵死亡的發(fā)生[20]。因此,兩者在NPC中協(xié)同促進(jìn)腫瘤的發(fā)生和進(jìn)展。
綜上所述,NPC中GPX4、SLC7A11表達(dá)水平升高,兩者表達(dá)與臨床分期、腫瘤分化程度、淋巴結(jié)轉(zhuǎn)移及放療敏感性有關(guān),共同參與NPC的發(fā)生、發(fā)展。GPX4、SLC7A11陽性表達(dá)的NPC患者生存預(yù)后較差,GPX4、SLC7A11是評估NPC患者預(yù)后的潛在標(biāo)志物。臨床醫(yī)生可根據(jù)癌組織中GPX4、SLC7A11表達(dá)對患者放療敏感性及預(yù)后進(jìn)行預(yù)測,從而積極治療,改善患者臨床預(yù)后。但本研究未對NPC中GPX4、SLC7A11促進(jìn)腫瘤進(jìn)展的分子機(jī)制進(jìn)行研究,擬后續(xù)通過細(xì)胞、分子生物學(xué)實驗,進(jìn)一步揭示兩者的臨床應(yīng)用價值。
- 國際檢驗醫(yī)學(xué)雜志的其它文章
- 游離DNA甲基化在非腫瘤性疾病中的應(yīng)用研究進(jìn)展
- LINC_00355通過miR-15a-5p調(diào)節(jié)PHF19在肺癌侵襲轉(zhuǎn)移中的作用機(jī)制研究
- 再生障礙性貧血患者外周血miR-155-5p、miR-1260b水平及臨床意義
- HPV DNA負(fù)荷量、輔助性T細(xì)胞17、FoxP3+調(diào)節(jié)性T細(xì)胞及炎癥因子與高危型HPV感染的相關(guān)性分析
- 膀胱癌患者血清miR-124、miR-320a水平與臨床病理特征及生存預(yù)后的關(guān)系
- BRAF、TP53、Pax8-PPARγ在甲狀腺癌中的表達(dá)及療效預(yù)測價值

