肺癌根治術后肺部感染病原菌分布及其早期風險預測模型的構建
程冬艷 程 領 薄 霞
作者單位:450000 鄭州大學第一附屬醫院
肺癌高居癌癥死亡率之首,對人類的生命安全造成嚴重的影響[1]。目前對于肺癌的主要治療方式是手術,其能夠有效切除腫瘤組織,控制癌癥的進展[2]。但是由于肺癌手術的創傷性較大,且很容易破壞胸腔的正常環境,引發術后積氣和積液的產生;并且手術也可對免疫力造成一定影響,肺部感染也較為多見,對預后會造成嚴重的影響[3-4]。肺癌術后發生肺部感染的治療難度較大,而抗生素的長時間使用也會影響康復[5],但關于術后肺部感染病原菌分布以及危險因素仍不明確。本研究為此選取我院收治的72例肺癌患者臨床資料進行分析,以研究肺癌根治術后肺部感染病原菌分布及其早期風險預測模型的構建。
1 資料與方法
1.1 一般資料
選取我院2019年2月至2021年12月收治的72例肺癌患者作為研究對象,72例患者男性42例,女性30例,年齡49~68歲,平均年齡(59.62±5.47)歲;BMI指數21~24 kg/m2,平均BMI指數(22.63±1.28)kg/m2。納入標準:①均符合《肺癌診斷治療學》[6]中肺癌的診斷標準;②術后經過病理學檢查明確肺癌診斷標準;③于我院初次接受治療;④患者臨床資料完整。排除標準:①患者術前合并肺部感染或者其他感染疾病;②患者行氣管切開;③患者機械通氣在24 h以上;④患者依從性較差,無法正常溝通。
1.2 方法
肺部感染:參考《臨床肺部感染病學》[7]中肺部感染評定標準:①患者術后新發咳嗽、咳痰或者原本呼吸道癥狀明顯加重,同時存在膿性痰,并伴有胸痛;②發熱,且體溫≥38 ℃;③患者合并肺實質體征或者肺濕性啰音;④患者白細胞計數>10×109/L,伴有或者不伴有核左移。符合以上一項及以上即刻診斷肺部感染。
標本采集以及病原菌檢驗標準:患者在起床后以清水清理干凈口腔,隨后以生理鹽水漱口后將深部痰咳出,第一口倒掉,獲取第二口痰;無法自主咳痰的則需要運用纖維支氣管鏡獲得痰液。痰涂片在低倍視野下可觀察到白細胞數大于25個、上皮細胞低于10個為合格標本。采用梅特勒托利多科技公司的7000RMS微生物鑒定儀進行檢測,當>105CFU/ml則為陽性。連續2次培養為同一種病原菌時則為陽性,且該病菌為致病菌。
臨床資料:收集患者的年齡、性別、吸煙史、飲酒史、糖尿病、術前一秒用力呼氣容積(Forced expiratory volume in one second,FEV1)、心臟病史、腫瘤直徑、手術時間、切除范圍、術中出血量、術后輸血情況。
1.3 統計學方法
2 結果
2.1 肺癌根治術后感染和病原菌分布情況分析
72例患者出現了18例肺部感染,感染率為25.00%。18例感染總共分離出35株病原菌,其中革蘭陰性菌22株,占62.85%,以銅綠假單胞菌、肺炎克雷伯菌和大腸埃希菌為主;革蘭陽性菌9株,占25.71%,以金色葡萄球菌和溶血性葡萄球菌為主;真菌4株,占11.42%,以白色念珠菌為主。見表1。
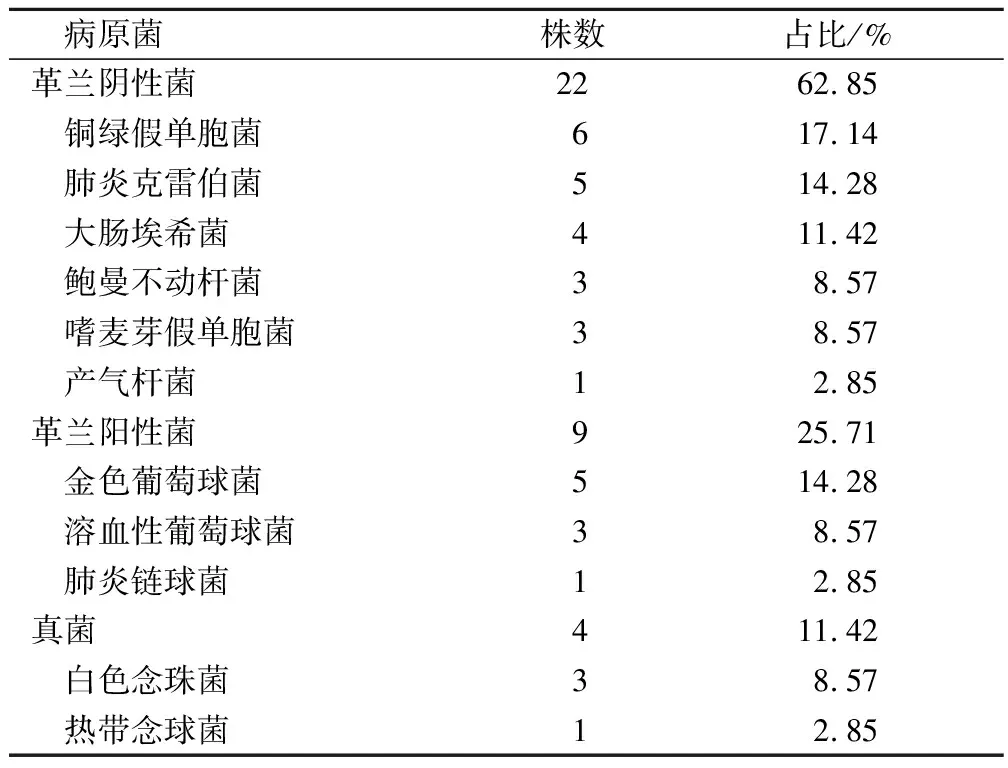
表1 肺癌根治術后感染和病原菌分布情況分析
2.2 肺癌患者根治術后早期肺部感染的單因素分析
2組患者在性別、飲酒史、糖尿病病史、心臟病史、腫瘤直徑方面差異無統計學意義(P>0.05);與未感染組患者相比,感染組患者年齡≥60歲、有吸煙史、術前FEV1≤80%、手術時間≥150 min、多葉切除以及術中出血量≥200 mL的占比顯著更高,差異具有統計學意義(P<0.05)。見表2。
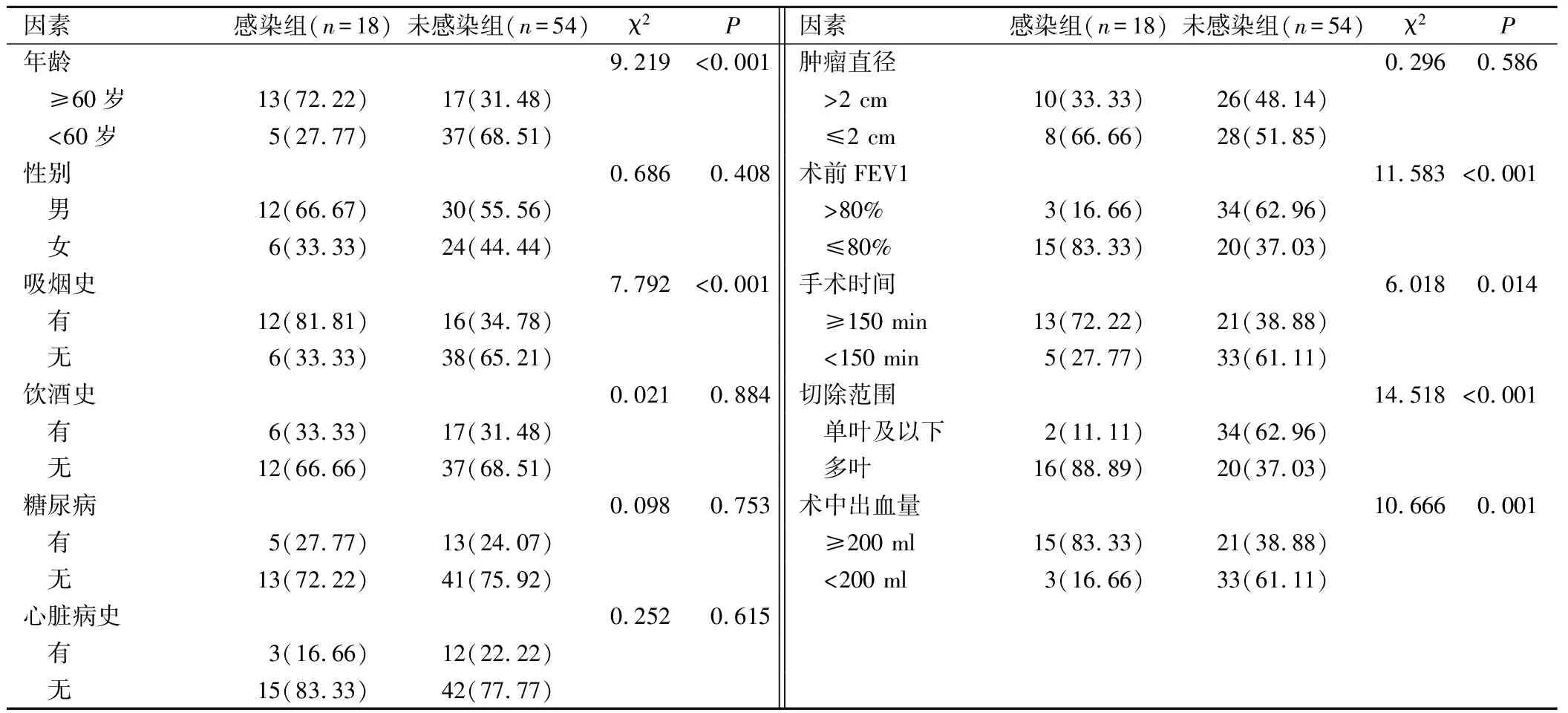
表2 肺癌患者根治術后早期肺部感染的單因素分析(例,%)
2.3 肺癌患者根治術后早期肺部感染的多因素分析
以單因素分析中差異有統計學意義的變量(年齡、吸煙史、術前FEV1、手術時間、切除范圍以及術中出血量)作為自變量,以術后早期肺部感染組作為因變量,進行多因素回歸分析。結果提示,年齡、吸煙史、術前FEV1、手術時間、切除范圍以及術中出血量均是術后肺部感染的獨立影響因素(P<0.05)。見表3。
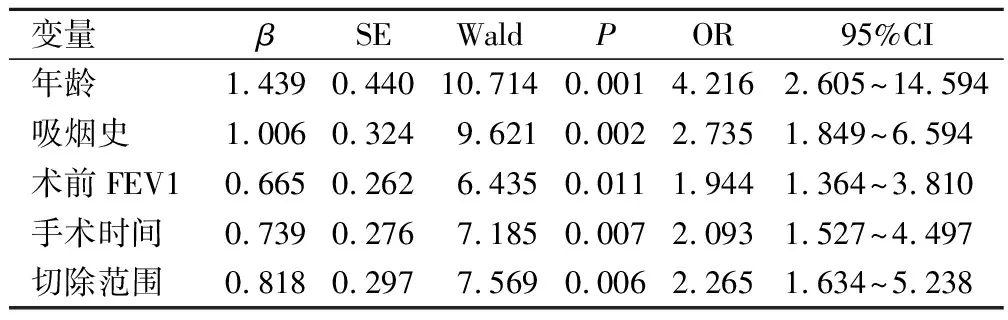
表3 肺癌患者根治術后早期肺部感染的多因素分析
2.4 肺癌患者根治術后早期肺部感染的列線圖創建
根據多因素Logistic回歸分析結果進行分析并創建預測模型(圖1),各獨立危險因素對于術后早期肺部感染的影響程度均以分值進行表示,將總分處做垂線,對應的預測價值則作為術后早期肺部感染的預測風險值。列線圖結果提示,年齡≥60歲為52分、有吸煙史為65分、術前FEV1≤80%為68分、手術時間≥150 min為49分、多葉切除為78分、術中出血量≥200 mL為70分。
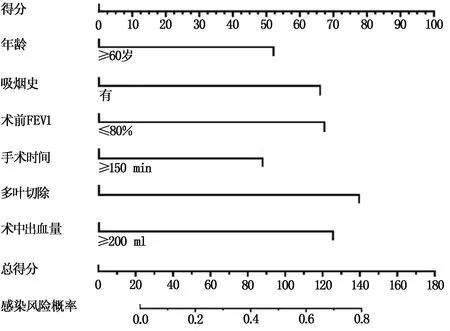
圖1 肺癌患者根治術后早期肺部感染的列線圖創建
2.5 肺癌患者根治術后早期肺部感染的列線圖模型驗證
通過創建模數據驗證結果顯示Hosmer-Lemeshow擬合優度檢驗結果χ2=8.372,P=0.14,以ROC曲線下面積對列線圖模型預測根治術后早期肺部感染的區分度,ROC曲線下面積為0.816,見圖2。可見,列線圖模型對于根治術后早期肺部感染預測風險精準和區分度均較高。
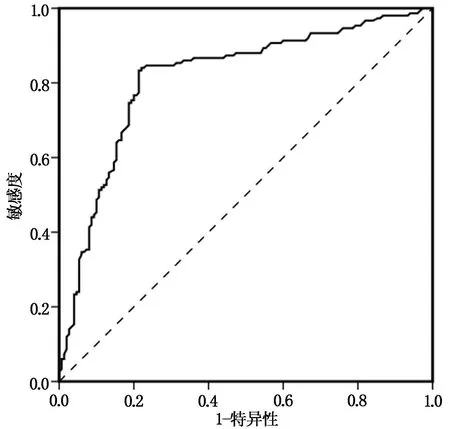
圖2 預測肺癌患者根治術后早期肺部感染的ROC曲線
3 討論
肺癌是呼吸系統常見的惡性腫瘤,發病率和死亡率均增長較快,嚴重威脅人們的生命安全[8]。目前臨床上常用肺癌根治術進行治療,具有較高的治療效果。肺部感染是術后常見的并發癥,致病微生物感染會造成肺組織實質性病變,可增加治療難度,嚴重影響預后恢復[9-10]。本研究為此進行研究,以為臨床上肺癌根治術術后肺部感染防治提供參考。
在本次研究結果中發現,72例患者出現了18例肺部感染,感染率為25.00%。這與馬穎欣等[10]研究結果一致。進一步病原菌進行分析發現,肺部感染病病菌主要以革蘭陰性菌為主,占62.85%;而革蘭陰性菌主要以銅綠假單胞菌和肺炎克雷伯為主。這是因為兩種病菌均可引起肺部炎癥病變,廣泛存在于人體呼吸道和腸道,在機體抵抗力較低時很容易出現感染的情況。多因素分析顯示,年齡≥60歲、有吸煙史、術前FEV1≤80%、手術時間≥150 min、多葉切除、術中出血量≥200 mL均是術后感染的獨立危險因素。高齡患者容易發生肺部感染是因為年齡較大,器官功能也逐漸衰竭,免疫力降低后,對于病菌的抵抗力也隨之降低,并且手術也會對免疫力造成影響,這也進一步加劇了高齡患者術后感染的風險,而列線圖模型評分增加52分[11]。吸煙患者由于長時間的吸煙會引起肺密閉容量升高,上皮纖毛系統功能也更易出現障礙,升高感染的風險,列線圖顯示評分增加65分[12]。FEV1是肺功能的重要反應指標,而肺功能與并發癥存在密切的關系。肺癌患者的呼吸肌力量較差,咳嗽痰效率也隨著降低。朱瑞云等[13]研究發現存在肺通氣功能障礙是患者術后并發肺部感染的獨立危險因素,而本研究結果顯示,切除范圍和術前FEV1≤80%均是患者術后并發肺部感染的獨立危險因素,這與本研究結果一致;同時列線圖模型評分分別增加78和68分。手術時間也是重要的影響因素,由于手術時間的延長,會引起單肺通氣時間增加。呼愛鮮[14]研究發現,手術時間≥3 h是肺癌患者術后并發肺部感染的危險因素。這與本次研究結果中手術時間≥150 min相近;同時列線圖模型評分增加49分。術中出血量通常是手術侵犯程度的反應指標,出血是手術難以避免的,過多的出血會引起循環血量降低,導致氧氣供應不足,這會使器官組織出現缺血損傷的風險加劇[15]。而組織缺氧后會引起能量生成異常,造成機體免疫屏障損害和腸道菌群異位,最終出現肺部感染。列線圖顯示輸血量≥200 mL評分增加70分。另外本研究對列線圖模型進行驗證發現列線圖模型對于根治術后早期肺部感染預測風險精準和區分度均較高。
綜上所述,肺癌根治術后肺部感染病原菌以革蘭陰性菌為主;基于年齡、吸煙史、術前FEV1、手術時間、切除范圍以及術中出血量這6項影響因素,創建預測肺癌根治術患者術后肺部感染的列線圖模型,區分度以及準確度較高。

