Flt3L、TGF-β1及EGFR與急性髓系白血病患者不良預后的關系
高 磊 趙 梅 魏興禹
作者單位:466000 河南省周口市中心血站(高 磊);466000 河南省周口市第二人民醫院(趙 梅);466000 河南省周口開元醫院(魏興禹)
白血病是血液系統惡性腫瘤,患者主要表現為造血功能障礙,根據發生惡性克隆增殖的細胞類型不同可分為髓系白血病和淋巴細胞白血病,其中臨床發病以急性髓性白血病(acute myelogenous leukemia,AML)常見,占白血病發病患者的60%以上[1]。AML發病機制尚未完全闡明,考慮受環境、遺傳等多種因素共同影響[2]。AML臨床治療以化療為主,利用阿糖胞苷、柔紅霉素等藥物誘導化療破壞白血病細胞,短期可有效延緩疾病進展,有75%~80%的患者可以得到有效緩解,但長期生存率仍無法保證,僅有不足30%的患者能得到治愈[3],臨床普遍認為早期診斷是延長生存率的關鍵。FMS樣酪氨酸激酶3配體(Fms-related tyrosine kinase 3 ligand,Flt3L)是具有促進造血干細胞、造血祖細胞增殖、分化功能的生長因子,其對維持造血功能十分重要,研究顯示AML患者Flt3L水平與健康人有較大差異[4];轉化生長因子β1(transforming growth factor beta 1,TGF-β1)屬于轉化生長因子超家族,同時參與構建骨髓微環境,是造血系統主要負調節因子,能抑制血細胞增殖[5];表皮生長因子受體(epidermal growth factor receptor,EGFR)是具有酪氨酸激酶活性的跨膜表面受體,在多種惡性腫瘤中高表達,其能介導腫瘤細胞增殖、轉移[6],但在AML預后研究中討論較少。本研究回顧分析我院收治的120例初診AML患者資料,探究Flt3L、TGF-β1及EGFR與患者不良預后的關系,旨在為臨床AML早期診斷提供依據。
1 材料與方法
1.1 一般資料
選取我院2018年5月至2021年5月收治的120例首次確診AML患者為觀察組,納入標準:①年齡≥18歲;②符合2016年世界衛生組織發布的《造血和淋巴組織腫瘤分類》中相關標準[7];③首次確診,入院前未接受相關治療;④臨床資料完整。排除標準:①合并重要器官器質性病變;②合并其他系統惡性腫瘤;③合并其他血液系統疾病;④隨訪過程中樣本丟失。募集同期來院體檢的100例健康志愿者為對照組。2組性別、年齡比較差異無統計學意義(P>0.05),見表1。本研究經醫院醫學倫理委員會審核批準后展開。
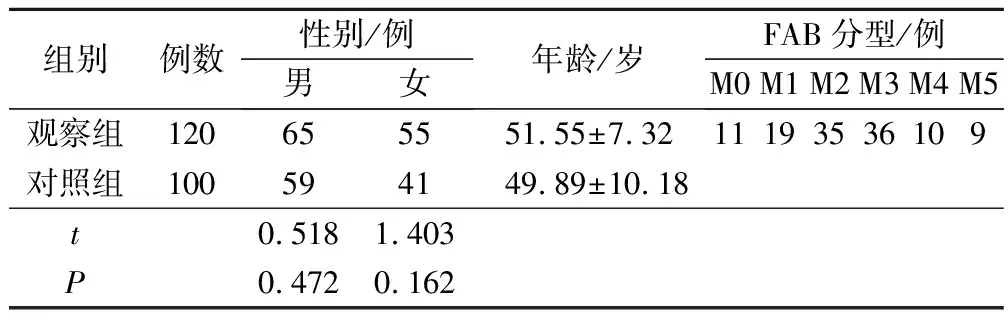
表1 一般資料比較
1.2 血清學檢驗
清晨,取觀察組AML患者及健康志愿者的空腹外周靜脈血5 ml,置入EDTA抗凝管中,以3 500 rpm離心15 min分離上層血清待測。取待測血清樣本,根據試劑盒要求,以酶聯免疫吸附反應檢測Flt3L、TGF-β1、EGFR水平。
1.3 隨訪
觀察組AML患者出院后,每月電話隨訪1次追蹤預后情況,其中預后不良判斷參考《成人急性髓系白血病中國診療指南2017版》中的AML預后危險度分級標準[8],以死亡、復發、累及≥3條染色體的復雜異常核型判定為預后不良。
1.4 觀察指標
①比較觀察組和對照組的Flt3L、TGF-β1及EGFR水平。②將觀察組根據隨訪預后情況分為良好組和不良組,比較不同預后患者的臨床資料,包括:性別、年齡、FAB分型、血小板計數、白細胞計數、血紅蛋白濃度、Flt3L、TGF-β1及EGFR水平。③采用COX模型分析指標與患者不良預后的關系,并以ROC曲線判斷Flt3L、TGF-β1及EGFR水平對AML患者不良預后的預測效能。
1.5 統計學方法
2 結果
2.1 觀察組和對照組Flt3L、TGF-β1及EGFR水平比較
觀察組Flt3L、TGF-β1水平低于對照組,EGFR水平高于對照組,差異有統計學意義(P<0.05),見表2。
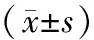
表2 觀察組和對照組Flt3L、TGF-β1及EGFR水平比較
2.2 不同預后患者臨床資料比較
觀察組患者出院后隨訪3~12個月,中位隨訪時間10個月,存活86例,死亡12例,復發22例,預后不良發生率28.33%(34/120)。不同預后患者的Flt3L、TGF-β1及EGFR水平比較,差異有統計學意義(P<0.05),見表3。
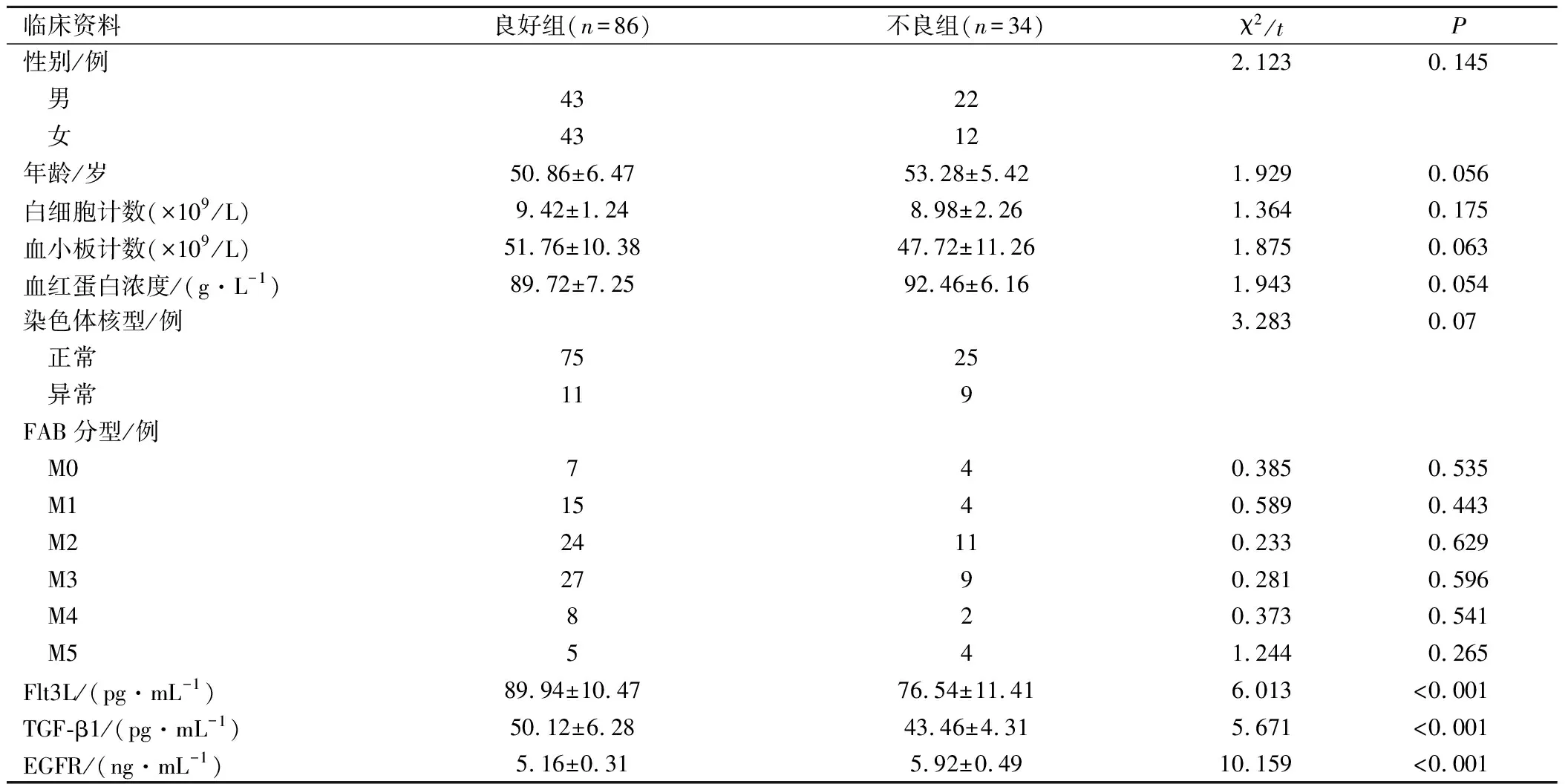
表3 不同預后患者臨床資料比較
2.3 影響AML患者預后的COX模型分析
COX模型分析顯示Flt3L、TGF-β1及EGFR水平為AML患者預后不良的獨立影響因素(P<0.05),見表4。
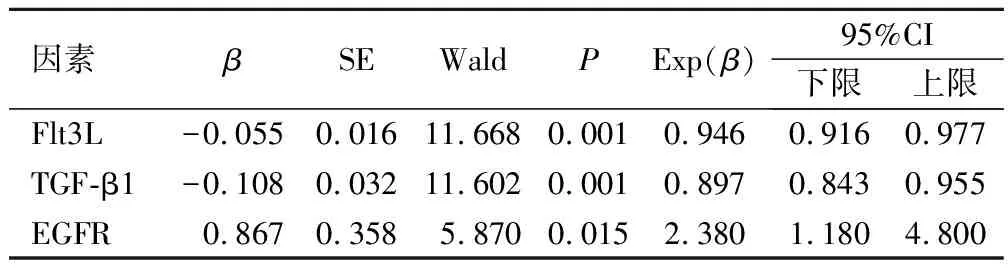
表4 影響AML患者預后的COX模型分析
2.4 Flt3L、TGF-β1及EGFR水平預測AML患者不良預后的ROC曲線
經ROC曲線分析顯示,Flt3L、TGF-β1及EGFR水平預測AML患者預后不良的AUC為0.874、0.838、0.858,見表5、圖1。
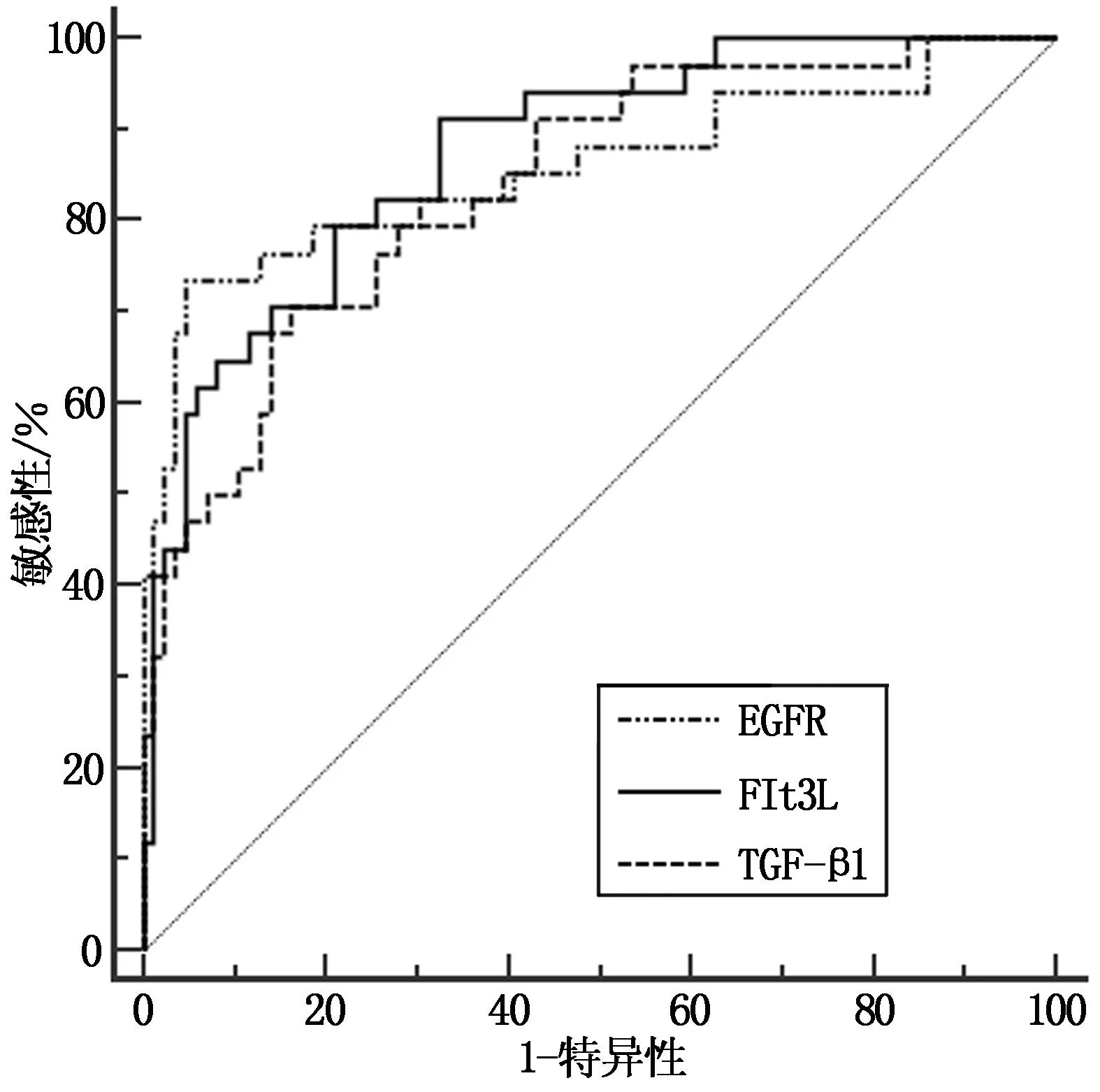
圖1 Flt3L、TGF-β1及EGFR水平預測AML患者不良預后的ROC曲線
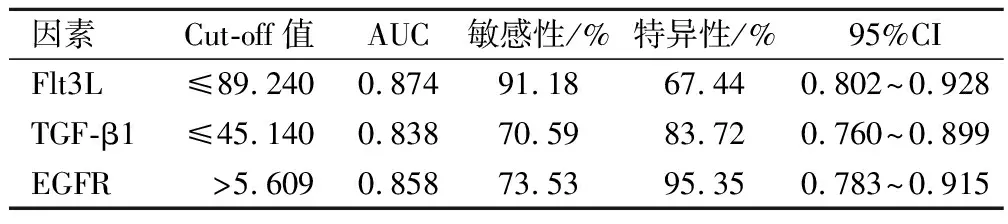
表5 Flt3L、TGF-β1及EGFR水平預測AML患者不良預后的ROC曲線參數
3 討論
AML是臨床主要白血病類型,有進展迅速、預后差、死亡率高等特點。此外,AML發病機制尚未明晰,臨床表現差異較大,早期診斷及預后判斷較為困難,因此探索多樣化的AML標志物具有重要意義。
Flt3是Ⅲ型受體酪氨酸激酶,是由Flt3基因編碼的蛋白質,其基因突變是導致AML復發的主要原因之一[9]。Flt3由993個的氨基酸組成,主要在骨髓中表達,參與造血系統。Flt3L是Flt3的配體,主要在骨髓基質干細胞中合成,其與Flt3結合時可活化Flt3的酪氨酸結構域,形成二聚體進而激活P13K/AKT和MAPK通路相關信號分子,從而發揮調控造血干細胞和造血祖細胞增殖、分化、遷移等作用[10]。本研究結果顯示AML患者Flt3L水平低于健康志愿者(P<0.05),與Milne等[11]研究結果類似,提醒早期檢測Flt3L有助于診斷AML。比較不同預后患者血清學指標顯示良好組Flt3L水平高于不良組,且COX分析顯示其為AML預后不良獨立影響因素(P<0.05),經ROC曲線分析其預測預后不良的AUC為0.874,提醒診斷早期檢測Flt3L水平可有效預測不良預后。此外,Flt3L檢測較Flt3基因檢測便捷,更有利于動態追蹤以及時采取對癥治療措施。
TGF-β1是多效應細胞因子TGF-β的同分異構體,可參與胚胎的生長發育過程,并且能通過自分泌或旁分泌的方式通過細胞表面受體途徑來調控細胞的增殖分化,此外還具有促進細胞外基質形成、免疫調節、促血管生成等作用[12]。楊麗媛等[13]觀察經TGF-β信號通路抑制劑LY364947處理的白血病細胞的細胞周期及凋亡情況,發現抑制TGF-β信號通路能夠抑制白血病細胞的體外增殖,誘導細胞凋亡,降低細胞遷移及侵襲能力。本研究結果顯示AML患者與健康人之間TGF-β1水平差異明顯,而且預后不良的AML患者TGF-β1水平更低,經COX分析及ROC曲線分析發現TGF-β1水平是AML患者預后不良獨立影響因素,存在較高的預測預后的效能,分析原因一方面是TGF-β1能抑制白血病細胞增殖,避免復發,另一方面J?ger等[14]研究發現TGF-β1能誘導健康CD34+造血干細胞及祖細胞功能抑制。
EGFR是具有酪氨酸激酶活性的受體,其能通過與EGF結合后磷酸化激活P13K/AKT和MAPK等多條通路,進而參與細胞增殖、分化、遷徙等生理過程中,常在腫瘤組織中異常激活。Mu等[15]研究顯示調節EGFR家族表達的MYO1D能通過誘導PI3K/AKT信號傳導和ERK信號通路調節AML的生長。本研究結果顯示AML患者與健康志愿者及不同預后的AML患者的EGFR水平有明顯差異,經COX及ROC曲線得知其水平可作為預后不良預測指標,提醒其參與AML疾病進展及復發。
綜上所述,不同預后的AML患者Flt3L、TGF-β1及EGFR水平不同,三者水平變化均與預后相關,且有較好預測AML患者預后的效能,檢測其水平變化有助于為制定患者早期診治方案提供參考。

