中期胃癌患者根治術后復發情況與術前LETM1、TIMP-1表達的關系研究
萬云杰 夏甘樹 王子銘 張志忠
作者單位:455000 河南省安陽市腫瘤醫院
胃癌是臨床常見消化道腫瘤,具有較高的病死率。且近年來在我國發病率不斷上升,已成為威脅我國居民生命安全的重要因素[1]。胃癌中期即Ⅱ~Ⅲ期,是治療胃癌的重要階段,胃癌根治術則是治療胃癌的主要方式。該階段采用胃癌根治術雖具有可觀的治療效果,幫助延長生存時間,而部分患者受病程、分化程度等因素影響,仍伴有胃癌復發的風險[2]。但是由于尚無有效指標可預測胃癌根治術后患者是否復發,導致難以提前制定治療計劃,控制病情發展。因此,尋找可用于預測胃癌根治術后是否復發的相關指標已成為臨床熱點話題。得益于近年來免疫組織化學等領域的發展,多種蛋白物質的出現并在腫瘤領域的廣泛應用為臨床提供新的思路,其中基質金屬蛋白酶組織抑制劑(TIMP-1)在腫瘤診斷及評估等方面獲得廣泛運用,而亮氨酸拉鏈EFhand結構域跨膜蛋白1(LETM1)亦成為評估預后等方面的重要參考方面,但是關于兩種物質聯合檢測能否用于預測中期胃癌根治術后復發狀況尚不可知,且相關報道亦較為有限,基于此,本次嘗試探究中期胃癌根治術后復發狀況與LETM1、TIMP-1聯合檢測的聯系,希望為臨床提供經驗及參考,現報告如下。
1 材料與方法
1.1 一般資料
回顧性分析2016年11月至2019年5月于我院進行胃癌根治術的Ⅱ~Ⅲ期胃癌患者102例。男性68例,女性34例;年齡43~64歲,平均年齡(54.84±3.17)歲;高分化59例,中分化31例;低分化12例;彌漫型胃癌48例,腸型39例,混合型胃癌15例;Ⅱ期61例,Ⅲ期41例。
納入標準:①經相關檢查后,符合《中國早期胃癌篩查及內鏡診治共識意見(2014年,長沙)》[3]中胃癌相關診斷標準者;②TNM分期[4]Ⅱ~Ⅲ期者;③首次確診者;④計劃行胃癌根治術者;⑤預計治療方案相似者;⑥臨床資料齊全者。
排除標準:①伴有器官功能障礙或衰竭者;②伴有凝血、免疫系統疾病者;③伴有其他部位惡性腫瘤者;④術前行其他治療者;⑤伴有其他消化系統疾病者。
1.2 方法
①亮氨酸拉鏈EFhand結構域跨膜蛋白1(LETM1)檢測:于患者胃癌根治術前,取病灶及癌旁正常組織,固定后使用石蠟進行包埋;制成3~6 μm切片后,進行水化、沖洗等操作,5~10 min/次,2~3次/片,隨后在緩沖液中提高溫度至100 ℃,維持8~10 min,后待切片冷卻行沖洗、孵育等操作,并加入LETM1抗體稀釋液100 μL,隨后在3 ℃~5 ℃環境下存放8~10 h,再加入聚合物輔助劑,再次孵育,磷酸緩沖液沖洗3次,并進行顯色、復染、沖洗等操作后進行封片,隨后進行觀察。②基質金屬蛋白酶組織抑制劑(TIMP-1)檢測:于術前取標本,固定后行包埋,制成3~6 μm切片,并ABC免疫組化染色法進行染色,使用上海羽哚生物科技有限公司生產免疫組化試劑盒觀察TIMP-1狀況。兩組檢測結果均由3名5年以上經驗的相關醫師進行評估及預測。
1.3 評估標準
LETM1評估標準:依據觀察細胞著色強度及陽性占比對LETM1進行分級,若無明顯陽性細胞或染色程度均好,可記作陰性-,觀察陽性細胞數<25%,或存在棕黃色顆粒,則記作+,若觀察內陽性細胞數量≥25%且<50%,顆粒為黃色或棕黃色,則記作++;若觀察內陽性細胞數量≥50%,且均有深棕色則記作+++。若患者觀察為-或+,則可記作LETM1低表達,若患者觀察為++或+++,則記作LETM1高表達。
TIMP-1狀況評估:觀察切片內陽性細胞數量及染色狀況,依據乳腺癌陽性切片作為陽性標準,以濃度為0.05 μmol/L的 磷酸鹽緩沖溶液進行染色作為陰性參考標準。若切片中細胞陽性率≥20%,則記作陽性,若切片中陽性細胞率<20則記作陰性病例。
復發評估標準:若術前檢查LETM1高表達或TIMP-1陽性,則可記作可能復發。
1.4 統計學方法
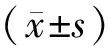
2 結果
2.1 LETM1預測結果比較
經統計,術后2年內胃癌復發57例(55.88%),未復發45例(44.12%)。其中LETM1陽性65例患者中,共有48例(73.85%)復發,17例(26.15%)未復發;LETM1陰性37例患者中共有9例(24.32%)復發,28例未復發(75.68%);TIMP-1陽性共63例,46例(73.02%)復發,17例未復發(26.98%);TIMP-1陰性共有39例,其中11例(28.21%)復發,28例未復發(71.79%),見表1。
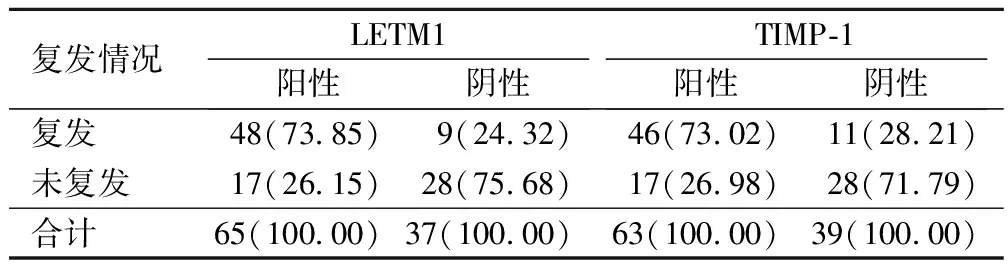
表1 LETM1預測結果比較(例,%)
2.2 聯合檢測預測效能比較
聯合檢測預測3年內復發71例(69.61%),無復發31例(30.39%),見表2、表3、圖1。
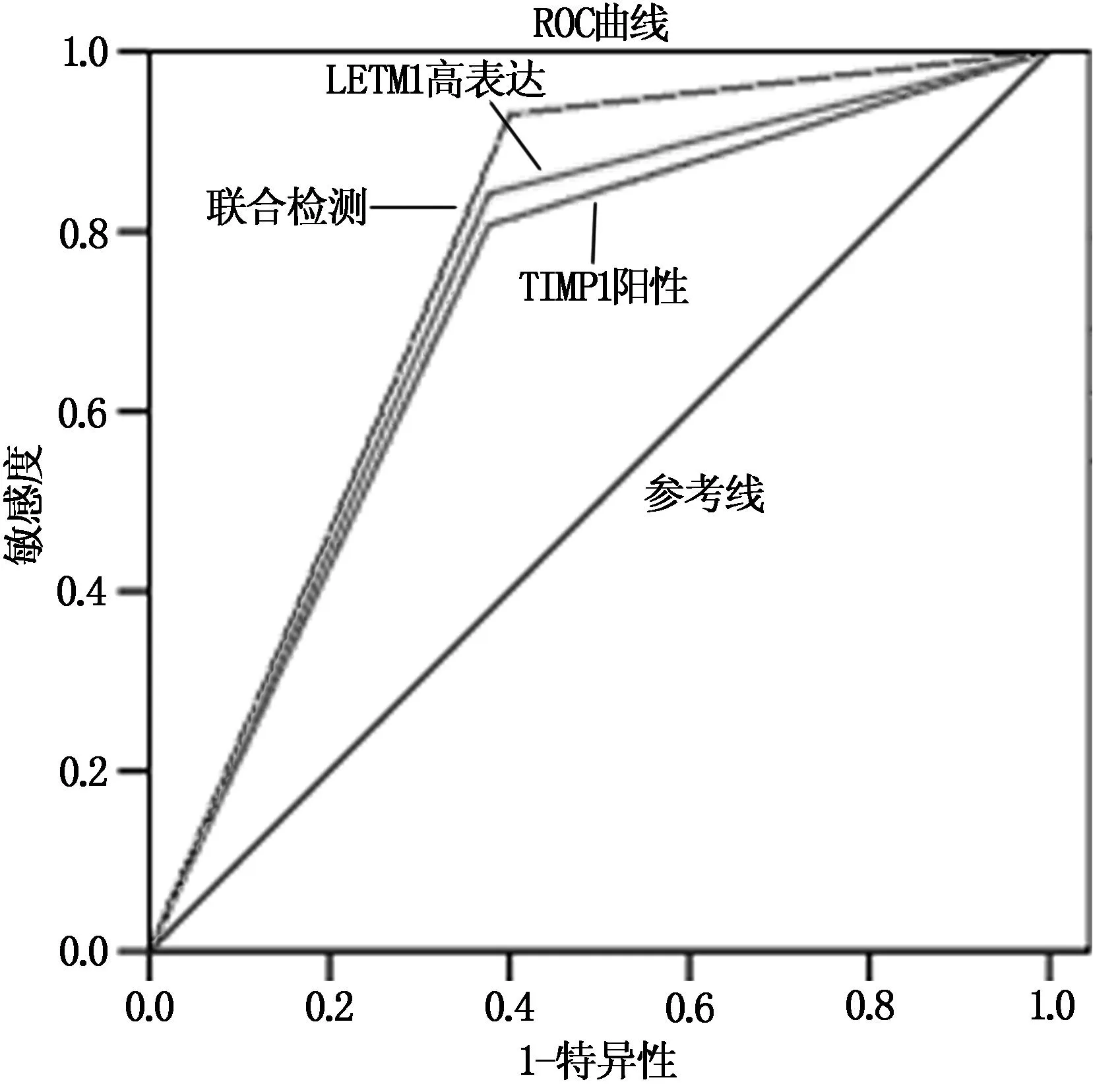
圖1 LETM1、TIMP-1預測胃癌根治術后復發狀況ROC曲線

表2 聯合檢測預測效能比較/例
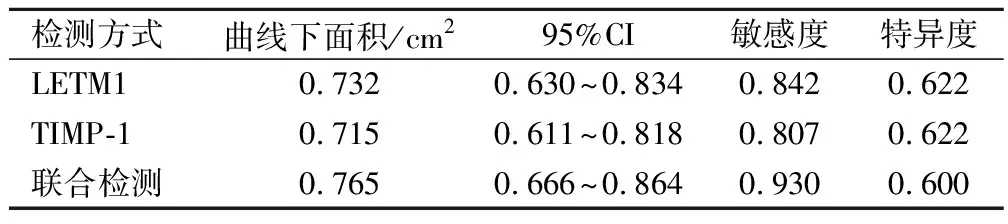
表3 LETM1、TIMP-1聯合檢測預測效能分析
2.3 不同生存時間患者相關表達比較
術后3年內,共有53例死亡,剩余生存49例。LETM1高表達共54例,其中43例(79.63%)生存時間<3年,11例(20.37%)生存時間≥3年;LETM1低表達共48例,其中10例(20.83%)生存時間<3年,38例(79.17%)生存時間≥3年;TIMP-1陽性共有62例,其中46例(74.19%)生存時間<3年,16例(25.81%)生存時間≥3年;TIMP-1陰性共有40例,其中共有7例(17.50%)生存時間<3年,33例(82.50%)生存時間≥3年。
3 討論
胃癌是臨床常見惡性腫瘤,由于臨床對于發病機制尚未完全明晰,臨床多以胃癌根治術進行治療,但是受患者病程、免疫能力、基礎疾病等因素影響,具有較高的復發率。但是對于胃癌根治術后是否復發臨床暫無有效方式進行預測。因此尋找相關指標對胃癌根治術后復發狀況進行預測并提前予以治療已成為臨床重點研究方向,伴隨近年來免疫組織化學的快速發展,LETM1、TIMP-1的出現及在多種癌癥中的廣泛應用為臨床醫護人員提供新的思路。
本次研究就兩組患者聯合預測準確率展開統計,發現聯合檢測并預測復發率具有較高準確性,推測與LETM1、TIMP-1的性質有關。LETM1蛋白屬于EF臂鈣離子結合蛋白,在機體內具有多種表達方式,亦是影響線粒體正常功能、維持線粒體形態、滲透壓的重要因素[5]。由于胃癌組織的生長發育需要較多的物質,因此胃癌組織周圍常伴有豐富的小血管,故線粒體數量同樣較高,而LETM1作為參與癌癥發生發展的重要因素及線粒體中常見物質[6],亦具有較高的表達,故復發患者中LETM1多以高表達形式呈現,表示胃癌組織仍具有充足的營養物質及再次發生的可能。劉偉昌等[7]在研究中發現,LETM1高表達可能加快中原癌基因(c-myc)等基因轉錄速度,并激活其他信號通路,達到促進惡性腫瘤細胞分裂、增殖甚至遷移的進程,進一步提高復發風險。陳樂樂等[8]學者亦在報道中指出,LETM1可通過調節PI3K/Akt信號及胃癌組織周圍細胞,參與胃癌發生發展進程,提高復發率。TIMP-1是可通過活化間質膠質酶等物質的低分子量蛋白,亦具有抑制基質金屬蛋白酶(MMPs)的功能[9]。如抑制基質金屬蛋白酶-9(MMP-9)等,MMP-9是常見腫瘤標志物,不僅可影響細胞外基質的降解進程,還可增強腫瘤浸潤能力,且與腫瘤發生發展密切相關[10],是影響復發、轉移的重要因素。TIMP-1則是以蛋白酶共價結合的形延緩甚至避免水解,達到抑制腫瘤細胞的作用[11]。許林波等[12]在報道中指出,TIMP-1可與MMP-9進行結合,降低MMP-9活性。而MMP-9活性降低可阻礙胃癌發生發展的作用,TIMP-1表達亦可能受MMP-9活性降低影響,呈現出高表達,打破TIMP-1與MMP-9的平衡,導致癌細胞侵襲能力增強,影響復發[13],而當TIMP-1處于高表達時,多以陽性進行表達,此時TIMP-1可激活血管內皮因子(VEGF)、絲裂素活化蛋白激酶(MAKP信號通路),引起腫瘤細胞增殖速度加快并在快速傳播下,進一步提高復發風險[14]。
本次研究還對聯合檢測能否預測生存時間展開比較,發現亦生存時間<3年同樣與TIMP-1陽性、LETM1高表達的有關,其根本原因是兩種檢測結果是胃癌發生發展及轉移的重要參考。一方面,TIMP-1陽性、LETM1高表達患者在胃癌根治術后具有較高的復發率,可能直接影響患者生存時間。另一方面,LETM1高表達,不僅表示胃癌組織周圍具有較充足的能量及營養,還可能因LETM1 mRNA激發部分信號通路,加快胃癌細胞增殖,增強胃癌細胞惡性生物學行為[15],進而增強胃癌對患者威脅,縮短生存時間。孫國巖等[16]學者也發現,TIMP-1表達水平較高常表示預后較差,與本次研究結論類似。
綜上所述,LETM1、TIMP-1聯合檢測可幫助中期胃癌患者預測胃癌根治術后復發狀況及生存時間,具有臨床價值。

