魚油和豆油作為飼料脂肪源對彭澤鯽親本卵巢組織轉錄組分析


摘要:為探究魚油和豆油作為飼料脂肪源對彭澤鯽親本卵巢發育的影響,將健康的初始體質量為253.78±5.34 g的彭澤鯽分別以魚油(FO)和豆油(SO)兩種脂肪源的試驗飼料飼喂 60 d。采用Illumina NovaSeq 6000高通量測序平臺對彭澤鯽親本卵巢組織進行轉錄組測序。然后將所測序列經質控,組裝后對比到GO KEGG等數據庫中進行注釋,并對其進行差異基因等的聚類分析。試驗結果顯示,FO組平均得到4.33×107條Raw Reads,原始數據過濾掉測序接頭序列、未知堿基序列、低質量序列后平均得到4.19×107條Clean Reads,堿基數6.50Gb;SO組平均得到4.30×107條Raw Reads,原始數據過濾掉測序接頭序列、未知堿基序列、低質量序列后平均得到4.15×107條Clean Reads,堿基數6.45Gb。經過純化后,Q20比例在97.25%以上,Q30比例在91.55%以上。在SO組相對FO組比較中,按照qlt;0.05和|log2FC(SO/FO)|gt;1的篩選條件,得到425個差異表達基因(DEGs),顯著上調基因有290個,顯著下調基因有135個,共篩選出7個性腺發育相關基因,其中6個基因顯著上調,1個基因顯著下調。對DEGs進行GO功能分析表明,差異表達的基因對比到GO數據庫共898個GO term,這些term分別對應細胞組分,分子功能以及生物過程等三大類,差異基因主要涉及到生物調控、細胞過程、代謝過程和刺激反應等。通過KEGG富集分析結果表明,兩組樣本之間的差異表達基因富集194條通路,主要涉及細胞進程、環境信息處理、遺傳信息處理、新陳代謝、有機系統等五大類代謝通路。其中細胞生長和死亡、信號分子和相互作用、氨基酸代謝和脂類代謝等富集顯著。
關鍵詞:彭澤鯽親本;脂肪源;轉錄組測序;差異表達基因;KEGG富集
中圖分類號:S917.4 文獻標識碼:A
基金項目:江西省重點研發計劃(20203BBF63045);江西省現代農業產業技術體系(JXARS-03);江西省農牧漁業科研指導性課題(2023-35)
作者簡介:肖俊(1991—),男,水產師,碩士,研究方向:水產養殖。E-mail:874370756@qq.com
*通訊作者:丁立云(1981—),男,研究員,博士,研究方向:水產養殖與飼料營養。E-mail:dingliyun2008@163.com
彭澤鯽(Carassius auratus var.Pengze)是我國首個直接從野生鯽魚中人工選育出的養殖新品種,具有生長快、抗病能力強、耐低氧、肉質鮮嫩等特點[1]。自選育以來,彭澤鯽的養殖發展迅速,取得巨大的經濟效益和社會效益[2]。2023年,彭澤鯽被推選為江西農產品“二十大區域公用品牌”,彭澤鯽科技小院獲批全國科技小院[3]。苗種質量是商業化水產養殖發展的關鍵指標之一,近年來,人們對彭澤鯽的需求量急劇增加,彭澤鯽產量不能夠滿足市場需求,勢必就要擴大彭澤鯽的養殖規模,但彭澤鯽魚苗生產養殖基地很少,苗種的質量和來源就得不到保障,長此以往,會導致優質苗種退化[4]。
脂肪是魚類機體不可或缺的營養物質,其提供的必需脂肪酸對魚類生長和繁殖發育有著重要作用[5],魚油作為傳統水產飼料的常用脂肪源,因其富含長鏈多不飽脂肪酸(Long chain polyunsaturated fatty acids,LC-PUFA),成為水產飼料中最理想的脂肪源[6]。LC-PUFAs,特別是C22:6n-3(DHA)、C20:5n-3(EPA)和C20:4n-6(ARA),是卵黃蛋白原和胚胎細胞生物膜的關鍵成分之一[7]。脂肪源的營養價值在很大程度上取決于脂肪酸的不飽和程度及各種脂肪酸的比例。如添加富含n-6和n-3多不飽和脂肪酸的飼料對雌鯉(Cyprinus carpio)的性腺成熟和繁殖性能至關重要[6]。羅非魚(Oreochromis niloticus)攝食富含LNA的飼料可以在性腺中檢測到濃度遠高于攝食魚油組的n-3 PUFAs[7]。豆油對提高中華絨螯蟹(Eriocheir sinensis)產卵力的效果優于魚油[8]。
卵巢是魚類繁殖不可缺少的生殖器官,選用魚油和豆油作為彭澤鯽親本飼料的脂肪源,研究其對彭澤鯽親本卵巢發育關鍵基因及相關信號通路具有一定的意義。隨著高通量測序技術的普及,利用轉錄組測序全面快速的獲得卵巢組織幾乎全部轉錄本序列信息,挖掘與性腺發育相關的候選基因是一種解析性腺發育機制的有效途徑[9]。高通量測序技術在動物組織中挖掘差異表達基因和富集代謝通路等方面的研究較為豐富。然而,從營養角度出發的研究卻幾乎沒有。特別是針對彭澤鯽親本的研究尚未有過報道。因此,本研究通過使用轉錄組測序技術探究飼料中添加魚油和豆油對彭澤鯽親本的卵巢組織差異表達基因(Differentially expressed genes,DEGs)轉錄表達情況,并從中篩選出性腺發育關鍵基因及相關信號通路。旨在為彭澤鯽親本生殖發育及相關機制的闡明奠定基礎。
1 材料與方法
1.1 試驗魚及飼養管理
彭澤鯽親本購買于九江良盛生態農業發展有限公司,正式試驗開始前在循環水系統中用基礎飼料暫養4周,以適應養殖環境和飼料規格。本研究選取了健康且有活力的彭澤鯽親本90尾,初始體質量為(253.78±5.34)g。將其平均分成2組,每組3個平行,每個平行15尾魚,養殖周期為60 d。投喂時間設定為每天的9∶00和17∶00,對試驗魚進行飽食投喂。養殖試驗水質進行嚴格把控:水溫(20±5) ℃,溶解氧≥7 mg/L,pH 7.53±0.12,氨氮和亞硝酸濃度均≤0.1 mg/L。光周期遵循自然周期。
1.2 試驗飼料
飼料的蛋白質源選擇進口魚粉、豆粕和谷朊粉,脂肪源選擇魚油(FO)和豆油(SO),將FO∶SO按5∶0和0∶5的比例配置成2種等氮等能試驗飼料。經過逐級混勻的方式混合均勻后,將顆粒飼料制粒成直徑為2 mm的大小,并在晾干后放置于-20 ℃冰箱保存。表1是基礎飼料配方和營養成分,表2是各個試驗組飼料的脂肪酸組成。
1.3 樣品采集
飼養實驗結束后,饑餓24 h,隨即將魚置冰盤內解剖,取出卵巢組織,用凍存管分裝,并迅速置于液氮中,然后于-70 ℃冰箱保存,以備總RNA提取。
1.4 試驗方法
1.4.1" RNA提取與檢測,文庫構建與高通量測序
使用Trizol試劑盒(Invitrogen,Carlsbad,CA,USA)按照制造商的方案從卵巢組織中提取總RNA。使用安捷倫2100生物分析儀(Agilent Technologies,Palo Alto,CA,USA)和RNase-free瓊脂糖凝膠電泳檢測總RNA的質量和完整性。文庫構建和高通量測序(采用Illumina NovaSeq 6000)由華大基因(華大基因科技股份有限公司,深圳)完成。
1.4.2" 數據過濾
測序得到的raw data使用SOA Pnuke(v1.5.6)進行過濾,過濾掉包含接頭的reads(接頭污染)、未知堿基N含量大于5%的reads、低質量的reads(質量值低于15的堿基占該reads總堿基數的比例大于20%的reads為低質量的reads),得到clean data。后續使用Dr.Tom多組學數據挖掘系進行數據分析、繪圖及挖掘。
1.4.3" 差異表達基因分析
使用HISAT2(v2.1.0)軟件將clean data比對到參考基因組上。使用Bowtie2(v2.3.4.3)將clean data比對到參考基因集上。使用RSEM(v1.3.1)軟件進行基因表達定量,并使用pheatmap(v1.0.8)繪制基因在不同樣本中的表達量聚類熱圖。使用DESeq2(v1.4.5)進行差異基因檢測,首先對讀取次數進行歸一化處理,然后根據模型計算假設檢驗概率(p-value),最后進行多個假設檢驗校正,得到FDR值(1 discovery rate)。根據差異分析結果,篩選qlt;0.05和|log2FC(SO/FO)|gt;1基因為差異表達基因(DEGs),q是多重假設檢驗校正后的P值,FC為差異倍數(Fold change)。進一步深入探索與表型變化相關的基因功能,使用Phyper對差異基因進行GO及KEGG富集分析,以 Qvalue≤0.05為閾值,滿足此條件的定義為在候選基因中顯著富集。根據DEGs進行火山圖分析、KEGG通路富集分析、GO功能富集分析。
2 結果與分析
2.1 轉錄組測序結果
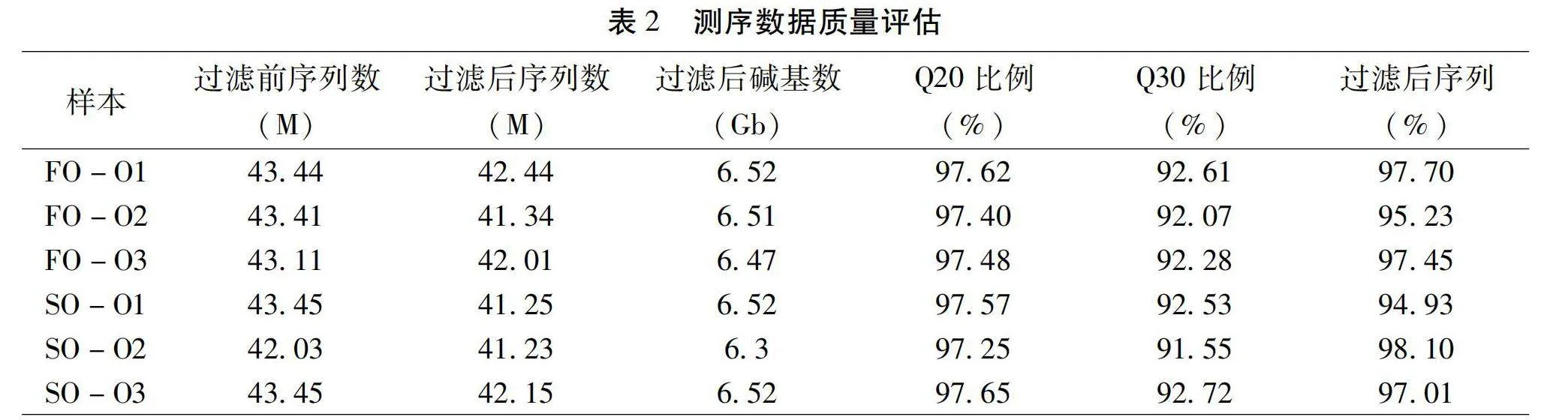
根據飼料中脂肪源不同,將其分為FO和SO兩組,每組三個重復,取樣卵巢組織(ovarian,O)后測序共得到6組轉錄組數據,FO組三個重復平均得到4.33×107條Raw Reads,原始數據過濾掉測序接頭序列、未知堿基序列、低質量序列后平均得到4.19×107條Clean Reads,堿基數6.50Gb;SO組三個重復平均得到4.30×107條Raw Reads,原始數據過濾掉測序接頭序列、未知堿基序列、低質量序列后平均得到4.15×107條Clean Reads,堿基數6.45Gb。經過純化后,6個轉錄組數據Q20比例均在97.25%以上,Q30比例均在91.55%以上,過濾后Reads比例均在 94.93%以上。這些結果表明,測序數據具有足夠的數量和高質量,可以確保準確的序列裝配和足夠的轉錄組覆蓋率,可進一步進行后續分析。各實驗組測序數據見表2。
2.2" 差異表達基因分析
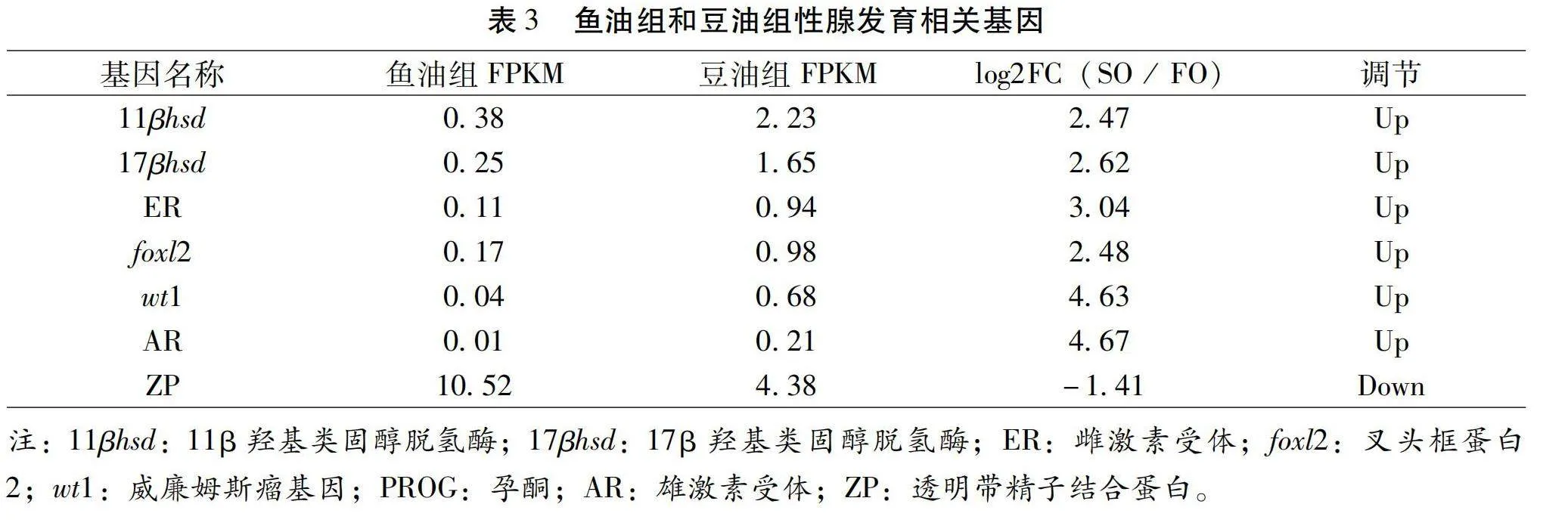
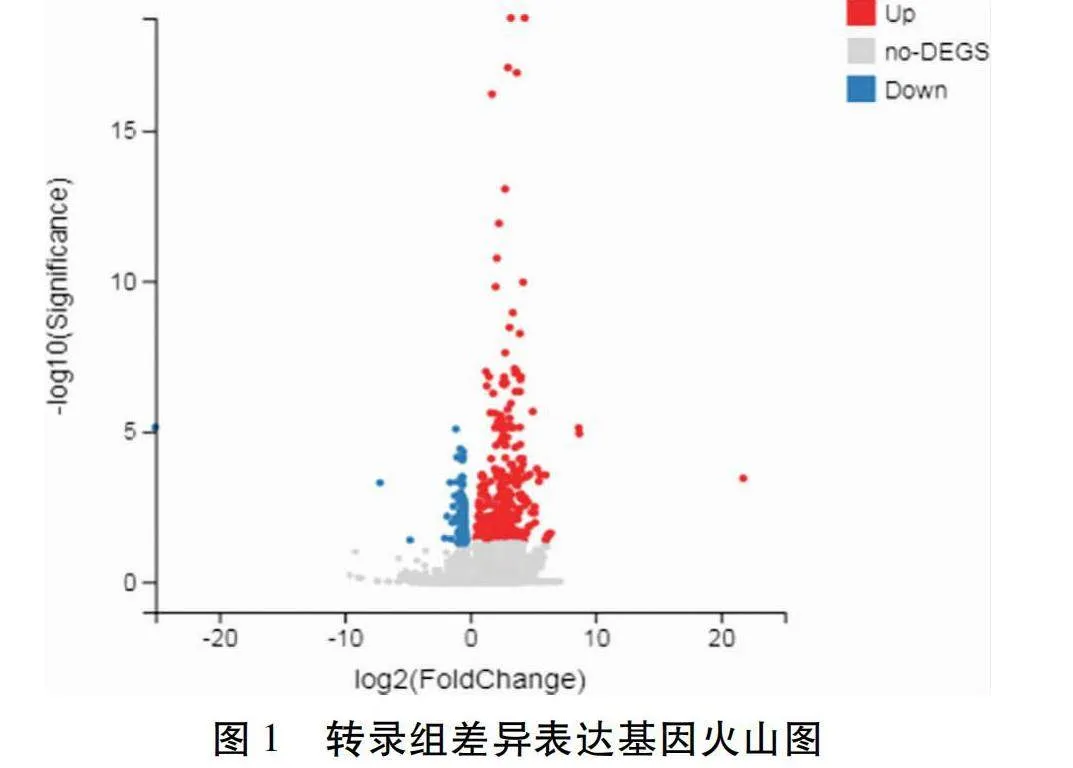
在SO組相對FO組比較中,按照qlt;0.05和|log2FC(SO/FO)|gt;1的篩選條件,在兩組中檢測出425個DEGs,其中上調DEG 290個,下調DEG 135個(圖1)。在這些DEG中,篩選出了一些性腺發育相關基因(表3),如11β羥基類固醇脫氫酶(11β-hydroxysteroid dehydrogenase,11βhsd)、17β羥基類固醇脫氫酶(11β-hydroxysteroid dehydrogenase,17βhsd)、雌激素受體(Estrogen Receptor,ER)、叉頭框蛋白2(Forkhead transcriptional factor 2,foxl2),威廉姆斯瘤基因(Wilms 1,wt1)、雄激素受體(Androgen Receptor,AR)和透明帶精子結合蛋白(Zona pellucida,ZP)等。
2.3" GO功能富集分析
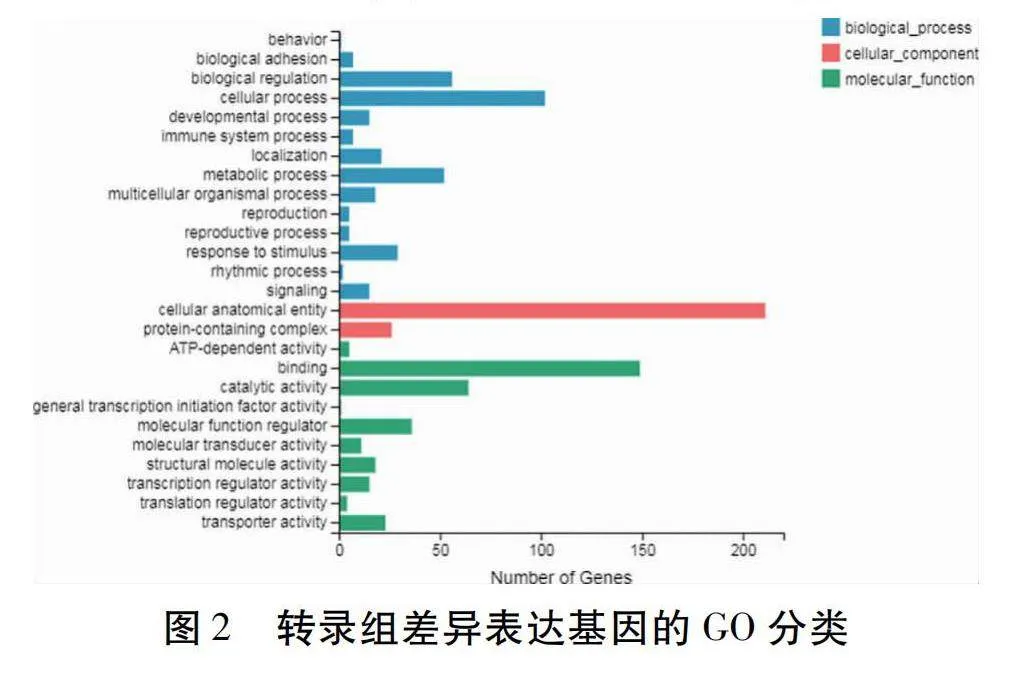
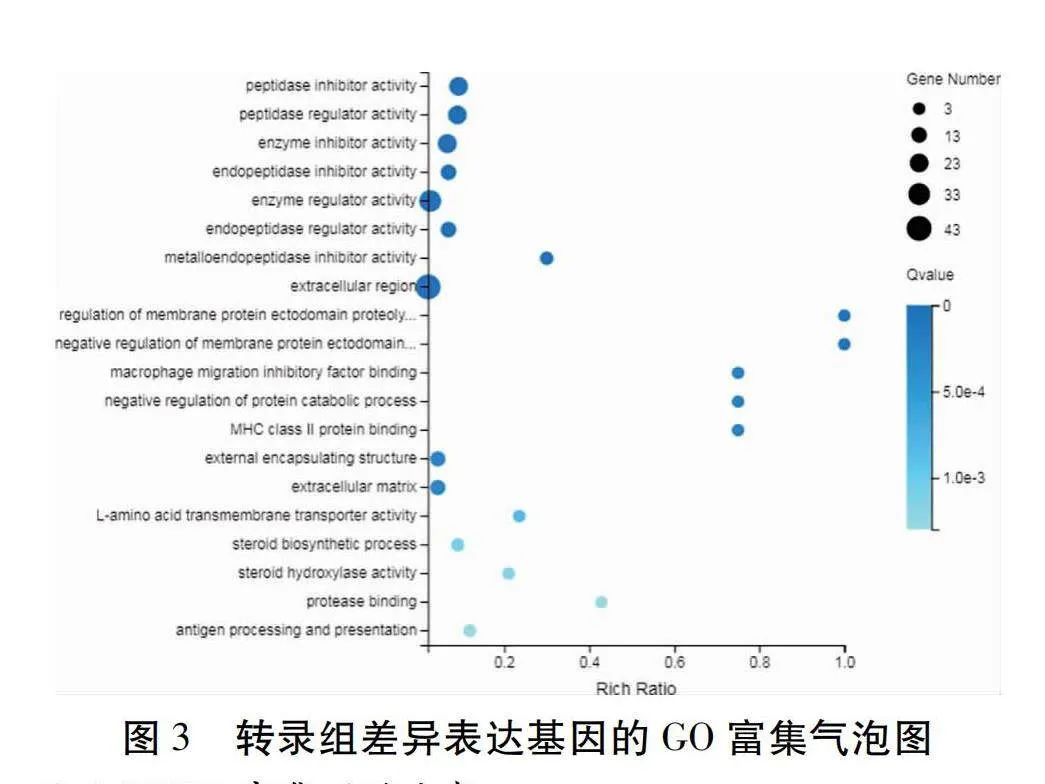
在SO組相對FO組的比較中用GO術語注釋到的425個DEGs進行GO(Gene Ontology)功能富集分析。如圖2所示,DEGs分別富集在生物過程(Biological process)、細胞組分(Cellular component)及分子功能(Molecular function) 3個類別中,GO term分別為335、237和326個。其中在生物過程功能類型中主要富集在生物調控(Biological regulation)、細胞過程(Cellular process)、代謝過程(Metabolic process)和刺激反應(Response to stimulus);在細胞組分功能類型中主要富集在細胞構造(Cellular anatomical entity)和蛋白復合物(Protein-containing complex);在分子功能類型中主要富集在結合(Binding)、催化活性(Catalytic activity)、分子功能調節(Molecular function regulator)和轉運活性(Transporter activity)。根據DEGs富集氣泡圖可知(圖3),胞外區(Extracellular region)和酶調節因子活性(Enzyme regulator activity)是包含DEGs最多的類別,其次還有肽酶抑制劑活性(Peptidase inhibitor activity)、肽酶調節活性(Peptidase regulator activity)、酶抑制劑活性(Enzyme inhibitor activity)和內肽酶抑制劑活性(Endopeptidase inhibitor activity)等。
2.4" KEGG富集通路分析
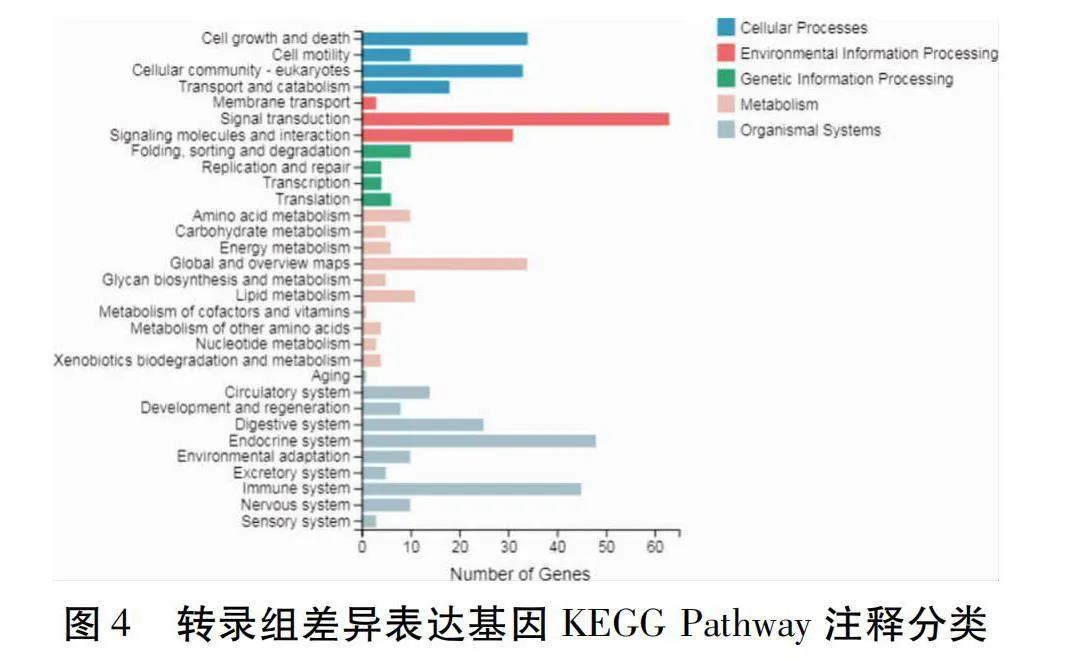
在SO組相對于FO組的比較中所有的DEGs映射到KEGG(Kyoto Encyclopedia of Genes and Genomes)通路數據庫,進行通路富集分析。如圖4所示,SO組相對FO組的比較中涉及到的通路有194條,這些DEGs分別富集在細胞進程(Cellular Processes)、環境信息處理(Environmental Information Processing)、基因信息處理(Genetic Information Processing)、新陳代謝(Metabolism)和有機體系統(Organismal Systems)5個類別中。其中細胞進程DEGs較多的通路有細胞生長和死亡(Cell growth and death)和細胞群落-真核生物(Cellular community-eukaryotes);環境信息處理DEGs較多的通路有信號轉導(Signal transduction)和信號分子和相互作用(Signaling molecules and interaction);基因信息處理DEGs較多的通路有折疊分類和退化(Folding,sorting and degradation)和翻譯(Translation);新陳代謝DEGs較多的通路有全局和總覽圖(Global and overview maps)、脂代謝(Lipid metabolism)和氨基酸代謝(Amino acid metabolism);有機體系統DEGs較多的通路有內分泌系統(Endocrine system)、免疫系統(Immune system)、消化系統(Digestive system)和循環系統(Circulatory system)。從KEGG富集分析中選取富集最顯著的20個通路(Pathway),做KEGG富集氣泡圖。由圖5可知,DEGs KEGG Pathway主要富集在黏著斑(Focal adhesion)、PI3K-Akt信號通路(PI3K-Akt signaling pathway)、ECM-受體互作(ECM-receptor interaction)、蛋白質的消化和吸收(Protein digestion and absorption)和松弛素信號通路(Relaxin signaling pathway)中。
3 討論
高通量的轉錄組測序已經成為人們挖掘新基因的有效手段,采用該技術對水產動物卵巢發育過程的研究,能幫助更好地了解卵巢發育這一生理過程中機體內在的轉錄調控變化,以便更積極主動地去解決生產上因卵巢發育而產生的各類問題。吳丹等[10]通過比較綠鰭馬面鲀精巢和卵巢的轉錄組表達差異,初步闡明了精巢和卵巢的基因表達特征。Zhou等[11]利用轉錄組測序技術研究不同大豆磷脂含量對三疣梭子蟹(Portunus trituberculatus)卵巢組織的影響,并發掘出其調控卵巢發育的功能性基因和相關通路。李青等[12]對鯽魚血液、肝臟、卵巢組織轉錄組比較分析為進一步克隆和挖掘鯽魚功能基因、多態性檢測及群體遺傳多樣性分析等方面研究奠定基礎。
高通量測序的準確性在于堿基質量值和Reads的數量和質量。在本研究中,FO組和SO組的平均Reads總數分別為4.33×107個和4.30×107個,堿基質量值Q30的比例均達到了91.55%。比對測序Reads和參考基因組序列是后續分析的關鍵一步,只有比對成功的序列才能被用于后續分析。本研究中,FO組的比對效率為83.29%,SO組的比對效率為81.12%,與之前的研究結果一致[13-15],表明選用的參考基因組具備了進行后續分析的必要條件。隨后,使用BLAST軟件將測序基因與Nr、GO、KEGG數據庫進行比對,為基因提供全面的注釋信息。
本研究從彭澤鯽親本卵巢組織的DEGs中篩選出7個與性腺發育相關的基因。foxl2參與了卵巢分化過程以及其他發育過程。先前的研究已經在南方鲇(Clarias gariepinus)[16]、稀有鮈鯽(Gobiocypris rarus)[17]、刀魚(Coilia nasus)[18]和黃鱔(Monopterus albus)[19]等魚類中進行過基因克隆和鑒定工作,結果顯示foxl2在各自性腺中的表達量要高于其他組織,而在卵巢中的表達量也要高于精巢。因此,foxl2已被證明在雌性發育過程中起關鍵作用,是目前已知的脊椎動物卵巢發育和分化的一個關鍵啟動基因[20]。wt1在魚類的腎臟和性腺中表達,可能通過直接或間接調節foxl2的表達來影響雌激素的生成。已從黃鱔[21]和半滑舌鰨(Cynoglossus semilaevis)[22]等魚類中克隆出wt1基因,發現它在性腺、腎、腸、脾和心臟等組織中均有表達。半滑舌鰨性腺中wt1的表達量明顯高于其他組織,而黃鱔中wt1在雌性、間性和雄性性腺中的表達量在不同時期呈現先升高后降低的趨勢。此外,在半滑舌鰨中,雄魚的wt1表達量明顯高于雌魚,而雌魚的表達量高于偽雄魚。這些結果表明wt1對于性腺分化過程可能不起決定性作用。11βHSD是一種與糖皮質激素代謝相關的酶,在稀有鮈鯽[23]、斑馬魚(Danio rerio)[24]和南方鲇[25]等魚類中已被克隆。17βHSD在雌魚體內起到重要作用,能夠將睪酮轉化為雌激素E2[26],在精巢中則可轉化為雄魚特有的11-KT[27],17βHSD是雌素酮(Estrone)和E2互相轉化的催化劑。此外,17βHSD在雌雄虹鱒魚中也表現出特異性表達,并在不同時期的肝臟中表達出現差異[28]。這些激素的轉化過程是通過特定的代謝酶催化進行的,其中17βHSD在雌魚體內起到至關重要的作用[29-30]。未來的研究熱點必將聚焦于這些激素代謝酶基因在性腺分化中的功能,以期更深入了解這些基因在彭澤鯽等魚類中的作用。zp在生殖相關生命活動中扮演重要角色,卵母細胞能夠合成ZP蛋白且在體內無卵母細胞存在時也能合成。硬骨魚中,ZP蛋白主要在肝臟和卵巢中合成,表達模式有卵巢特異性、肝臟特異性和共同表達[31]。青鳉(Oryziaslatipes)[32]中,雌激素能調控肝臟中ZP蛋白的合成;而斑馬魚卵巢ZP蛋白的表達受雌激素控制影響較小[33]。zp的表達與卵細胞的發育密切相關,青鳉中卵巢特異性表達的zp在卵細胞直徑達到45 μm時可檢測到表達;而鯉中,zp在卵黃囊泡階段就有高水平表達。雄性青鳉肝臟中的zp在正常情況下幾乎不表達,但在雌激素作用下會被誘導表達[34]。魚體內存在三種雌激素受體(ERα、ERβ1和ERβ2),這些受體參與調節魚類的生殖發育。ERα最初是從虹鱒(Oncorhynchus mykiss)中克隆得到的,在對其后續的研究中,又發現了ERα的另一個亞型ERα2[35]。隨后ERβ也被從不同種類的魚中克隆。此外,除了虹鱒外,其他魚類如團頭魴(Megalobrama amblycephala)[36]、許氏平鲉(Sebastes schlegelii)[37]、尼羅羅非魚(Nile tilapia)[38]和日本鰻鱺(Anguilla japonica)[39]等也報道存在ER。雄激素通過與AR結合在靶細胞膜上或核內發揮作用,使得信號傳入細胞內產生一系列生物學效應。AR同樣是一種配體依賴型的轉錄因子,最早在非洲爪蟾(Xenopus laevis)[31]的報道中發現AR存在2種亞型(ARα和ARβ),而在一些魚類如鯽和彭澤鯽中只存在一種亞型[40]。AR介導的信號途徑對雄性胚胎發育、雄性性成熟和雄激素依賴性靶組織的發育是必要的。
4 結論
本研究結果顯示,SO組相對于FO組的比較中,卵巢組織中11βhsd、17βhsd、ER、foxl2、wt1和AR共6個性腺發育相關基因顯著上調,唯獨zp基因表達顯著下調。這表明與添加魚油相比,添加豆油更有助于促進彭澤鯽親本卵巢的發育。因此,本試驗為進一步探究不同脂肪源對彭澤鯽生長發育的分子調控機制奠定了良好的基礎。
參考文獻
[1]Ding L,Chen W,Fu H,et al.Estimation of the optimum dietary protein to lipid ratio in juvenile Pengze Crucian Carp(Carassius auratus var.Pengze)[J].Aquaculture Nutrition,2022,2022(1):2485134.
[2]肖俊,丁立云,姚遠,等.彭澤鯽輪捕輪放養殖模式試驗 [J].中國水產,2023(5):69-72.
[3]中共彭澤縣委宣傳部 彭澤縣融媒體中心.彭澤 揚帆起航風正勁 砥礪前行譜新篇[N].九江日報,2024-01-05(005).
[4]葉本祥,廖亞明,丁立云.彭澤鯽養殖現狀及制約產業發展的原因分析 [J].江西水產科技,2021(3):3-4.
[5]Fei S,Chen Z,Duan Y,et al.Growth,reproduction,fatty acid profiles and offspring performance of broodstock yellow catfish Pelteobagrus fulvidraco fed diets with different lipid levels[J].Aquaculture,2024,580(P1):740273.
[6]劉洋,高堅,曹小娟,等.不同脂肪源對細鱗鮭生長、脂質代謝及抗氧化性能的影響 [J].水生生物學報,2018,42(3):533-41.
[7]Sui L Y,Sun H X,Wu X G,et al.Effect of dietary HUFA on tissue fatty acid composition and reproductive performance of Chinese mitten crab Eriocheir sinensis(H.Milne-Edwards) broodstock [J].Aquaculture International,2011,19(2):269-282.
[8]Wen X B,Chen L Q,Zhou Z L,et al.Reproduction response of Chinese mitten-handed crab(Eriocheir sinensis) fed different sources of dietary lipid [J].Comparative Biochemistry and Physiology Part A:Molecular amp; Integrative Physiology,2002,131(3):675-681.
[9]李鵬琛,劉炳正,蘇唯一,等.基于全長轉錄組測序挖掘中間球海膽(Strongylocentrotus intermedius)性腺發育相關基因 [J].基因組學與應用生物學,2022,41(Z2):2062-2075.
[10]吳丹,陳四清,柯翎,等.綠鰭馬面鲀雌雄性腺轉錄組比較分析 [J/OL].漁業科學進展:1-14[2024-05-07].
[11]Zhou Q C,Shi B,Jiao L F,et al.Hepatopancreas and ovarian transcriptome response to different dietary soybean lecithin levels in Portunus trituberculatus [J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2019,31:100600.
[12]李青,何斌,陳群利,等.鯽魚血液、肝臟、卵巢組織轉錄組比較分析 [J].江蘇農業科學,2022,50(3):28-35+48.
[13]劉鼎瑞,歐陽號鋒,黃景軍,等.基于轉錄組測序解析翹嘴鱖適應人工飼料的分子機制 [J].海南熱帶海洋學院學報,2022,29(5):1-11.
[14]黃思婕,周艷,魏亞麗,等.雌雄羅非魚對持續性高溫的響應機制 [J].上海海洋大學學報,2021,30(3):426-434.
[15]劉思嘉,田菲,張存芳,等.鯉在低溫脅迫下肝胰腺轉錄組測序分析 [J].生物技術通報,2018,34(11):168-178.
[16]Sridevi P,Senthilkumaran B.Cloning and differential expression of FOXL2 during ovarian development and recrudescence of the catfish,Clarias gariepinus [J].General and Comparative Endocrinology,2011,174(3):259-268.
[17]Wang J,Liu X,Wang H,et al.Expression of two cytochrome P450 aromatase genes is regulated by endocrine disrupting chemicals in rare minnow Gobiocypris rarus juveniles [J].Comparative Biochemistry and Physiology Part C:Toxicology amp; Pharmacology,2010,152(3):313-320.
[18]Fang D A,Yang X J,Feng X,et al.FoxL2 combined with Cyp19a1a regulate the spawning upstream migration in Coilia nasus[J].Gene,2019,710:307-315.
[19]He Z,Li Y,Wu Y,et al.Differentiation and morphogenesis of the ovary and expression of gonadal development-related genes in the protogynous hermaphroditic ricefield eel Monopterus albus[J].Journal of Fish Biology,2014,85(5):1381-1394.
[20]Raghuveer K,Senthilkumaran B,Sudhakumari C C,et al.Dimorphic expression of various transcription factor and steroidogenic enzyme genes during gonadal ontogeny in the air-breathing catfish,Clarias gariepinus[J].Sexual Development,2011,5(4):213-223.
[21]胡青,楊嬌艷,高宇,等.黃鱔WT1基因序列分析及在性腺發育過程中的表達 [J].華中農業大學學報,2014,33(1):73-79.
[22]張紅,陳松林,劉洋,等.半滑舌鰨WT1a基因的克隆與性別分化期的表達分析 [J].中國水產科學,2014,21(1):26-36.
[23]Liu S,Wang L,Qin F,et al.Gonadal development and transcript profiling of steroidogenic enzymes in response to 17α-methyltestosterone in the rare minnow Gobiocypris rarus [J].Journal of Steroid Biochemistry and Molecular Biology,2014,143:223-232.
[24]Alderman S L,Vijayan M M.11-Hydroxysteroid dehydrogenase type 2 in zebrafish brain:a functional role in hypothalamus-pituitary-interrenal axis regulation [J].Journal of Endocrinology,2012,215(3):393.
[25]Rasheeda M,Kagawa H,Kirubagaran R,et al.Cloning,expression and enzyme activity analysis of testicular 11β-hydroxysteroid dehydrogenase during seasonal cycle and after hCG induction in air-breathing catfish Clarias gariepinus [J].The Journal of steroid biochemistry and molecular biology,2010,120(1):1-10.
[26]Callard G V,Tarrant A M,Novillo A,et al.Evolutionary origins of the estrogen signaling system:insights from amphioxus [J].Journal of Steroid Biochemistry and Molecular Biology,2011,127(3-5):176-188.
[27]Baker M.11 [beta]-hydroxysteroid dehydrogenase-type 2 evolved from an ancestral 17 [beta]-hydroxysteroid dehydrogenase-type 2 [J].Nature Precedings,2010:1-19.
[28]Castro L F C,Rocha M J,Lobo-Da-Cunha A,et al.The 17β-hydroxysteroid dehydrogenase 4:Gender-specific and seasonal gene expression in the liver of brown trout(Salmo trutta f.fario) [J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2009,153(2):157-164.
[29]Tokarz J,Mindnich R,Norton W,et al.Discovery of a novel enzyme mediating glucocorticoid catabolism in fish:20beta-hydroxysteroid dehydrogenase type 2 [J].Molecular and Cellular Endocrinology,2012,349(2):202-213.
[30]Tokarz J,Norton W,M?ller G,et al.Zebra fish 20β-hydroxysteroid dehydrogenase type 2 is important for glucocorticoid catabolism in stress response [J].PLoS One,2017,8(1):e54851.
[31]鄭堯,陳家長,邴旭文,等.彭澤鯽F1、F2代雌雄魚Vtg B和ZP2表達及卵黃蛋白原含量差異研究 [J].水產科學,2016,35(4):370-375.
[32]Yokokawa R,Watanabe K,Kanda S,et al.Egg envelope formation of medaka Oryzias latipes requires ZP proteins originating from both the liver and ovary [J].The Journal of Biological Chemistry,2023,299(4):104600.
[33]Liu X J,Wang H,Gong Z Y.Tandem-repeated Zebrafish zp3 genes possess oocyte-specific promoters and are insensitive to estrogen induction[J].Biology of Reproduction,2006,74(6):1016-1025.
[34]鄭堯,王在照,陳家長.調控魚類性腺分化基因的研究進展 [J].水生生物學報,2015,39(4):798-810.
[35]Segner H,Casanova-Nakayama A,Kase R,et al.Impact of environmental estrogens on Yfish considering the diversity of estrogen signaling [J].General and Comparative Endocrinology,2013,191:190-201.
[36]劉莉芳,羅麗飛,陳宇龍,等.雌激素受體基因調控團頭魴生長和性腺發育的初步研究 [J].華中農業大學學報,2022,41(1):179-185.
[37]徐小杰,王學穎,周莉,等.許氏平鲉(Sebastes schlegelii)卵子發生及妊娠過程中雌激素、芳香化酶及其受體的變化規律 [J].海洋與湖沼,2021,52(5):1236-1243.
[38]Yan L,Feng H,Wang F,et al.Establishment of three estrogen receptors(esr1,esr2a,esr2b) knockout lines for functional study in Nile tilapia[J].The Journal of Steroid Biochemistry and Molecular Biology,2019,191:105379.
[39]Hyeon J Y,Hur S P,Kim B H,et al.Involvement of estrogen and its receptors in morphological changes in the eyes of the Japanese eel,Anguilla japonica,in the process of artificially-induced maturation[J].Cells,2019,8(4):310.
[40]Zheng Y,Wang L,Li M,et al.Molecular characterization of five steroid receptors from pengze crucian carp and their expression profiles of juveniles in response to 17α-ethinylestradiol and 17α-methyltestosterone [J].General and Comparative Endocrinology,2013,191:113-122.

