玉米赤霉烯酮和脫氧雪腐鐮刀菌烯醇雙特異性抗體的制備及檢測方法構建
王云云, 石廣革, 孫嘉笛, 陸 欣, 紀 劍, 孫秀蘭*,
(1.江南大學 食品學院,江蘇 無錫 214122;2.菏澤市食品藥品檢驗檢測研究院,山東 菏澤 274000)
真菌毒素是一類由曲霉菌、鐮刀菌、青霉菌等絲狀真菌產生的次生代謝產物。 常見的真菌毒素如赭曲霉毒素、玉米赤霉烯酮(ZEN)、黃曲霉毒素、脫氧雪腐鐮刀菌烯醇(DON)和伏馬菌素,可通過日常飲食被生物體攝入并在體內累積,對生物體的肝腎功能、生殖系統、免疫功能等造成不可逆的傷害[1-2]。2013—2014 年,Han 等對麥麩在內的357 個飼料樣本的真菌毒素污染情況調查顯示,DON 是中國飼料中最常見的真菌毒素,其次是ZEN 和AFB1[3]。 2019年,Yang 等對國內市場上的576 個玉米制品中的真菌毒素污染水平進行評估,結果表明78%的樣品至少存在一種真菌毒素污染, 其中DON 和ZEN 的發生率分別為63%和46%[4]。 可見,DON 和ZEN 廣泛存在于糧食以及飼料中, 對糧食中ZEN 和DON 開展同步快速檢測對保障糧食安全具有重要意義。
目前針對DON 和ZEN 的檢測手段主要包括儀器檢測分析法和免疫檢測法兩大類[5-7]。 氣相色譜、液相色譜、氣相色譜質譜聯用等大型儀器法可以實現高精確度檢測,但同時復雜的樣品處理流程使其無法實現現場檢測[8]。 免疫檢測方法是一種基于抗原抗體特異性結合的檢測手段。 相對于色譜和質譜方法, 免疫檢測方法對操作人員和場地要求低,且能夠實現低成本、快速靈敏檢測污染物[9]。 目前,通過動物免疫獲得的多克隆或單克隆抗體是免疫檢測中使用的主要識別元件。 其中多克隆抗體特異性差,檢測背景信號值高,不適于真菌毒素的精準定量;單克隆抗體的特異性強,批間差異小,但技術要求高、制備周期長、成本高且只能檢測一類具有類似結構的真菌毒素。 因此,特異性抗體的高效制備是免疫檢測方法開發的關鍵因素。
近年來,基因重組抗體技術發展迅速。 該技術將含有抗體基因的載體導入到原核或真核生物中,在一定條件下培養可誘導產生具有生物活性的蛋白質。 重組抗體克服了傳統抗體生產的局限性,無須經過復雜的細胞融合篩選過程, 具有生產周期短、重復性好的優點。 相比傳統的雜交-雜交瘤融合技術,重組表達的雙特異性抗體無須經過多次細胞融合篩選的過程,且不易發生由染色體丟失造成的生產能力喪失的情況。 目前雙特異性抗體類型有區內交換抗原結合片段、抗原結合片段-單鏈抗體、單鏈抗體-單鏈抗體(scFv)2等[10]。 其中(scFv)2形式可以通過多肽連接臂連接2 種scFv, 具有結構簡單、相對分子質量低且不存在錯誤組裝、表達效率高等優勢[11]。 因此,作者首先在哺乳動物細胞Expi293F中表達了ZEN 單鏈抗體(ZEN-scFv)和DON單鏈抗體(DON-scFv),進一步設計和制備可識別ZEN 和DON 的雙特異性抗體(Bis-scFv)并建立酶聯免疫檢測方法。 表達抗體Bis-scFv 制備周期短、重現性好和可定向改造,有助于提高抗體制備效率,實現多種物質同時檢測,具有良好的應用前景。
1 材料與方法
1.1 材料與設備
1.1.1 菌株與細胞大腸桿菌(E.coli DH5α)感受態:天根生化科技有限公司(北京);Expi293F 細胞:賽默飛世爾科技有限公司(美國);表達質粒構建、引物合成和基因測序由安升達生物科技有限公司(蘇州)完成。
1.1.2 主要試劑玉米赤霉烯酮(ZEN)、脫氧雪腐鐮刀菌烯醇(DON)、黃曲霉毒素B1(AFB1)、赭曲霉毒素A(OTA)和T-2 毒素等標準品:Sigma-Aldrich公 司;ExpiFectamine293 轉 染 試 劑 盒、Opti-MEM I無血清培養基、Expi293F 表達培養基、Gene Ruler DNA Ladder Mix: 賽默飛世爾科技有限公司 (美國);卵清蛋白(ovalbumin,OVA)、無縫克隆試劑盒、氨芐青霉素(Amp):生工生物工程有限公司(上海);PCR Master Mix 高保真酶: 翌圣生物科技股份有限公司(上海);辣根過氧化物酶標記抗His 標簽單克隆抗體:ImmunoWay 生物技術公司;His 標簽蛋白純化試劑盒、預染蛋白質Marker:碧云天生物技術公司(南通);牛血清蛋白(bovine albumin,BSA):國藥集團化學試劑有限公司(上海)。
1.1.3 實驗儀器T-100 鏈式反應核酸擴增儀、Mini-PROTEAN Tetra1658033 蛋白質電泳系統:Biorad 公司(上海);Thermo3111 恒溫培養箱:賽默飛世爾科技有限公司(美國);VS-1300L-U 超凈工作臺:安泰空氣技術有限公司(蘇州)。
1.2 實驗方法
1.2.1 質粒設計抗體由兩組輕鏈(VL、CL)和重鏈(VH、CH1、CH2和CH3)組成,結構呈現“Y”型,見圖1(a)。 抗體的可變區負責識別結合抗原,可變區的VH 和VL 可通過長度通常為10~25 個氨基酸殘基的多肽接頭連接形成scFv,見圖1(b)。 其作為小相對分子質量的單個多肽更容易被改造和表達,并且能夠保留原始抗體的性質[12]。作者首先構建了ZENscFv 和DON-scFv 重組質粒, 并在哺乳動物細胞Expi293F 中表達。 通過柔性連接子 (Gly4Ser)3將ZEN-scFv 和DON-scFv 基因序列連接用于融合表達,獲得雙特異性抗體Bis-scFv,見圖1(c),以期可以同時結合ZEN 和DON 這2 種不同的表位。 為促進重組抗體通過Expi293F 細胞進行高表達分泌,在DON-scFv、ZEN-scFv、Bis-scFv 前添加信號肽(SP),信號肽序列為:MGWSCIILFLVATATGVHS[13-14]。DON-scFv 和ZEN-scFv 基因序列來自NCBI 數據庫,DON-scFv NCBI:AY151141.1,AY151140.1;ZENscFv NCBI:U74672.1,U74671.1。
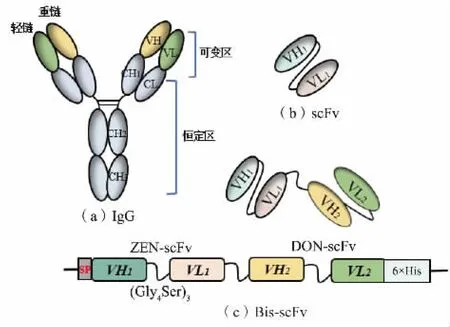
圖1 重組抗體質粒設計Fig.1 Design of recombinant antibody plasmid
1.2.2 重組載體構建雙特異性抗體表達載體構建采用無縫克隆技術,構建流程見圖2,構建過程使用的引物見表1。 CH-Linker-DON-scFv-pTT5 載體由金斯瑞生物科技股份有限公司構建,保存于作者所在實驗室。 Bis-scFv-pTT5 重組載體的構建采用無縫克隆技術, 將CH-Linker-DON-scFv-pTT5 載體中的CH 基因替換成ZEN-scFv。 以ZEN-scFvpCMV 為模板, 以BIS-SCFV-F1/F2 為引物, 經過PCR 擴增獲得ZEN-scFv 片段 (802 bp)。 以CHLinker-DON-scFv-pTT5 載體作為模板, 以BISSCFV-V1/V2 為引物對經PCR 擴增獲得Linker-DON-scFv-pTT5 載體片段(5 227 bp)。 利用無縫克隆酶連接上述的PCR 純化產物, 取100 ng Linker-DON-scFv-pTT5 的PCR 產物和40 ng ZEN-scFv 擴增片段,兩者之間的摩爾比保持在1∶2~1∶3,加入10 μL 的2×無縫克隆酶混合液, 用無菌水補足體系至20 μL。 混合物置于50 ℃水浴下反應40 min,立即冰浴冷卻2 min 后進行熱激轉化(42 ℃、90 s)。轉化后的E.coli DH5α 進行菌落PCR 驗證,經瓊脂糖凝膠電泳驗證,將長度正確的菌株接種到含有氨芐的LB 培養基中培養6 h, 用于測序。 相同操作進行DON-scFv-pCMV 重組載體構建。

表1 質粒構建所用引物Table 1 Primers used in plasmid construction

圖2 Bis-scFv-pTT5 構建流程Fig.2 Construction process of Bis-scFv-pTT5
1.2.3 哺乳動物細胞表達重組抗體Expi293F 細胞的培養和轉染遵循Vazquez-Lombardi 的實驗方案[14]。 首先將液氮保存的1×107個Expi293F 細胞加入25 mL 培養基中, 在37 ℃含體積分數8.0%的CO2條件下培養并傳代3~4 代。取7.5×107個細胞置于25.5 mL 培養基中, 并向其中加入表達抗體質粒和陽離子脂質體轉染試劑繼續培養,18 h 后再加入增強劑Ⅰ和增強劑Ⅱ以維持細胞活性, 繼續培養7 d,將培養物以3 200 r/min 離心20 min,上清液用于純化。
1.2.4 表達產物純化以及聚丙烯酰胺蛋白質電泳驗證 向3 mL 柱體積的層析親和柱中加入1 mL 的Ni-TAN 凝膠, 加入1mL 的非變性裂解液平衡2~3次。 將待純化的上清液加入親和柱中,富集分離目的蛋白質。加入1 mL 的洗滌液(含20 mmol/L 咪唑)洗滌3 次,去除多余的雜蛋白質。 加入1 mL 的洗脫液(含250 mmol/L 咪唑),重復洗脫6 次,收集洗脫液。純化產物用12.5 g/dL 的十二烷基硫酸鈉聚丙烯酰胺凝膠電泳(SDS-PAGE) 驗證相對分子質量大小。 為保護抗體的活性, 對上述的洗脫產物用PBS緩沖溶液(0.01 mol/L,pH 7.4)透析3 d,去除雜質離子。
1.2.5 抗體親和性驗證抗體親和性采用ELISA法測定。 步驟如下:
1)包板 向96 孔板加入100 μL 質量濃度為1 μg/mL 的DON 或ZEN 抗原,37 ℃孵育2 h,然后用PBST (含有體積分數0.05%吐溫-20 的PBS 溶液)洗滌5 次。
2)封閉 PBST 洗滌后,每孔加入250 μL 含有5 g/dL 脫脂奶粉PBS 緩沖液,37 ℃封閉2 h,結束后再將96 孔板用PBST 洗滌5 次并干燥。
3)加樣 取100 μL 純化抗體、50 μL 純化抗體與50 μL 不同質量濃度的毒素標準品的混合液,37 ℃孵育1 h,PBST 洗滌5 次。
4)加二抗 將100 μL 辣根過氧化物酶標記的抗His 標簽二抗加入孔中,并在37 ℃下孵育30 min,PBST 洗滌5 次。
5)顯色讀數 向每個樣品孔中加入100 μL 的3,3’,5,5’-四甲基聯苯胺溶液,15 min 后加入50 μL 濃度為2 mol/L 的H2SO4溶液終止顯色反應,測定OD450。 添加體積分數10%甲醇的PBS 溶液到對照孔, 其OD450為B0, 添加DON 和ZEN 標準品的OD450為B。 以毒素質量濃度為橫坐標,B/B0為縱坐標,用origin 2018 軟件通過非線性擬合得到標準曲線,并確定B/B0為50%時所對應的真菌毒素的質量濃度,即半抑制質量濃度(IC50)。 此外,通過對比相同質量濃度下的ZEN、DON、OTA、AFB1、T-2 毒素對于抗體與抗原結合的抑制效果, 驗證抗體的特異性。 對各組抑制率采用graphpad prism8.0.1 單因素方差(ANOVA)分析,不同字母標記(a/b)表示2 組差異顯著性(P<0.05)。
1.2.6 實際樣品檢測取5 g 玉米粉, 分別添加質量分數為40、80 μg/kg 的ZEN 標準品充分混勻,用20 mL 甲醇-水(體積比86∶14)超聲提取30 min。 將提取物于12 000 r/min 離心15 min, 并用0.22 μm微孔濾膜過濾后用氮氣干燥。將其重新溶解于1 mL體積分數10%的甲醇PBS 中, 提取物用體積分數10%的甲醇PBS 稀釋20 倍用于ELISA 檢測。 相同步驟對玉米進行DON 加標分析, 加標的質量分數分別為80 μg/kg 和240 μg/kg。
式中:CV 為加標回收率,%;m1為玉米粉中ZEN 質量分數的測定值,μg/kg;m2為玉米粉中實際ZEN 加標的質量分數,μg/kg;RSD 為相對標準偏差,%;SD為玉米粉中ZEN 質量分數測定值的標準偏差,μg/kg;m3為玉米粉中ZEN 質量分數測定值的平均值,μg/kg。
2 結果與分析
2.1 重組載體的構建
重組載體Bis-scFv-pTT5 和DON-scFv-pCMV的瓊脂糖凝膠電泳驗證結果見圖3。 Bis-scFv-pTT5其擴增片段大小位于2 000 bp 附近,見圖3(a),符合理論值1 904 bp。 DON-scFv-pCMV 其擴增片段大小位于1 000~1 200 bp,見圖3(b),符合理論值1 075 bp。 對菌落PCR 長度驗證正確的菌株進行堿基測序顯示,重組載體片段正確組裝,且堿基序列正確, 未發生基因突變, 表明Bis-scFv-pTT5 和DON-scFv-pCMV 重組載體構建成功。

圖3 重組載體瓊脂糖凝膠電泳驗證圖Fig.3 Agarose gel electrophoresis of recombinant antibody plasmids
2.2 ZEN-scFv 和DON-scFv 的SDS-PAGE 分析
Expi293F 細胞采用了30 mL 的體系,誘導表達后離心去除細胞, 對上清液進行純化, 分別收獲1.55 mg ZEN-scFv 和253 μg 的DON-scFv,SDSPAGE 驗證結果見圖4。 ZEN-scFv 含有251 個氨基酸, 通過SnapGene 軟件計算蛋白質理論相對分子質量為26 700,在26 000~34 000 條帶單一,見圖4(a),符合ZEN-scFv 理論相對分子質量。 DON-scFv含有257 個氨基酸,其蛋白質理論相對分子質量為27 400,在26 000~34 000 條帶單一,見圖4(b),符合DON-scFv 理論相對分子質量。

圖4 Expi293F 細胞表達的單鏈抗體的SDS-PAGE 圖Fig.4 SDS-PAGE analysis of the expression of single chain antibodies expressed by Expi293F cells
2.3 ZEN-scFv 和DON-scFv 親和性驗證
透析純化后獲得質量濃度為188 μg/mL 的ZEN-scFv。 將ZEN-scFv 稀釋為0.5 μg/mL,測定其對1.0 μg/mL 的ZEN-BSA 和1.0 μg/mL 的BSA 親和性, 定義ZEN-BSA 的吸光度OD450為P,BSA 的吸光度OD450為陰性對照N。當P/N≥2.1 時,則判定親和性為陽性[15]。 如圖5 所示,ZEN-scFv 對應的P值為2.57,N 值為0.07,兩者比值為36.71,顯著大于2.1,表明ZEN-scFv 能夠識別并結合抗原上偶聯的ZEN 分子,親和性為陽性。 DON-scFv 經過純化、二喹啉甲酸法蛋白質質量濃度測定后, 獲得的最大DON-scFv 質量濃度為38 μg/mL。 將DON-scFv 稀釋至質量濃度為1 μg/mL 進行驗證,對1 μg/mL 的DON-OVA 和1 μg/mL 的OVA 測定親和性。 DONscFv 對應的P 值為0.89,N 值為0.10, 兩者比值為8.9,表明DON-scFv 能夠識別并結合抗原上偶聯的DON 分子,親和性為陽性。

圖5 ZEN-scFv 和DON-scFv 結合活性ELISA 驗證Fig.5 ELISA validation of the binding activity of ZENscFv and DON-scFv
2.4 ZEN-scFv 和DON-scFv 靈敏度的測定
采用間接競爭ELISA 法對ZEN-scFv 和DONscFv 識別的靈敏性進行分析。首先利用ELISA 棋盤優化確定當ZEN-BSA 包被質量濃度為0.125 μg/mL、ZEN-scFv 包被質量濃度為0.125 μg/mL 時,OD450約為1.0。 在此條件下, 建立了0~1 000 ng/mL 的ZEN 標準抑制曲線,結果見圖6(a)。 ZEN-scFv 的IC50值為8.66 ng/mL, 靈敏度較報道的該序列單特異性ZEN-scFv(IC50為11.20~14.00 ng/mL)高[16-17]。此外,DON-OVA 包被質量濃度為1.0 μg/mL,DONscFv 的質量濃度為1.0 μg/mL。在該條件下,在DON質量濃度為0~10 000 ng/mL 建立標準曲線,結果見圖6(b)。 DON-scFv 的IC50為69.01 ng/mL,表明對DON 具有較高的敏感性,能夠滿足國內對于糧食中DON 限量(1 000 μg/kg)的檢測要求。

圖6 單鏈抗體標準抑制曲線Fig.6 Standard inhibition curves for single chain antibodies
2.5 雙特異性抗體驗證
6×His、 標簽DON-scFv 由515 個氨基酸組成,理論相對分子質量為54 100。圖7(a)顯示在相對分子質量55 000~72 000 存在清晰的單一蛋白質條帶,電泳條帶與理論相對分子質量略微偏大,可能是由于磷酸化或糖基化修飾使得蛋白質電荷發生改變從而影響了蛋白質在凝膠上的轉移速度。 進一步對DON-OVA(1 μg/mL)和ZEN-BSA(1 μg/mL)結合能力進行ELISA 驗證,結果見圖7(b)。 表達抗體Bis-scFv 對2 種抗原的OD450與對照組OVA/BSA 存在明顯差異,P/N 遠大于2.1。 可見, 通過(Gly4Ser)3 Linker 連接ZEN-scFv 和DON-scFv 組成的雙特異抗體Bis-scFv 保留了DON-scFv 和ZEN-scFv 的親和識別功能。 同時,在相同抗原和抗體質量濃度下,Bis-scFv 對ZEN 的OD450比DON強,表明Bis-scFv 對ZEN 具有更強的親和力。

圖7 雙特異性抗體的SDS-PAGE 和ELISA 親和性驗證Fig.7 SDS-PAGE and ELISA validation of the affinity of bispecific antibody
2.6 抗體靈敏度測定
ELISA 棋盤優化確定ZEN-BSA 包被質量濃度為1.0 μg/mL,Bis-scFv 的質量濃度為5 μg/mL。 將ZEN 溶于體積分數10%的甲醇PBS 中,配制成質量濃度為0.25~10 000 ng/mL 的標準品,Bis-scFv 對ZEN 的非線性抑制曲線見圖8(a)。Bis-scFv 對ZEN表現良好的靈敏度, 其IC50為20.64 ng/mL。 同樣,ELISA 棋盤優化確定8 μg/mL 的Bis-scFv 和2 μg/mL的DON-OVA 時,OD450值約為1.0。 在此條件下,在DON 為0~10 000 ng/mL 建立非線性抑制曲線,測得其IC50為132.29 ng/mL,見圖8(b)。 將Expi293F表達的重組抗體與目前報道的單克隆抗體(mAb)進行比較,結果見表2。 Expi293F 表達的Bis-scFv 與ZEN-scFv 靈敏度相近, 且與目前報道的部分抗ZEN mAb 靈敏度相近。 目前,歐盟和我國對于糧食中ZEN 的最大限量分別為100、60 μg/kg,ZEN-scFv和Bis-scFv 能夠滿足ZEN 的檢測要求。 與DONscFv 比較,Bis-scFv 對DON 的靈敏度顯著下降,但仍顯著優于部分報道的抗DON mAb。 研究表明,scFv 連接肽的長度以及VH 和VL 排列取向會導致不同結合活性和寡聚狀態[18-19]。Bis-scFv 融合抗體的形式對DON 敏感性的干擾大于ZEN, 這可能是由ZEN-scFv 和DON-scFv 排列取向差異導致。
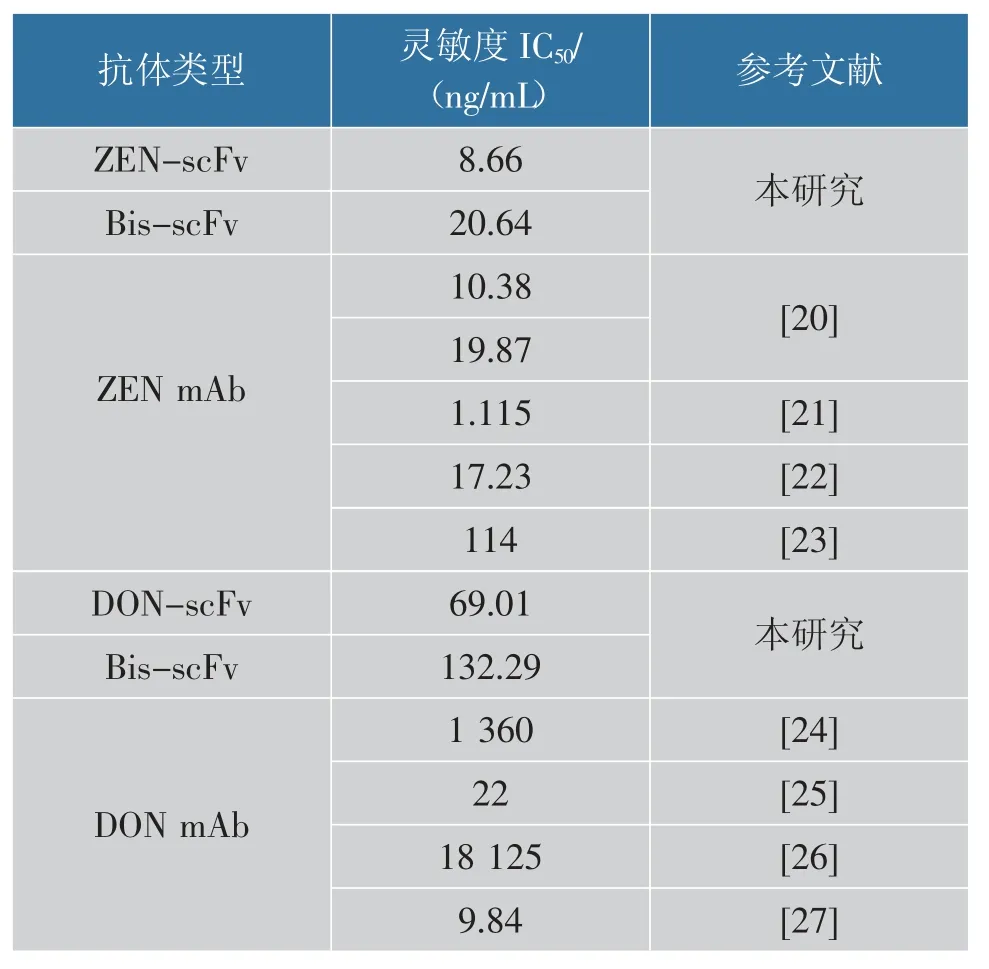
表2 重組表達抗體與傳統抗體靈敏度比較Table 2 Sensitivity comparison between the recombinant antibodies and the traditional antibodies

圖8 雙特異性抗體標準抑制曲線Fig.8 Standard inhibition curves of bispecific antibody
2.7 抗體特異性驗證
為驗證Bis-scFv 對ZEN 和DON 識別的特異性,考察了OTA、AFB1、T-2 毒素與Bis-scFv 的結合能力,結果見圖9。在相同質量濃度的抗體和包被抗原的情況下, 當ZEN 和DON 質量濃度達到10 000 ng/mL 時, 游離的Bis-scFv 與游離的ZEN 和DON結 合,Bis-scFv 與ZEN-BSA 和DON-OVA 的 結 合受到抑制,此時抑制率接近100%。 當向體系加入質量 濃 度 為10 000 ng/mL 的OTA、AFB1、T-2 毒 素時, 對抗體與包被抗原結合的抑制效果顯著小于DON 和ZEN,抑制率小于10%,這表明OTA、AFB1、T-2 無法與Bis-scFv 結合,Bis-scFv 與OTA、AFB1、T-2 之間不存在明顯的交叉反應。

圖9 表達抗體Bis-scFv 特異性Fig.9 Specificity of antibody Bis-scFv
2.8 基于雙特異性抗體的ELISA 檢測方法構建
基于Bis-scFv 建立ELISA 檢測方法, 當ZEN質量濃度在1~100 ng/mL 時,B/B0與ZEN 質量濃度對數值呈線型關系,見圖10(a)。 線性關系為Y=-0.402 8lg X+0.961 4, 線性擬合優度R2=0.946 7,IC50為13.98 ng/mL。 當DON 質量濃度在10~500 ng/mL 時,DON 質量濃度的對數與B/B0線型關系為Y=-0.527 5lg X+1.585,線性擬合優度R2=0.968 1,IC50為113.99 ng/mL,見圖10(b)。 用BisscFv-ELISA 檢測ZEN 和DON 加標的玉米樣品,結果見表3。 玉米粉中ZEN 加標量為40 μg/kg 和80 μg/kg,Bis-scFv-ELISA 測定的平均值為34.45 μg/kg 和86.52 μg/kg, 平 均 回 收 率 為86.13%~108.14%;玉米粉中DON 加標量為80 μg/kg 和240 μg/kg,Bis-scFv-ELISA 測 定 的 平 均 值 為75.08 μg/kg 和206.44 μg/kg, 平 均 回 收 率 為86.02%~93.85%。 玉米樣品加標回收檢測結果表明,BisscFv-ELISA 具有良好的準確性,能夠用于實際樣品檢測。將Bis-scFv-ELISA 同步檢測與基于單克隆抗體的同步檢測方法進行比較,Bis-scFv-ELISA 具有更廣定量檢測范圍,見表4。

表3 玉米粉的DON 和ZEN 加標檢測結果(n=3)Table 3 Detection results of DON and ZEN in spiked corn flour samples(n=3)

表4 DON 和ZEN 檢測方法比較Table 4 Comparison of DON and ZEN detection methods

圖10 Bis-scFv-ELISA 線性標準抑制曲線Fig.10 Linear standard inhibition curves of Bis-scFv-ELISA
3 結 語
結合重組抗體表達技術,在Expi293F 表達系統中成功表達了能夠用于免疫檢測的ZEN-scFv 和DON-scFv,IC50分別為8.66 ng/mL 和69.01 ng/mL。基于性質良好的單特異性抗體片段進行基因改造,獲得了具有ZEN 和DON 結合位點的Bis-scFv。 經ELISA 驗 證,Bis-scFv 對ZEN-BSA 和DON-OVA存在親和性。 Bis-scFv 對ZEN 靈敏度接近ZENscFv,IC-ELISA 的IC50為20.64 ng/mL, 而對DON敏感性顯著下降,IC-ELISA 的IC50為132.29 ng/mL。Bis-scFv 對OTA、AFB1、T-2 毒素無顯著的交叉反應, 具有良好的特異性。 基于Bis-scFv 建立的ELISA 檢測方法, 其對ZEN 檢測的線性范圍為1~100 ng/mL,DON 的檢測線性范圍為10~500 ng/mL。Bis-scFv-ELSIA 對玉米粉中ZEN 和DON 的加標回收率分別為86.13%~108.14%和86.02%~93.85%,相對標準偏差小于15%, 檢測穩定性高, 表明BisscFv-ELISA 能夠滿足糧食中ZEN 和DON 檢測要求。

