從燃燒熱測量求算化學反應熱
——“燃燒熱的測定”實驗改進
江豪,淳遠,李唐,張開宇,楊立軍,高衛,楊金月
南京大學化學化工學院,化學國家級實驗教學示范中心,南京 210023
“燃燒熱的測定”實驗是一個經典的物理化學實驗項目,涉及到物理化學相關原理中的熱化學知識,學生先通過測量已知燃燒熱的樣品(通常是苯甲酸)的燃燒熱獲得氧彈式熱量計的水當量,接下來再去測量待測物質的燃燒熱,通常為萘[1-4]。由于實驗的成功率較高,操作難度合適,且可以幫助學生更好地理解相關概念,因而絕大多數高校開設的物理化學實驗課程中均會包括該實驗項目。近年來,一些高校對該實驗內容進行了改進,比如使用蔗糖[5]和肉桂酸[6]等綠色試劑替換有污染的萘,測量甘蔗渣和玉米芯等農林廢棄物的燃燒熱[7],測量白酒、固體酒精、各類植物等物質的燃燒熱[8]。張樹永等[9]將農林廢棄物燃燒熱的測定進一步與國家能源安全和三農發展等國家戰略對接,構建了一個優秀的實驗課程思政案例。此外,還有一些研究通過改變壓片方式和點火方式來提升點火成功率[10],通過數據采集和處理的自動化來減少人為誤差[11]。
然而,現今大部分高校開展的“燃燒熱的測定”實驗仍存在不足之處:首先,該實驗只是單純地測定物質的燃燒熱;其次,教學過程采用傳統的驗證性實驗模式,實驗流程固定,可供學生探索的空間較小,不利于對學生自主學習能力和創新思維意識的培養。
基于此,我們對經典的“燃燒熱的測定”實驗進行了改進。改進的實驗方案中,將實驗從單純測量某物質(如萘)的燃燒熱,改造為測量合成鄰苯二甲酸(酐)反應的反應熱。通過改進,不僅可以把熱化學中的重要定律——Hess定律引入到物理化學實驗中,從而提升燃燒熱測定的理論意義;還可以通過測量不同待測物質的數據,增加實驗的選擇性,增加學生自主探索、分工合作、數據共享的空間,從而將原實驗轉變為團隊協作實驗,增強學生的團隊合作能力。
為了測量合成鄰苯二甲酸(酐)的反應熱,我們設計了多個合成路徑,以萘、鄰二甲苯為原料,以鄰苯二甲酸與鄰苯二甲酸酐為產物,安排學生通過小組合作,分別測量萘、鄰二甲苯、鄰苯二甲酸和鄰苯二甲酸酐的燃燒熱,從而確定相關五個反應的反應熱,并對這五條合成路徑進行討論分析,從而增強學生分析和解決問題的能力。
1 實驗部分
1.1 試劑和材料
苯甲酸(C7H6O2),含量≥ 99.5%,江蘇強盛化工有限公司;萘(C10H8),分析純,天津石英鐘廠霸州市化工分廠;鄰二甲苯(C8H10),98%,上海麥克林生化科技有限公司;鄰苯二甲酸(C8H6O4),99.5%,上海麥克林生化科技有限公司;鄰苯二甲酸酐(C8H4O3),含量≥ 99.7%,永華化學科技(江蘇)有限公司;明膠空心膠囊,上海紅星膠囊有限公司。
1.2 實驗儀器
SHR-15A燃燒熱實驗儀一套;氧氣鋼瓶一個;萬用表一個。
1.3 實驗步驟[4]
1) 整理、洗凈并擦干儀器。
2) 壓片。從干燥器中取出苯甲酸樣品,研磨至粉末狀,稱取0.9-1.0 g研磨后的苯甲酸,在壓片機中壓至片狀,放入燃燒杯中準確稱重,記錄苯甲酸樣品質量。
3) 充氧氣。氧彈頭放在彈頭架上,燃燒杯已裝入樣品,放入燃燒杯架,取一根燃燒絲在中間繞成小線圈,燃燒絲兩端繞在氧彈頭兩根點火電極上,將燃燒絲線圈緊貼樣品。萬用表測定兩電極間電阻。將氧彈頭放入彈杯,用手擰緊,再測電阻,若電阻變化不大,則充氧。
將充氧氣銅管的自由端接在氧氣減壓閥上,先調節氧氣減壓閥壓力1.8 MPa。氧彈進氣口對準充氧器出氣口,手輕壓操作手柄,待壓力升至0.5 MPa以上,松開手柄,用放氣頂針開啟出口放氣,以趕走氧彈中的空氣。同法再次充氧,待壓力升至1.8 MPa停留約30 s,以充滿氧氣。再次測量電阻,若電阻變化不大,則可以將氧彈放入熱量計內筒。
4) 調節水溫。打開裝置開關,將溫差測定儀探頭放入熱量計外筒中,測定并記錄環境溫度。塑料桶取略多于3000 mL自來水,將溫差測定儀探頭放入水中,使用冰袋等調節水溫,使自來水溫度低于環境溫度1 K左右。用容量瓶準確量取3000 mL已調節溫度的自來水加入內筒,蓋上熱量計蓋子。將溫差測定儀探頭插入內筒水中。
5) 打開攪拌開關,電動機運轉后,每30 s讀取水溫一次(精確至±0.002 °C),直至連續8次顯示水溫有規律的微小變化或基本不變,按下點火按鈕。若升溫很快,說明樣品點燃成功。繼續每30 s記錄一次溫度,當溫度升至最高點后再記錄8組數據,停止實驗。
6) 取出溫差測定儀探頭,打開熱量計蓋子取出氧彈,用放氣頂針將余氣放出。旋下氧彈彈蓋,檢查樣品燃燒效果。沒有殘渣表示燃燒完全,若留有許多黑色殘渣表明燃燒不完全,則實驗失敗,需要重新實驗。用水沖洗氧彈及燃燒杯,倒去內筒的水,用紗布擦干儀器。
7) 根據擬研究的反應,使用同樣的方法測定反應物和產物的燃燒熱。其中萘稱取的質量為0.6-0.7 g,鄰二甲苯稱取的質量為0.5-0.6 g (裝入明膠膠囊中,和膠囊一起燃燒,需記錄膠囊質量),鄰苯二甲酸稱取的質量為1.2-1.3 g,鄰苯二甲酸酐稱取的質量為1.1-1.2 g。
2 結果與討論
2.1 燃燒熱測定實驗結果
苯甲酸作為標準物質,已知其在298.15 K時的燃燒熱為-3226.8 kJ·mol-1[4],可以求出燃燒熱測定實驗中儀器的熱容。在計算反應過程的ΔT時,為了減少系統和環境熱交換的影響,需要使用雷諾校正圖進行溫度校正[1-4]。
實驗測得的儀器熱容的平均值為14.304 kJ·K-1,以此為基礎,根據萘、鄰二甲苯、鄰苯二甲酸與鄰苯二甲酸酐的實驗結果,從公式(1)計算得到的燃燒熱與對應的文獻值[12-15]列于表1中。為保證結果的可信度,每個樣品測定均重復三次,表中列出的數據為三次實驗的平均值。
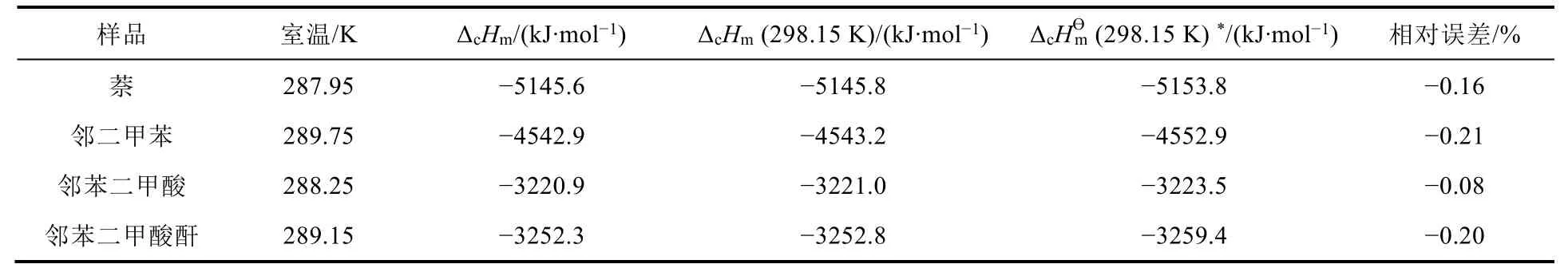
表1 待測物質的燃燒熱
文獻列出燃燒熱的溫度通常為298.15 K[12],考慮到燃燒熱與溫度有關,而實驗時環境溫度和298.15 K有一定的差別,為了便于與文獻值進行比較,利用Kirchhoff定律,通過反應前后摩爾定壓熱容變化值(ΔCpm)對熱效應進行了溫度校正(公式(2))[16]。經溫度校正后儀器熱容平均值為14.309 kJ·K-1,由此算出的各物質298.15 K下燃燒熱也列于表1之中。
從表1可以看出,四個樣品燃燒熱測定結果與理論值相差都很小,表明測量結果準確性很高。若不經溫度校正,萘在288 K左右的燃燒熱測量值為-5145.6 kJ·mol-1,比校正后只變化了0.2 kJ·mol-1,誤差不到萬分之一。可見溫度校正與否對燃燒熱的測量結果影響較小,這主要歸因于通常待測物質的燃燒熱為很大的負值。
通過測量得到的燃燒熱數據可以計算不同反應的反應熱。以萘、鄰二甲苯、鄰苯二甲酸和鄰苯二甲酸酐為反應物種,可以組合得到以下5個在實際化工生產中有意義的反應:
這些反應的反應熱計算結果列于表2。
從表2可以看出,對于前4個反應,通過測量燃燒熱途徑計算出反應熱與文獻值的相對誤差絕對值不大于0.55%,說明此方法是可行的,結果較為準確。第五個反應的相對誤差絕對值達到11.4%,偏差較大。從絕對誤差可以看出,這些反應計算值偏差都在個位數上,但是由于前4個反應的熱效應絕對值超過1000 kJ·mol-1,燃燒熱測量本身的偏差帶來的影響很小。而第五個反應的熱效應絕對值只有35.9 kJ·mol-1,遠遠小于其反應物和生成物的燃燒熱絕對值(> 3000 kJ·mol-1),燃燒熱測量本身的偏差帶來的影響就非常顯著了。
2.2 實驗教學開展方案
上述實驗結果證實了通過燃燒熱測量計算鄰苯二甲酸或鄰苯二甲酸酐合成過程反應熱的可行性,但是由于燃燒熱的測量耗時較長,在常規的實驗教學模式下,利用一次實驗的時間不可能完成所有樣品的燃燒熱測定。為了充分有效地利用課堂時間,更為了加強對學生自主學習能力的訓練,引入線上、線下相結合的翻轉學習模式,我們設計了如圖1所示的實驗流程。
教師事先將燃燒熱測量的原理以及實驗操作過程拍攝制作為微課視頻,供學生課前線上自主學習,熟悉實驗原理和操作過程。同時學生也需查閱文獻資料,了解鄰苯二甲酸(酐)的性質、工業合成途徑和重要用途。線下實驗開始時,針對5個不同的反應,學生可以自主選擇、分工完成其中一個反應的測量過程。確定研究體系后,利用燃燒熱實驗儀測量該反應各物質的燃燒熱。其中固體樣品的燃燒熱采用壓片法進行,而液體樣品的燃燒熱需裝入膠囊中進行測量。最后,教師再組織學生展開討論,對鄰苯二甲酸(酐)的合成、燃燒熱測定的意義、液體和固體燃燒熱測定過程的異同、實驗數據的處理方法、測量誤差的來源和影響程度、如何校正等進行交流和分享,從而讓學生對燃燒熱相關的研究有更為全面的認識和更深入的思考。課后實驗報告處理中,學生的實驗數據共享,每位學生在自己研究的反應基礎上,結合其他同學的實驗結果,可以對這幾條反應途徑的熱效應進行分析比較,進而對幾條合成路線進行評述;還可對第五個反應出現的較大相對誤差的原因進行分析,從而對由燃燒熱測量結果計算反應熱效應的局限性有直觀的認識。
目前這樣一個教學方案已在本校拔尖班學生中嘗試開展,取得了不錯的效果。其中30%左右的學生燃燒熱的測定精度能夠達到0.3%以內,計算出反應熱誤差低于1%;絕大部分同學的反應熱誤差能控制在3%以內。學生的數據誤差主要來自于點火后停止計時過早、雷諾圖校正處理不當等因素。學生實驗后也反映燃燒熱測定的實驗改進豐富了熱化學的實驗內容,使實驗教學和國民生產結合得更為緊密;開放的實驗內容給予了他們更多的自主性學習和研究的空間,科研能力得到了更好的訓練。后期我們將把這一改進方案在其他班級推廣。
3 結語
通過燃燒熱的測定可以獲得從萘或鄰二甲苯合成鄰苯二甲酸(酐)的化學反應熱,其實驗結果與文獻值非常接近。本實驗改進使“燃燒熱的測定”實驗不只限于單一物理量的測量訓練,更將之與實際工業合成應用相關聯;另外“翻轉學習”的引入可以進一步提升學生的自主學習能力和團隊合作精神,這些都將有助于拔尖創新人才的培養。

