國井白酒窖池發酵過程中酒醅微生物多樣性及理化特性
蔡程山,白飛榮,許 玲,董喬娟,王鵬輝,姜明慧,張天賜,石魯博,孫澤青,姚 粟*
(1.中國食品發酵工業研究院有限公司,北京 100015;2.山東扳倒井股份有限公司,山東 淄博 256300)
中國白酒釀造已有悠久的歷史,其品種繁多、香型各異、工藝更是各有不同[1]。發酵過程中,窖池中各種微生物生化代謝及其相互作用、互相影響、協調發展共同構成了窖池特定的微生態系統,微生物多樣性一定程度上決定了白酒品質[2]。針對特定釀酒企業解析窖池微生物多樣性,分離發酵過程中優勢菌株具有重要意義。長期以來,人們利用傳統可培養技術對窖池中的微生物組分進行分析,揭示了不同窖池中的優勢菌群的種屬與分布特點,如劉雯雯[3]應用傳統可培養技術分離到328株霉菌,其中優勢真菌屬為交鏈孢屬(Alternaria)、地絲菌屬(Geotrichum)、孢霉屬(Cladosprium)、曲霉屬(Aspergillus)、散囊菌屬(Eurotium)和紅曲霉屬(Monascus)等;CHEN B等[4]研究發現,醬香型白酒發酵窖池優勢真菌為宛氏擬青霉(Paecilomyces variotii)、米曲霉(Aspergillus oryzae)和土曲霉(Aspergillus terreus)。可培養技術雖然促進酒企生產技術的發展,但不能對非培養微生物進行分析,無法全面解析窖池微生物群落結構及生長規律。隨著分子生物學技術的快速發展,高通量測序技術以其靈敏度高、重復性好、可分析不可培養微生物等優點,被廣泛應用到微生物群落多樣性的分析[5]。如胡小霞等[6-7]采用高通量技術研究發現,窖池微生物優勢細菌屬包括乳酸桿菌屬(Lactobacillus)、埃希氏菌屬(Escherichia-Shigella)和芽孢桿菌屬(Bacillus);優勢真菌屬為交鏈孢屬(Alternaria)、曲霉屬(Aspergillus)、伊薩酵母屬(Issatchenkia)、畢赤酵母屬(Pichia)、假絲酵母屬(Candida)、接合酵母屬(Zygosaccharomyces)等。同時白酒風味獨特,種類繁多,采用常規化學方法測定如白酒中總酸、總酯、總醛、甲醇和雜醇油等成分已經滿足不了白酒工作者的工作需求。氣相色譜-質譜聯用(gas chromatography-mass spectrometer,GC-MS)技術可對白酒微量成分準確剖析,但僅依據化學含量難以評估風味物質的特征貢獻,還需結合感官閾值指標,評價白酒風味物質貢獻和白酒品質[8]。
本研究以山東扳倒井股份有限公司國井白酒窖池發酵中酒醅為研究對象,通過可培養技術,將優勢功能微生物進行分離、篩選、鑒定及應用;應用現代分子生物學技術,深入了解國香型白酒酒醅的微生物群落結構及演變過程,明確酒醅發酵過程中的優勢真菌和細菌種類;結合GC-MS技術,分析原酒中的揮發性風味物質對樣品總體香氣的貢獻;通過對發酵過程酒醅中水分、酸度、還原糖、淀粉含量以及原酒酒精度、總酸、總酯等理化性質測定,進一步認識微生物群落代謝對酒質的影響,為提升國井白酒的品質提供理論依據。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品采集
本研究酒醅樣品取自山東扳倒井股份有限公司,收集窖池不同時間點7個酒醅樣品(入窖堆積、發酵0 d、6 d、12 d、18 d、24 d、30 d),采樣時間為2021年11月15日~2021年12月14日,每次采集樣品覆蓋不同位置(窖池對角線兩個點,同一位點上層和下層糟醅)通過四分法采集兩份等同樣品(每份500 g)分別用于可培養法和非培養法的測定。
1.1.2 化學試劑
氯化鈉、葡萄糖、氫氧化鈉、鄰苯二甲酸氫鉀、乙二胺四乙酸、十六烷基三甲基溴化銨、氯仿、異戊醇、異丙醇、醋酸鈉、鹽酸、無水乙醇、4-甲基-2-戊醇(均為分析純):國藥集團化學試劑有限公司;3,5-二硝基水楊酸(分析純)、Tris-飽和酚:上海源葉生物科技有限公司;0.85%生理鹽水:北京陸橋技術股份有限公司;瓊脂糖(分析純):北京全式金生物技術有限公司;聚合酶鏈式反應(polymerase chain reaction,PCR)引物:生工生物工程(北京)股份有限公司;DL2000脫氧核糖核酸(deoxyribonucleic acid,DNA)Marker、核糖核酸酶(ribonuclease,RNase)、蛋白酶K:寶生物工程(大連)有限公司;DNA純化試劑盒、真菌DNA提取試劑盒:美國Omega Bio-Tek公司。
1.1.3 培養基
馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養基:馬鈴薯浸粉5.0 g/L,葡萄糖20.0 g/L,瓊脂20.0 g/L。121 ℃高壓滅菌20 min。
大豆酪蛋白瓊脂(trypticase soy agar,TSA)培養基:胰蛋白胨15.0 g/L,大豆胨5.0 g/L,氯化鈉5.0 g/L,瓊脂15.0 g/L,pH值7.3±0.2。121 ℃高壓滅菌15 min。
強化梭菌培養基(reinforcedClostridiummedium,RCM):蛋白胨10.0 g/L,牛肉粉10.0 g/L,酵母粉3.0 g/L,葡萄糖5.0 g/L,可溶性淀粉1.0 g/L,氯化鈉5.0 g/L,醋酸鈉3.0 g/L,L-半胱氨酸鹽酸鹽0.5 g/L,瓊脂0.5 g/L,pH值6.8±0.1。121 ℃高壓滅菌15 min。
1.2 儀器與設備
AC2-6S1生物安全柜、GHP-9160隔水式培養箱:上海一恒科學儀器有限公司;5424 R高速冷凍離心機:德國Eppendorf 公司;TRIO48聚合酶鏈式反應(PCR)儀:德國Biometra公司;BioDrop-μLite微量核酸蛋白分析儀:英國Biochrom有限公司;DT-401A電子天平:常熟市佳衡天平儀器有限公司;HG-50高壓滅菌鍋:日本HIRAYAMA公司;Votex 2000旋渦振蕩儀:美國Coleparmer公司;Microflex LRF基質輔助激光解吸電離飛行時間質譜(matrix-assisted laser desorption/ionization-time of flight-mass spectrometry,MALDI-TOF-MS)儀:意大利BRUKER公司;EC250-90電泳儀、Gel DoCqM EZ凝膠成像儀:美國BIO-RAD公司。
1.3 方法
1.3.1 可培養微生物分離
取樣品25 g至225 mL生理鹽水中,稀釋至10-1~10-4濃度,不同濃度稀釋液吸取100 μL分別涂布到PDA、TSA和RCM平板上,PDA平板置于培養箱中28 ℃好氧培養5 d,TSA平板置于培養箱中37 ℃好氧培養3 d,RCM平板置于培養箱中37 ℃厭氧培養3 d。
1.3.2 酒醅樣品中可培養微生物的菌種鑒定
真菌鑒定:利用真菌基因組提取試劑盒提取分離菌株的脫氧核糖核酸(DNA),再利用核糖體內部轉錄間隔區(internal transcribed spacer,ITS)、核糖體rDNA大亞基(26SD1/D2)[9-10]等分子標記引物對絲狀真菌和酵母菌的核酸序列進行聚合酶鏈式反應(PCR)擴增。PCR擴增體系:2×PCR MasterMix21μL,10μmol/L上、下游引物各1μL,DNA 30 ng,雙蒸水(ddH2O)補足至50 μL。PCR擴增條件:94 ℃10 min;94 ℃30 s,55 ℃30 s,72 ℃40 s,共35個循環;72 ℃7 min。擴增后獲得約600 bp的DNA片段,并進行測序。根據測序結果,用菌株的26S rDNA和ITS rDNA基因作為靶序列,在美國國家生物技術信息中心(national center of biotechnology information,NCBI)的GenBank數據庫中用基本局部比對搜索工具(basic local alignment search tool,BLAST)程序搜索同源序列,挑選與靶序列最相近的參考菌株系列,以99%序列相似性為判定標準完成菌種鑒定。
細菌鑒定:利用細菌基因組提取試劑盒提取分離菌株的DNA,再利用16S rRNA基因通用引物27F/1492R進行PCR擴增。PCR擴增體系:2×PCRMasterMix25μL,10μmol/L上、下游引物各1 μL,DNA 2 μL,雙蒸水(ddH2O)補足至50 μL。PCR擴增條件:94 ℃5 min;94 ℃1 min,55 ℃1 min,72 ℃1 min 30 s,共30個循環;72 ℃10 min。擴增后獲得約1 500 bp的DNA片段,并進行測序。根據測序結果,在EzBio Cloud數據庫中進行比對,獲得目標菌株及其近緣種的序列相似性,以98.65%序列相似性為判定標準完成菌種鑒定。
1.3.3 樣品宏基因組提取與高通量測序分析
利用溴化十六烷基三甲銨(cetyltrimethyl ammonium bromide,CTAB)法提取樣品的宏基因組DNA。以質檢合格的宏基因組DNA為模板,使用16S rRNA基因V4區通用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')進行PCR擴增。PCR擴增體系:5×FastPfu緩沖液8 μL,2.5 mmol/L脫氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,dNTPs)4 μL,10 μmol/L上、下游引物各2 μL,FastPfu酶1 μL,DNA 30 ng,雙蒸水(ddH2O)補足至40 μL。PCR擴增條件:95 ℃5 min;95 ℃30 s,55 ℃45 s,72 ℃45 s,共27個循環;72 ℃10 min[11]。使用Agencourt AMPure XP磁珠對PCR擴增產物進行純化并溶于洗脫緩沖液中,完成文庫的構建。使用Agilent 2100 Bioanalyzer對構建文庫的片段范圍及濃度進行檢測,檢測合格的文庫利用HiSeq2500平臺進行擴增子測序。
將高通量測序數據與已知數據庫進行比對分析,對獲得的操作分類單元(operational taxonomic unit,OTU)進行物種分類,使用軟件R(v3.4.1),在種水平繪制樣品的物種豐度圖,直觀的展示樣品中物種的組成及豐度,反映樣品間微生物物種的變化情況。
1.3.4 酒醅樣品及原酒理化指標測定
水分的測定[12]:采用電熱烘箱干燥法;酸度的測定[12]:采用中和滴定法;淀粉含量的測定:采用滴定法;還原糖的測定[12]:采用3,5-二硝基水楊酸(3,5-dinitrosalicylic acid,DNS)-分光光度計法[12];原酒總酸、總酯的測定:采用中和滴定(指示劑)法;原酒酒精度的測定:參考國標GB 5009.225—2016《食品安全國家標準酒中乙醇濃度的測定》;原酒綜合品評:參考國標GB/T10345—2007《白酒分析方法》。
1.3.5 原酒中揮發性風味物質的檢測及氣味活度值分析
原酒中揮發性風味物質的檢測采用GC-MS法。
樣品預處理:取待分析的酒樣0.5 mL,置于10 mL 固相微萃取儀采樣瓶中,加入5 mL去離子水、1.5 g氯化鈉及20 μL 2.005 g/L的4-甲基-2-戊醇,35 ℃頂空萃取40 min,熱解吸3 min進樣。
氣相色譜條件:CP-WAX57CB毛細管柱(50m×0.25mm×0.2 μm),柱溫采用程序升溫,初溫35 ℃,保持3 min后以3 ℃/min 升至80 ℃,再以9 ℃/min升至200 ℃,保持20 min。載氣為高純氦氣(He)(純度99.999%),流速1.0 mL/min,進口溫度230 ℃,不分流進樣1 μL。質譜條件:電子電離(elctronic ionization,EI)源,電子能量70 eV,離子源溫度230 ℃,質譜掃描范圍50~500 amu。
采用氣味活度值(odor activity value,OAV)評價各化合物對樣品總體風味的貢獻,OAV=物質濃度/閾值,OAV<1,說明該物質對總體風味無實際作用;OAV>1,說明該物質可能對總體風味有較大影響;且在一定范圍內,OAV越大,說明該物質對總體風味的貢獻越大[13-14]。
1.3.6 數據處理
數據分析主要包括測序數據過濾、序列標簽(Tag)拼接、OTU聚類、物種注釋和物種復雜度分析等流程。利用QIIME 2[15]的DADA2方法[16]對下機數據進行質控,去除低質量序列、嵌合體并得到Clean Data。使用FLASH軟件(v1.2.11),利用重疊關系將雙末端測序得到的成對Reads組裝成一條序列,得到高變區的Tags。利用USEARCH軟件(v7.0.1090)將拼接好的Trags聚類為OTU,并采用RDP classifier 貝葉斯算法對OTU代表序列進行分類學分析,并在界、門、綱、目、科、屬和種水平統計分析各樣本的群落組成。利用QIIME2中q2-diversity方法進行Alpha多樣性指數分析,Chao1、Ace、Shannon和Simpson指數共同表征樣品的微生物群落結構的豐富度和多樣性。實驗數據用“平均值±標準差”表示,樣品差異分析采用單因素方差法,差異顯著(P<0.05)時通過Duncan氏法進行多重比較,分析由SPSS 27.0軟件完成。
2 結果與分析
2.1 不同發酵時間酒醅樣品中可培養微生物分離結果
不同發酵時間酒醅樣品中可培養微生物分離結果見表1。由表1可知,通過可培養技術在不同發酵時期酒醅樣品中共分離出155株,獲得14種微生物,涵蓋11個屬,其中真菌5種[謝瓦曲霉(Aspergillus chevalieri)、釀酒酵母(Saccharomyces cerevisiae)、發酵畢赤酵母(Pichia fermentans)、橫梗霉(Lichtheimiasp.)和Trichomonascus ciferrii];細菌9種[解淀粉芽孢桿菌(Bacillus amyloliquefaciens)、枯草芽孢桿菌(Bacillus subtilis)、布氏慢生乳桿菌(Lentilactobacillus buchneri)、啄木鳥腸球菌(Enterococcus phoeniculicola)、成團泛菌(Pantoea agglomerans)、植物乳桿菌(Lactobacillus plantarum)、短發酵乳桿菌(Levilactobacillus brevis)、希爾加德慢生乳桿菌(Lentilactobacillus hilgardii)和高原芽孢桿菌(Bacillus altitudinis)]。所有樣品都分離到解淀粉芽孢桿菌(Bacillus amyloliquefaciens)和釀酒酵母(Saccharomyces cerevisiae)。隨著發酵時間增長,可培養微生物種類變化較大。入窖堆積樣品中分離到釀酒酵母(Saccharomyces cerevisiae)、解淀粉芽孢桿菌(Bacillus amyloliquefaciens)、Trichomonascus ciferrii、謝瓦曲霉(Aspergillus chevalieri)、橫梗霉(Lichtheimiasp.)、枯草芽孢桿菌(Bacillus subtilis)、啄木鳥腸球菌(Enterococcus phoeniculicola)和成團泛菌(Pantoea agglomerans),入窖池樣品分離到發酵畢赤酵母(Pichia fermentans),發酵12 d、發酵18 d和發酵24 d均分離到布氏慢生乳桿菌(Lentilactobacillus buchneri),發酵12 d樣品還分離到短發酵乳桿菌(Levilactobacillus brevis),發酵18 d分離到希爾加德慢生乳桿菌(Lentilactobacillus hilgardii)和高原芽孢桿菌(Bacillus altitudinis),發酵30 d樣品分離到枯草芽孢桿菌(Bacillus subtilis)。

表1 不同發酵時間酒醅樣品中可培養微生物分離結果Table 1 Isolation results of culturable microorganism of fermented grains samples at different fermentation time
2.2 不同發酵時間酒醅樣品微生物菌群結構分析
2.2.1 真菌群落組成分析
在屬水平上,基于高通量測序技術對7個不同發酵時間樣品真菌的種類和相對豐度進行分析,結果見圖1。由圖1可知,7個不同發酵時間樣品共測序獲得真菌435 114個OTUs,種水平上共有224種OTUs,優勢菌種(相對豐度>1%)主要有發酵畢赤酵母(Pichia fermentans)、橙色嗜熱子囊菌(Thermoascus aurantiacus)、謝瓦曲霉(Aspergillus chevalieri)、棉毛狀嗜熱霉(Thermomyces lanuginosus)、東方伊薩酵母(Issatchenkia orientalis)同物異名為庫德里阿茲威氏畢赤酵母(Pichia kudriavzevii)、少孢畢赤酵母(Pichia exigua)與臭曲霉(Aspergillus foetidus)。入窖堆積樣品中主要有橙色嗜熱子囊菌(Thermoascusaurantiacus)、謝瓦曲霉(Aspergillus chevalieri)和棉毛狀嗜熱(Thermomyces lanuginosus)3種菌,入窖池發酵樣品中主要包含發酵畢赤酵母(Pichia fermentans)、橙色嗜熱子囊菌(Thermoascus aurantiacus)、謝瓦曲霉(Aspergillus chevalieri)、棉毛狀嗜熱霉(Thermomyces lanuginosus)4種菌,隨著發酵時間的延長,發酵畢赤酵母(Pichia fermentans)、謝瓦曲霉(Aspergillus chevalieri)、棉毛狀嗜熱霉(Thermomyces lanuginosus)和少孢畢赤酵母(Pichia exigua)比例逐漸減小,東方伊薩酵母(Issatchenkia orientalis)逐漸增多。發酵時間在18~30 d時,微生物多樣性增多,相對豐度增大。
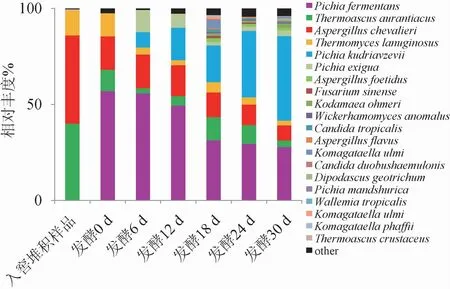
圖1 基于屬水平不同發酵時間酒醅樣品的真菌群落結構Fig.1 Fungal community structure of fermented grains samples at different fermentation time based on genus level
2.2.2 細菌群落組成分析
在屬水平上,基于高通量測序技術對7個不同發酵時間樣品細菌的種類和相對豐度進行分析,結果見圖2。由圖2可知,7個不同發酵時間樣品共測序獲得細菌422 720個OTUs,種水平上共有304種OTUs,發酵起始細菌種類較多,優勢菌種(相對豐度>1%)主要有金山醋酸乳桿菌(Acetilactobacillus jinshanensis)、耐酸乳桿菌(Lactobacillus acetotolerans)、解淀粉芽孢桿菌(Bacillus amyloliquefaciens)、考氏科薩克氏菌(Kosakonia cowanii)、魏斯氏菌(Weissella confuse)、乳桿菌屬(Lactobacillussp.)、雞葡萄球菌(Staphylococcus gallinarum)、巴氏醋桿菌(Acetobacter pasteurianus)、小片球菌(Pediococcus parvulus)、橋乳桿菌(Lactobacillus pontis)和發酵乳桿菌(Lactobacillus fermentum)。入窖堆積樣品中優勢菌種有10種,分別為解淀粉芽孢桿菌(Bacillus amyloliquefaciens)、考氏科薩克氏菌(Kosakonia cowanii)、魏斯氏菌(Weissella confuse)、雞葡萄球菌(Staphylococcus gallinarum)、斯氏泛菌(Pantoea stewartii)、戊糖片球菌(Pediococcus pen tosaceus)、橋乳桿菌(Lactobacillus pontis)、發酵乳桿菌(Lactobacillus fermentum)、直桿糖多孢菌(Saccharopolyspora rectivirgula)和類食品乳桿菌(Lactobacillus paralimentarius)。入窖池發酵樣品中主要包含金山醋酸乳桿菌(Acetilactobacillus jinshanensis)、解淀粉芽孢桿菌(Bacillus amyloliquefaciens)、考氏科薩克氏菌(Kosakonia cowanii)、魏斯氏菌(Weissellaconfuse)、雞葡萄球菌(Staphylococcusgallinarum)、戊糖片球菌(Pediococcus pentosaceus)、巴氏醋桿菌(Acetobacter pasteurianus)、橋乳桿菌(Lactobacillus pontis)、發酵乳桿菌(Lactobacillus fermentum)、直桿糖多孢菌(Saccharopolyspora rectivirgula)、乳酸乳球菌(Lactococcus lactis)、玫瑰色葡糖桿菌(Gluconobacter roseus)、舊金山乳酸菌(Lactobacillus sanfranciscensis)和解糖腸球菌(Enterococcus saccharolyticus)。隨著發酵時間延長,金山醋酸乳桿菌(Acetilactobacillus jinshanensis)快速增加,發酵18~30 d時,樣品中金山醋酸乳桿菌(Acetilactobacillus jinshanensis)和耐酸乳桿菌(Lactobacillus acetotolerans)相對豐度>97%。
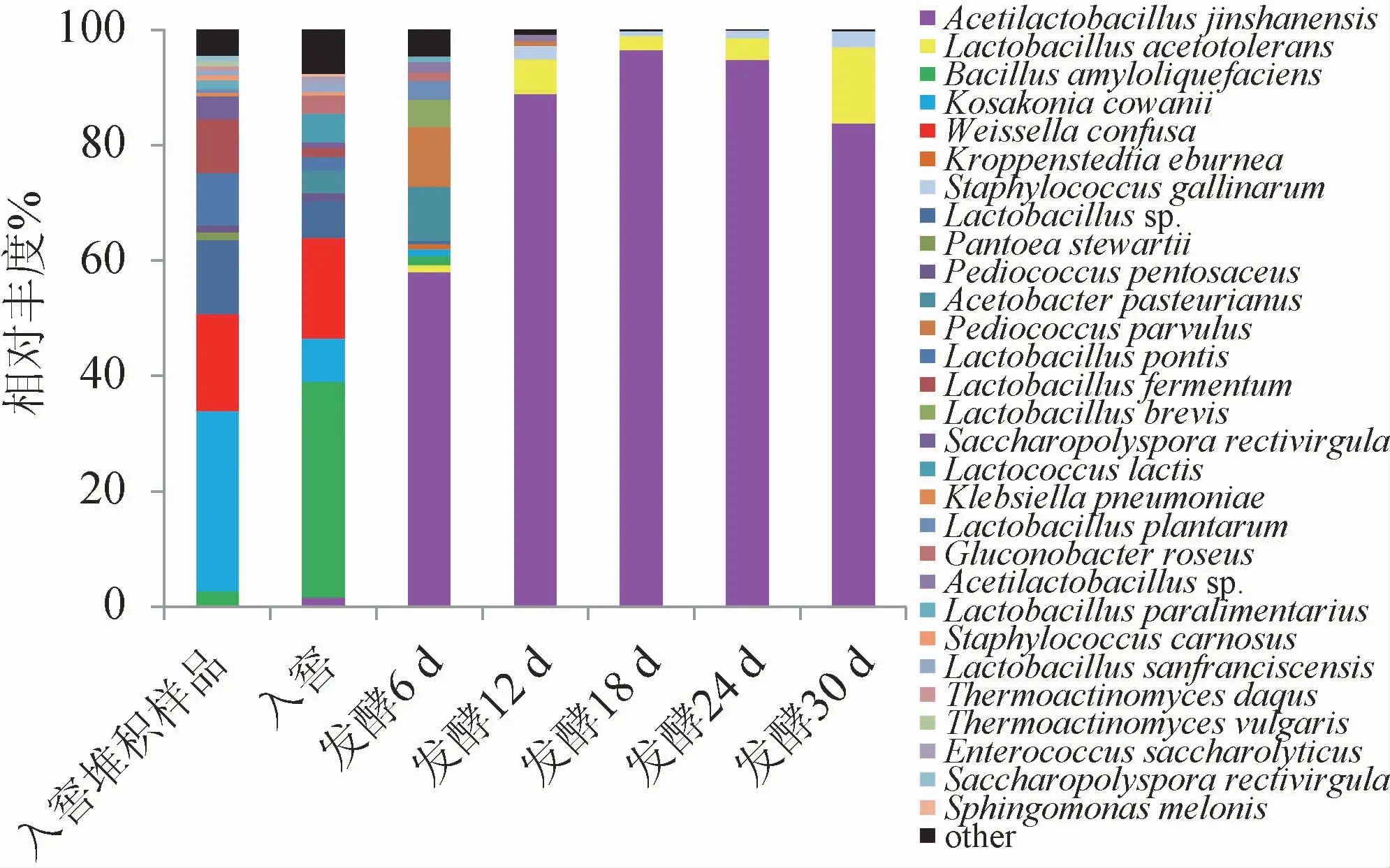
圖2 基于屬水平不同發酵時間酒醅樣品的細菌群落結構Fig.2 Bacterial community structure of fermented grains samples at different fermentation time based on genus level
2.3 窖池酒醅發酵過程中優勢菌特性分析
窖池酒醅發酵過程中細菌、酵母菌、霉菌之間有相互促進也有相互拮抗作用,隨著溫度、酒精濃度、酸度和氧氣含量等因素的變化,微生物群落結構不斷的演化,不同微生物對原料中淀粉和蛋白質分解,生成各類代謝產物[17]。這些代謝產物最終進入生化反應中進行大量復雜的物質轉化及能量代謝,形成重要風味物質。謝瓦曲霉(Aspergillus chevalieri)和臭曲霉(Aspergillus foetidus)有產酶和糖化的作用[18-19],枯草芽孢菌(Bacillus subtilis)、高原芽孢桿菌(Bacillus altitudinis)和解淀粉芽孢桿菌(Bacillus amyloliquefaciens)主要具有耐高溫、產酶、產香的功能,與一些風味物質(如吡嗪類化合物)的形成有關[20],發酵畢赤酵母(Pichia fermentans)在不同底物和不同環境調節下,代謝產物主要有醇、酯、酸[21-23],釀酒酵母(Saccharomyces cerevisiae)和東方伊薩酵母(Issatchenkia orientalis)可將葡萄糖在無氧條件下發酵成為酒精和二氧化碳,是主要的產酒酵母;Trichomonascus ciferrii具有重要產香功能[24],橫梗霉屬(Lichtheimiasp.)與芳香類物質呈顯著正相關[25],植物乳桿菌(Lactobacillus plantarum)與釀酒酵母共同作用對酯類、醇類和醛酮類等大部分揮發性物質的形成有明顯促進作用[26],金山醋酸乳桿菌(Acetilactobacillus jinshanensis)有利于有機酸的產生[27],耐酸乳桿菌(Lactobacillus acetotolerans)具有優良的耐酸和產酸特性,有利于其在白酒釀造過程中生長繁殖并豐富白酒風味[28]。考氏科薩克氏菌(Kosakonia cowanii)具有產阿魏酸酯酶功能,能夠增加麩皮、大曲和糟醅中阿魏酸的釋放量,使得樣品中阿魏酸含量增加[29]。魏斯氏菌(Weissella confuse)可以產生酸、醛、酮和酯等風味物質[30]。
2.4 Alpha多樣性指數分析
Alpha多樣性指數是用來分析樣本內的微生物群落多樣性,通過對樣本該指數的分析可以反映樣本內微生物群落的豐富度和多樣性。其中,Chao1和Ace指數是估計樣品中的物種總數,指數值越大,表示樣品中群落豐富度越高。Shannon 指數反映群落的多樣性,Simpson 指數反映群落中優勢種的集中程度,Shannon指數越大,Simpson指數越小,說明樣品中的物種多樣性越高。深度測序指數Coverage是指各樣品文庫的覆蓋率,其數值越高,則樣品中序列被測出的概率越高。不同發酵時期樣品中微生物群落結構多樣性指數分析結果見表2。
由表2可知,7個樣品真菌的Chao1指數在37.143~111.111,呈現先增大后降低趨勢;Ace指數在48.370~105.176,豐富度最高的是發酵12 d樣品,但與發酵6 d和發酵24 d不具有顯著差異(P>0.05),入窖堆積樣品顯著低于其他樣品(P<0.05)。樣品的Shannon指數在1.052~2.235;Simpson 指數在0.172~0.536,多樣性最高的是發酵18 d樣品,最低的是發酵6 d樣品。
由表2可知,7個樣品細菌的Chao1 指數在17.0 ~211.091之間,呈逐漸降低趨勢;Ace指數在19.303~213.195,豐富度最高的是發酵0 d樣品,但與發酵6 d樣品不具有顯著差異(P>0.05),發酵24 d與發酵30 d樣品顯著低于其他樣品(P<0.05),但二者之間不具有顯著差異(P>0.05)。樣品的Shannon指數在0.184~2.569;Simpson指數在0.139~0.932,發酵0 d與入窖堆積樣品多樣性最高, 但二者不具有顯著差異(P>0.05),發酵18 d顯著低于其他樣品(P<0.05)。所有樣品的Coverage均>0.999, 表明測序深度已經基本覆蓋到樣本中所有的物種。
2.5 不同發酵時期酒醅樣品及原酒理化指標測定
不同發酵時期酒醅樣品理化指標測定結果見圖3。 由圖3a可知,隨著發酵時間的增加,酒醅中的水分含量逐漸增加,增幅10.54%,微生物的生長繁殖和物質代謝都伴隨著水分的生成和消耗,水分在整個測量過程呈上升趨勢,由此可見發酵過程中產生的水分要大于消耗的水分。發酵前6 d水分含量由56.2%增加至58.8%,主要由于菌群快速繁殖,產生較多的代謝水,水的含量增加較快。 發酵6~24 d,水分含量增加減緩,主要由于氧氣的消耗,酒精度的增加,導致部分微生物死亡,代謝產生的水有所減少。發酵后6 d酒醅中水分含量上升最快,可以推測微生物在這段時間活動比較旺盛。

圖3 不同發酵時間酒醅樣品的理化指標測定結果Fig.3 Determination results of physicochemical indexes of fermented grains samples at different fermentation time
酒醅中酸度主要來源于部分微生物產酸代謝和脂肪、淀粉、蛋白質的降解。酸度是決定白酒質量的關鍵因素之一。窖池中適當的酸度可以抑制部分有害雜菌的生長繁殖,促進呈香呈味物質的形成,參與酯化過程。然而,窖池酸度過高,會使發酵緩慢,產酒率降低[31]。 由圖3b可知,發酵過程中酸度呈現持續上升的趨勢,酸度由入窖時的1.25 mmol/10 g增加到出窖的3.2 mmol/10 g,酸度增幅1.95 mmol/10 g。發酵前期霉菌、酵母菌大量增殖在酒醅中占據主導地位,產酸菌利用前期生成的還原糖和乙醇產生較多的酸,中后期隨著營養物質及氧的消耗,酵母菌逐漸衰亡,此時部分厭氧及兼性厭氧細菌大量增殖產生多種有機酸,使得酒醅酸度持續升高。
白酒釀造過程中,糟醅中淀粉和還原糖含量的動態變化既間接反映了乙醇生成和發酵狀態,也顯示了糟醅中微生物代謝活性。由圖3c可知,隨著發酵的時間增加,酒醅中的還原糖含量逐漸減少,還原糖降幅2.9%。發酵前6 d,還原糖減少很快,可見在發酵的前期還原糖被酵母菌和一些產酸菌大量利用導致產糖的減少,使還原糖快速下降;發酵6~18 d還原糖有少量增加,說明酒醅中的菌群糖化作用非常明顯,產生的還原糖略高于消耗的。 發酵18~30 d,還原糖快速降低,推測酒精的積累對糖化酶的抑制作用,消耗量明顯大于產生量。由圖3d可知,隨著發酵的時間增加,酒醅中的淀粉含量逐漸減少,淀粉消耗12.64%。淀粉在發酵前6 d由20.8%降至16.1%,消耗量比較大,這是因為菌群的糖化作用消耗了大量的淀粉;發酵6~24 d下降趨勢減緩,由16.1%下降至11.3%,一方面因為酸度以及酒精度的增大,抑制了淀粉酶的作用,另一方面可能是由于窖池氧氣的減少導致霉菌大量死亡,糖化作用減弱。發酵24~30 d,淀粉含量繼續快速下降,推測可能由于厭氧菌或兼性厭氧菌的繁殖,加速了淀粉的消耗。
原酒理化指標測定結果為總酸1.42 g/L,總酯3.81 g/L,酒精度66.7%vol。山東扳倒井股份有限公司評酒團隊對酒樣進行品評:聞香帶糟香,稍帶青味,較醇和,后味較長,帶甜香,較細膩。
2.6 原酒中揮發性風味物質GC-MS分析結果
通過GC-MS對原酒中揮發性風味物質進行檢測,結果見表3。由表3可知,原酒酒樣中共檢測出56種揮發性風味物質,其中酯類27種,酸類9種,醇類11種,烷類3種,其他6種。參考相關文獻,其中具有揮發性風味的物質41種,OAV>1的有兩種,正己酸乙酯OAV為6.326 2,辛酸乙酯OAV為1.725 7。正己酸乙酯具有甜香,水果香,窖香,青瓜香;辛酸乙酯具有梨子香,荔枝香,水果香,甜香,百合花香等氣味。此兩種物質為原酒中關鍵風味化合物,對樣品總體香氣貢獻較大。
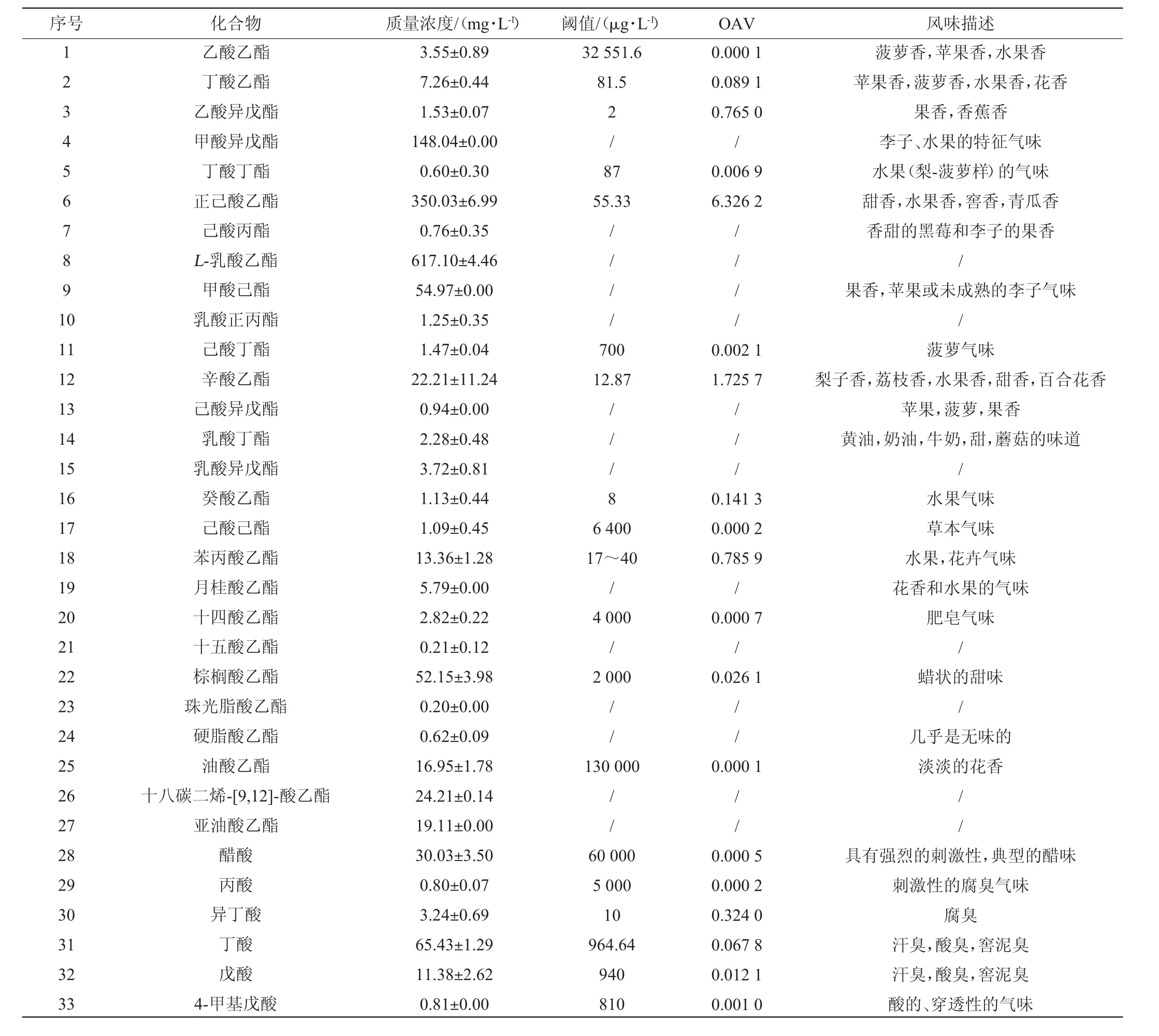
表3 原酒樣品中揮發性風味成分GC-MS檢測結果Table 3 GC-MS determination results of volatile flavor components in original liquor samples
3 結論
本研究對國井白酒窖池發酵中微生物群落結構及風味物質的進行了研究,通過可培養技術共分離獲得14種微生物,涵蓋11個屬,其中真菌5種,分別為謝瓦曲霉(Aspergillus chevalieri)、釀酒酵母(Saccharomyces cerevisiae)、發酵畢赤酵母(Pichia fermentans)、橫梗霉屬(Lichtheimiasp.)和Trichomonascus ciferrii;細菌9種,分別為解淀粉芽孢桿菌(Bacillus amyloliquefaciens)、枯草芽孢桿菌(Bacillus subtilis)、布氏慢生乳桿菌(Lentilactobacillus buchneri)、啄木鳥腸球菌(Enterococcus phoeniculicola)、成團泛菌(Pantoea agglomerans)、植物乳桿菌(Lactobacillus plantarum)、短發酵乳桿菌(Levilactobacillus brevis)、希爾加德慢生乳桿菌(Lentilactobacillus hilgardii)和高原芽孢桿菌(Bacillus altitudinis)。通過高通量測序發現真菌優勢菌主要有發酵畢赤酵母(Pichia fermentans)、橙色嗜熱子囊菌(Thermoascus aurantiacus)、謝瓦曲霉(Aspergillus chevalieri)、棉毛狀嗜熱霉(Thermomyces lanuginosus)、東方伊薩酵母(Issatchenkia orientalis)同物異名為庫德里阿茲威氏畢赤酵母(Pichia kudriavzevii)、少孢畢赤酵母(Pichia exigua)與臭曲霉(Aspergillus foetidus);細菌優勢菌主要有金山醋酸乳桿菌(Acetilactobacillus jinshanensis)、耐酸乳桿菌(Lactobacillus acetotolerans)、解淀粉芽孢桿菌(Bacillus amyloliquefa ciens)、考氏科薩克氏菌(Kosakonia cowanii)、魏斯氏菌(Weissella confuse)、乳桿菌屬(Lactobacillussp.)、雞葡萄球菌(Staphylococcus gallinarum)、巴氏醋桿菌(Acetobacter pasteurianus)、小片球菌(Pediococcus parvulus)、橋乳桿菌(Lactobacillus pontis)和發酵乳桿菌(Lactobacillus fermentum)。通過對不同發酵時間樣品理化指標測定,水分含量增幅10.54%,酸度增幅1.95,還原糖降幅2.9%,淀粉消耗12.64%。通過GC-MS分析,共檢測出56種揮發性風味物質,其中酯類27種,酸類9種,醇類11種,烷類3種,其他類6種。采用氣味活度值評價了各化合物對樣品總體風味的貢獻,發現正己酸乙酯和辛酸乙酯OVA較大,是原酒中關鍵風味化合物,對總體風味起到主要貢獻。

