吉西他濱聯合熱療對胰腺癌ASPC-1細胞增殖、遷移、侵襲和凋亡的影響及機制研究
習 攀,王 蒨,郭俊俊,李 量,李 雅
(1.陜西省腫瘤醫院放療科,陜西 西安 710061;2.陜西省腫瘤醫院內二科,陜西 西安 710061)
胰腺癌是具有侵襲性的、惡性程度較高的癌癥之一[1]。雖然男女發病率基本一致,但相對于白種人,非裔的發病率較高[2-3]。近10年來,胰腺癌全球發病率有所增加,這可能與肥胖、人口老齡化等因素相關[3-5]。但其病死率基本保持不變,胰腺癌的發病集中在70~80歲人群[6-9]。近20年來,中國胰腺癌發病率提高了近6倍[10]。目前,約80%胰腺癌患者在確診時已是晚期,其中1/3是局部晚期,而局部晚期胰腺癌患者的中位生存時間約6~10個月。
胰腺癌手術切除率低,術后復發率較高,故化療在胰腺癌綜合治療中發揮著重要作用。但目前胰腺癌的治療效果仍欠佳,其中吉西他濱(Gemcitabine,GEM)單藥的反應率僅28%左右[11-12]。分子靶向治療、免疫治療效果也遠低于預期,故需尋找更有效的治療方法。熱療是近些年出現的一種嶄新的癌癥治療技術,基本原理是將物理熱量投射到細胞內,從而形成熱效應來殺傷腫瘤細胞。熱療不僅對癌癥細胞有直接殺傷效果,而且還能強化化療的敏感性,最終誘發細胞凋亡。前期研究發現,特異性蛋白1(Specific protein 1,Sp1)、細胞周期蛋白D1(Cyclin D1)、環氧合酶-2(Cyclooxygenase-2,COX-2)、B細胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)等相關基因在癌癥細胞凋亡、侵襲及轉移過程中發揮重要作用。而熱化療在調節胰腺癌細胞增殖、遷移、侵襲以及誘導凋亡方面是否與Sp1、Cyclin D1、COX-2、Bcl-2等相關還有待驗證。因此,本研究探討GEM聯合熱療對胰腺癌ASPC-1細胞增殖、遷移、侵襲和凋亡的影響及可能的機制。
1 材料與方法
1.1 實驗細胞與主要試劑 人胰腺癌細胞株ASPC-1購自上海細胞庫;RPMI-1640培養基(批號:A1049105)、0.25%胰蛋白酶(批號:25200057)、磷酸鹽緩沖液(PBS,批號:1419020)、杜氏磷酸緩沖鹽溶液(DPBS,批號:1419014)購自美國Gibco公司;GEM (批號:G552001) 購自法國禮來公司;Sp1抗體(批號:PA5-29165)、Cyclin D1 抗體(批號:MA5-35331)、COX-2抗體 (批號:MA5-27783)、Bcl-2抗體 (批號:PA5-106039)購自Cell Signaling Technology (CST)公司;Transwell小室(批號:C2950)購自BD公司;MTT檢測試劑盒(批號:12-6696-42)購自美國Sigma公司;碘化吡啶(PI,批號:PA5-16661)、熒光染料DCFH-DA(批號:C2939)、實時熒光定量PCR(RT-qPCR)試劑盒(批號:C2940)購于自Takara公司。
1.2 實驗方法
1.2.1 細胞培養:在含有10%胎牛血清的RPMI-1640培養基中,將ASPC-1細胞懸浮并放置在37 ℃、5% CO2的細胞孵育箱中培養。
1.2.2 細胞分組與處理:將ASPC-1細胞隨機分為對照組、GEM組、熱化療組。對照組無任何處理。GEM組將濃度為30 μmol/L GEM溶解在RPMI-1640培養基中處理ASPC-1細胞24 h。熱化療組將ASPC-1細胞置于5%加濕CO2、43 ℃培養箱中孵育1 h后給予30 μmol/L GEM處理24 h。
1.2.3 MTT法檢測細胞增殖及活力情況:將ASPC-1細胞懸液接種于96孔板中,各組給予不同處理后在每孔中加入MTT,37 ℃孵育4 h。使用酶標儀在562 nm處檢測OD值,并計算細胞活力。
1.2.4 劃痕實驗檢測細胞遷移能力:將ASPC-1細胞以(0.5~1)×106個/孔的密度接種于6孔板中,在無血清培養基中過夜。次日,用槍頭在平板中間做劃痕后培養48 h,顯微鏡下每24 h觀察遷移的細胞并記錄遷移距離。
1.2.5 Transwell實驗檢測細胞侵襲能力:將ASPC-1細胞接種于Transwell上室(1×105個/孔)中,在Transwell下室中添加500 μl含20%胎牛血清的DMEM。常規條件孵育48 h后,將遷移的細胞固定并用結晶紫染色,顯微鏡下統計細胞數。
1.2.6 流式細胞儀檢測細胞凋亡情況:將ASPC-1細胞接種于10 cm培養皿中,收集細胞前24 h給予GEM,熱化療組給予GEM聯合熱療。取上清,清洗保留的細胞,離心后在200 μl結合緩沖液中重懸,然后與10 μl Annexin V-FITC和5 μl PI在4 ℃下反應30 min。加入300 μl緩沖液,在流式細胞儀上檢測凋亡細胞。
1.2.7 Western blot檢測相關蛋白表達:在培養皿中接種ASPC-1細胞后給予相應處理。將處理后的細胞用PBS洗滌2次,使用RIPA裂解液提取蛋白。用BCA試劑盒定量測定后,在10% SDS-聚丙烯酰胺凝膠上電泳,然后轉移到PVDF膜。在室溫下用5%脫脂奶粉封閉膜1 h后與抗Sp1、CyclinD1、Bcl-2、COX-2的一抗在4 ℃下反應過夜。用辣根過氧化物酶偶聯的IgG二抗在室溫下孵育1 h后檢測、顯影,采用Image-Pro Plus圖像分析軟件檢測條帶灰度值,以β-actin為內參,計算相關蛋白表達水平。
1.2.8 RT-qPCR檢測mRNA表達:采用1 ml TRIzol裂解緩沖液在三組處理過的胰腺癌細胞中提取總RNA。以2.5 μg總RNA為模板,使用反轉錄試劑盒合成cDNA,并進行定量PCR擴增。以GAPDH為內參,引物序列見表1。采用2-ΔΔCt法計算靶基因mRNA表達。

表1 各基因引物序列
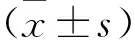
2 結 果
2.1 各組細胞增殖情況及不同熱化療方式細胞活力比較 見圖1。MTT結果顯示,30 μmol/L GEM對ASPC-1細胞增殖有抑制作用,熱化療組抑制作用更明顯(均P<0.05);30 μmol/L GEM聯合不同的熱療方式(化療前24 h給予43 ℃熱療1 h、化療同時熱療、化療后24 h給予43 ℃熱療1 h)的細胞活力分別為(50.45±3.77)%、(61.0±2.34)%、(71.74±2.14)%,GEM前熱療對細胞抑制作用更明顯(均P<0.05)。
注:與GEM前熱療比較,*P<0.05
2.2 各組細胞遷移及侵襲能力比較 見圖2、3。劃痕實驗結果顯示,與對照組比較,GEM組、熱化療組細胞遷移能力降低,且熱化療組細胞遷移能力降低更加明顯(均P<0.05)。Transwell實驗結果顯示,GEM組和熱化療組細胞侵襲能力較對照組降低,且熱化療組更明顯(均P<0.05)。

注:左圖為各組細胞劃痕實驗結果(×100)。右圖中,與對照組比較,*P<0.05;與GEM組比較,#P<0.05
2.3 各組細胞凋亡情況比較 見圖4。對照組、GEM組及熱化療組ASPC-1細胞凋亡率分別為(2.15±0.11)%、(4.12±0.20)%、(11.48±1.62)%。與對照組比較,GEM組和熱化療組細胞凋亡率升高,且熱化療組高于GEM組(均P<0.05)。
2.4 各組細胞Sp1、Cyclin D1、COX-2和Bcl-2蛋白表達比較 見圖5。與對照組比較,GEM組細胞Sp1、COX-2、Bcl-2蛋白水平降低(均P<0.05)。與GEM組比較,熱化療組Sp1、COX-2蛋白水平降低(均P<0.05)。
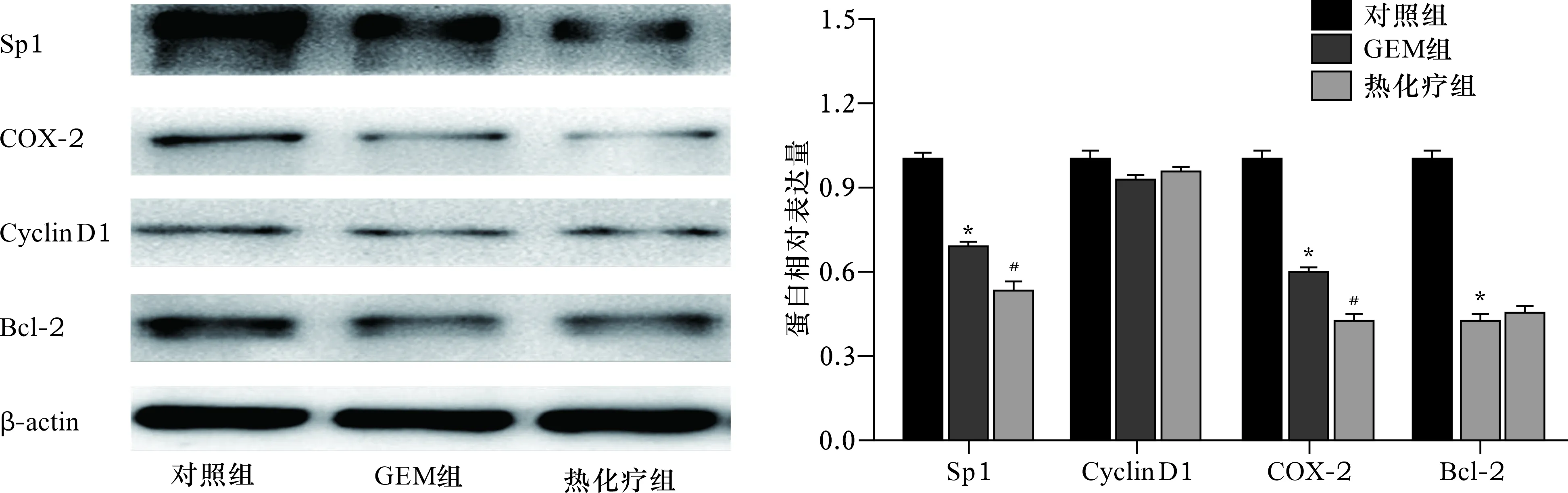
注:左圖為各蛋白電泳圖。右圖中,與對照組比較,*P<0.05;與GEM組比較,#P<0.05
2.5 各組細胞Sp1、Cyclin D1、COX-2和Bcl-2 mRNA表達比較 見圖6。與對照組比較,GEM組細胞Sp1、COX-2 mRNA表達降低(均P<0.05)。與GEM組比較,熱化療組Sp1、COX-2 mRNA表達降低(均P<0.05)。
3 討 論
熱療已在臨床實踐中用于各種腫瘤的治療,其抗腫瘤的有效性已在早期研究中得到了驗證[13-17]。隨機Ⅱ期和Ⅲ期臨床試驗證實了熱療治療乳腺癌、胰腺癌、宮頸癌、肺癌、頭頸部腫瘤、黑色素瘤以及胃腸道癌癥和肉瘤的效果[18-22]。此外,熱化療聯合治療已成為許多Ⅱ期和Ⅲ期臨床試驗的主題。例如,在臨床試驗中采用的熱療聯合順鉑、紫杉醇治療晚期卵巢癌的方案取得了較好的效果[23]。熱療通過降低細胞內pH值增加細胞膜的滲透性,從而提高了化療藥物的穿透與吸收能力。熱療對于化療也有增敏效果,主要源于熱療可以促進化療藥物誘導的細胞凋亡。化療耐藥的部分原因是由熱休克蛋白誘發的,而熱療則通過抑制部分熱休克蛋白的產生,從而防止化療耐藥的形成,這些在絲裂霉素、博來霉素、順鉑等藥物中得以證明[24-26]。但關于熱化療誘導癌癥細胞凋亡的機制目前仍不清楚。
有研究[27]證實,熱療可以抑制癌癥細胞的遷徙、轉移,胃癌細胞經42.5 ℃處理1 h后,細胞表面的分子發生變化,E-鈣黏素、B-整合素、黏附分子表達增多。研究[28-31]發現,經高溫(40~45 ℃,1~2 h)處理后的腫瘤細胞可表現為對化療藥物的敏感性顯著增加。通過局部熱療(42 ℃,30 min)聯合化療治療的胰腺癌患者,平均生存期超過單純化療的患者[32]。研究[33]發現,熱療通過降低膀胱癌細胞P糖蛋白、多藥耐藥相關蛋白1等蛋白的表達來逆轉耐藥,從而實現對化療的增敏。Sp1在肉瘤、結腸癌和胰腺癌中均有表達,研究表明Sp1在胰腺癌細胞中高表達且可作為胰腺癌患者生存預后的負性指標。在ⅡB期-Ⅳ期胰腺癌患者中,Sp1過表達與淋巴結轉移和較晚的癌癥分期有關,Sp1陽性患者的總生存期大幅縮短。作為轉錄因子,Sp1與多種蛋白(Cyclin D1、Bcl-2、COX-2)表達相關,這些蛋白同腫瘤增殖、侵襲、凋亡相關[34]。腫瘤細胞中Bcl-2過表達往往通過Sp1轉錄因子發揮作用。在胰腺癌細胞中,Sp1表達與COX-2表達呈正相關,抑制或過表達Sp1可導致COX-2的表達降低或升高[35]。
本研究發現,GEM聯合熱療對胰腺癌ASPC-1細胞增殖抑制作用較為明顯。GEM聯合熱療能顯著抑制ASPC-1細胞的遷移、侵襲并進一步誘導凋亡。為進一步研究熱化療對ASPC-1胰腺癌細胞增殖、遷移、侵襲抑制并誘導凋亡可能的機制,本研究測定了細胞內Sp1、Cyclin D1、Bcl-2和COX-2蛋白的表達,結果顯示與對照組比較,GEM組細胞Sp1、COX-2、Bcl-2蛋白水平降低;與GEM組比較,熱化療組Sp1、COX-2蛋白水平降低,并在mRNA層面上進行了驗證。
綜上所述,GEM聯合熱療可抑制胰腺癌ASPC-1細胞增殖、遷移和侵襲,并誘導凋亡,其機制可能與抑制Sp1及其下游基因COX-2有關。

