基于網絡藥理學和分子對接探討苗藥黑骨藤治療阿爾茨海默病的作用機制
舒燕霞 郭江濤 徐文芬 張永萍,2,3 孫開芬 石興雨 曾令琴
(1貴州中醫藥大學藥學院,貴州 貴陽 550025;2國家苗藥工程技術研究中心;3貴州中藥炮制與制劑工程技術研究中心)
阿爾茨海默病(AD),又稱老年癡呆,是一種中樞神經系統退變性疾病,其以廣泛性大腦皮質萎縮引起的認知功能減退、行為及人格變化為特征,也是導致老年人死亡的4大疾病之一〔1~3〕。調查結果顯示,全球約有5 000萬人患有AD,我國目前有近600萬的AD患者,65歲以上的老年人群中AD患病率高達3.21%,預計2040年將達到2 200萬人〔4~6〕。各國學者雖開展其相關新藥的研究,但大多以失敗告終。目前被批準用于治療的藥物,只針對AD的某個單一致病靶點進行預防或治療,雖在一定程度上改善患者癥狀,但不足以阻斷或逆轉其病理發展,且具有錐體外系癥狀、遲發型運動障礙等副作用〔7~10〕。
近年來,中藥以其多組分、多靶點、協同效果及毒副作用小等特點,已引起學者的廣泛關注。黑骨藤是貴州著名的十大苗藥之一,系蘿藦科杠柳屬植物黑龍骨的干燥根或全株,有祛風除濕、舒筋活血、止痛之效,主治風濕關節痛、跌打損傷、骨折骨痛及各種神經性疼痛等癥〔11~13〕。黑骨藤中含有黃酮類、甾體類、三萜類、蒽醌類等化學成分,具有抗類風濕、抗炎鎮痛、抗氧化及神經修復等藥理活性〔14~17〕,研究發現該藥材的抗氧化和神經修復作用能有效降低神經退化性疾病AD的發生〔16,18,19〕,揭示黑骨藤在治療AD方面具有很好的潛力,但目前關于黑骨藤治療AD的活性成分和作用機制尚未明確。
網絡藥理學從多成分、多靶點及多通路的角度出發,揭示藥物成分、靶點、疾病之間復雜的生物網絡關系,分析、預測藥物作用機制的研究方法〔20〕。分子對接技術則對于給定的蛋白質和配體,均可通過預測它們的結合模式及結合自由能,對其功能及作用機制進行研究〔21〕。因此,本研究采用網絡藥理學方法,從分子水平分析苗藥黑骨藤的有效成分,預測其作用靶點及相關信號通路,并采用分子對接技術對其核心靶點與活性成分進行對接,初步探討該藥材治療AD的作用機制,以期為黑骨藤治療AD的藥理研究和臨床應用提供理論基礎。
1 資料與方法
1.1苗藥黑骨藤活性成分及靶點數據庫的構建 通過中國知網(CNKI,https://www.cnki.net/)、萬方(https://www.wanfangdata.com.cn/index.html)、PubMed(https://pubmed.ncbi.nlm.nih.gov/)等數據庫收集黑骨藤的化學成分。借助中藥系統藥理學數據庫(TCMSP,http://tcm-spw.com/tcmsp.php),以口服生物利用度(OB)≥30%、類藥性(DL)≥0.18及分子量(MW)<500為限定條件對所收集到的化學成分進行篩選;尚未在TCMSP中收錄的成分則用Swiss ADME數據庫,以胃腸道吸收(GI absorption)的設置為“High”、DL滿足“Yes”為標準進行篩選,即可獲取兩個數據庫整合的活性成分庫。
在PubChem(https://pubchem.ncbi.nlm.nih.gov/)數據庫中獲取潛在活性成分的SMILES式,將SMILES式導入Swiss Target Prediction(http:swisstar-getprediction.ch/)數據庫,以Probability>0為篩選條件,預測出與活性成分相關的作用靶點;在SEA Search Server(https://sea.bkslab.org/)數據庫中,以人源基因為篩選標準獲取Swiss Target Prediction中尚未收錄的成分的相關靶點。整合Swiss Target Prediction、SEA Search Server數據庫活性成分相關靶點信息,篩除重復靶點,建立黑骨藤潛在活性成分的作用靶點庫。
1.2AD疾病靶點數據庫的構建 利用GeneCards(https://genealacart.genecards.org/)數據庫和OMIM(https://www.omim.org/)數據庫,以“Alzheimer′s disease”“AD”“mild cognitive impairment”“MCI”“dementia”為關鍵詞,進行人類基因檢索。在GeneCards數據庫中,由于疾病靶點數目龐大,則根據relevance score值進行中位數篩選,以獲得更相關的靶點。合并兩個數據庫AD疾病靶點,刪除重復項,建立AD疾病靶點庫。
1.3藥物-疾病交集靶點的獲取 將黑骨藤活性成分靶點和AD疾病靶點導入Venny2.1.0(https:// bioinfogp.cnb.csic.es/tools/venny/index.html)中,獲得交集靶點的韋恩圖,所得交集靶點即為黑骨藤活性成分可能作用于疾病的潛在靶點。
1.4“藥物-成分-成分靶點”“成分-疾病-交集靶點”網絡的構建 將1.1和1.3中的苗藥黑骨藤活性成分及其對應靶點、成分與疾病的交集靶點分別建立網絡文件,并編輯其屬性文件。將兩個文件導入Cytoscape3.8.0軟件中,構建“藥物-成分-成分靶點”和“成分-疾病-交集靶點”的可視化網絡。網絡圖的節點分別為藥物、疾病、成分、靶點,各節點之間的相互關系以邊表示。
1.5蛋白互作(PPI)網絡的構建及核心靶點的篩選 將1.3中得到的潛在作用靶點導入STRING數據庫(https://string-db.org),選擇“Multiple proteins”,設定物種條件為“Homo sapiens”,修改默認參數,選擇中等置信度為“0.400”,即獲得PPI網絡關系圖。在“Exports”中下載tsv.格式文件,將其導入Cytoscape3.8.0軟件,根據degree值調節節點大小和顏色深淺,繪制PPI網絡關系圖。在PPI網絡關系圖中,以大于度值(degree)、中介性和緊密性的中位數為標準,且根據度值排序,篩選其核心靶點,繪制核心靶點網絡關系圖。
1.6基因本體(GO)富集分析和基因組百科全書(KEGG)信號通路分析 通過HIPLOT(https://hiplot.com.cn/advance)數據庫,選擇GO/KEGG富集分析模塊,將1.3中的交集靶點導入數據表中,數據庫選擇“public/db/kegg/hsa_kegg_20210326.rds”、物種選擇“org.Hs.eg.db”,特殊參數設置P<0.05、Q<0.05。利用微生信(http://www.bioinformatics.com.cn/)平臺,將前10條功能注釋目錄和前20條信號通路目錄,以柱狀圖和氣泡圖的形式可視化。其中,GO富集包括生物過程(BP),分子功能(MF)和細胞組分(CC)。
1.7“活性成分-核心靶點-信號通路”網絡的構建 將1.6中KEGG分析的前20條信號通路所富集的靶點分別與1.1中苗藥黑骨藤各活性成分的靶點進行交集,各交集靶點合并,刪除重復項,建立網絡文件,并編輯其屬性文件。將兩個文件導入Cytoscape3.8.0軟件中,構建“活性成分-核心靶點-信號通路”的可視化網絡。
1.8活性成分與核心靶點的分子對接驗證 將黑骨藤的24個活性成分與PPI網絡中排名前5(degree>75)的核心靶點進行分子對接。在Zinc(http://zinc.docking.org/substances/home/)、PubChem數據庫獲取配體活性成分3D結構的mol 2或sdf.格式文件;通過Open Babel3.1.1軟件將小分子的sdf.格式轉化為mol 2格式。同時在PDB(https://www.rcsb.org/)數據庫中下載靶蛋白3D結構的pdb.格式,通過PyMOL2.4.1軟件將蛋白質中水分子和多余的非活性配體移除,并將結果導入到AutoDock Tools1.5.6軟件進行加氫、加電荷處理,輸出為pdbqt.格式。在Grid模塊設置對接搜索空間,通過Autodock vina運行分子對接過程,結合能Affinity<0表明受體和配體具有自發結合潛力,Affinity≤-5.0 kcal/mol說明化學成分與靶點對接效果較好〔22〕,最后利用PyMOL2.4.1軟件將對接結果進行可視化處理。
2 結 果
2.1活性成分及靶點數據庫的構建 將黑骨藤所含化學成分通過TCMSP數據庫篩選出潛在活性成分15個,見表1;TCMSP數據庫中未收載的成分,通過Swiss ADME數據庫篩選得到9個活性成分:Periforgenin C(HGT15)、3β,5β-dihydroxy-14-en-card-20(22)-enolide(HGT16)、臭矢菜素A(HGT17)、臭矢菜素B(HGT18)、(-)-丁香樹脂醇〔(-)-Syringaresinol,HGT19〕、(E)-1-(2,4-dihydroxy-phenyl)-Ethyl acrylate(HGT20)、鄰苯二甲酸二丁酯(HGT21)、滇杠柳苷元A(HGT22)、(+)-1-羥基松脂酚(HGT24)。將兩個數據庫的活性成分合并,最終得到24個活性化合物。在Swiss Target Prediction數據庫中,以Probability>0篩選得到各活性成分的作用靶點1 521個,并利用SEA Search Server數據庫,以人源基因靶點為篩選標準獲取Swiss Target Prediction中尚未收錄的活性成分的相關靶點70個。對兩個數據庫所收集的活性成分靶點進行整合,并剔除重復靶點,共得到黑骨藤活性成分潛在作用靶點574個。
2.2AD疾病靶點與交集靶點的獲取 通過GeneCards數據庫和OMIM數據庫獲取AD疾病靶點,其中GeneCards數據庫AD疾病靶點1 505個(relevance score≥13.15),OMIM數據庫525個,所有靶點合并剔除重復值后,得到1 513個AD疾病靶點。將1 513個疾病靶點與574個藥物靶點通過Venny 2.1.0網站在線分析,即可獲得159個交集靶點。
2.3“藥物-成分-靶點”“成分-疾病-交集靶點”網絡的構建 選擇黑骨藤的24個活性成分和106個潛在作用靶點(degree≥5)導入Cytoscape3.8.0構建“藥物-成分-靶點”網絡,并以degree值調節節點大小,該值越大則節點越大,見圖1;圖中共131個節點,740條邊代表該藥材化學成分與靶點之間的相互作用,活性成分節點越大,表明該成分所對應的靶點越多、靶點與成分之間的相互作用越強、成分越核心,體現了黑骨藤多成分、多靶點的特點。另將黑骨藤活性成分和交集靶點導入Cytoscape3.8.0構建“成分-疾病-交集靶點”網絡,見圖2;圖中184個節點、519條邊代表交集靶點與活性成分之間的作用關系。

表1 TCMSP數據庫的黑骨藤活性成分信息
2.4PPI網絡的構建及核心靶點的篩選 將159個交集靶點導入STRING數據庫,設置中等置信度為“0.400”,獲得蛋白相互作用關系,將其tsv.文件導入Cytoscape3.8.0軟件繪制PPI網絡,見圖3;網絡包含159個節點、1 981條邊、平均節點度值為24.9,節點代表靶點,邊代表蛋白間相互作用關系,線條越多表示關聯度越大。根據degree值調節節點大小和顏色深淺,degree值越大則節點越大、顏色越深,依據網絡拓撲學性質可知,有較多節點的化合物或疾病靶點在整個網絡中可能起到核心作用。
在PPI網絡關系圖中,以大于degree、中介性和緊密性的中位數為標準,綜合篩選得78個靶點,根據degree排序,選擇前20個(degree>45)靶點作為核心靶點,包括絲氨酸/蘇氨酸激酶(AKT)1、絲裂原活化蛋白激酶(MAPK)3、血管內皮生長因子(VEGF)A、類固醇受體輔助活化因子(SRC)、半胱氨酸蛋白酶(CASP)3等靶點,見表2、圖4;網絡包含20個節點、183條邊,根據degree值調節節點大小和顏色深淺,degree值越大則節點越大、顏色越深,說明其參與生物功能越多,作用越強。
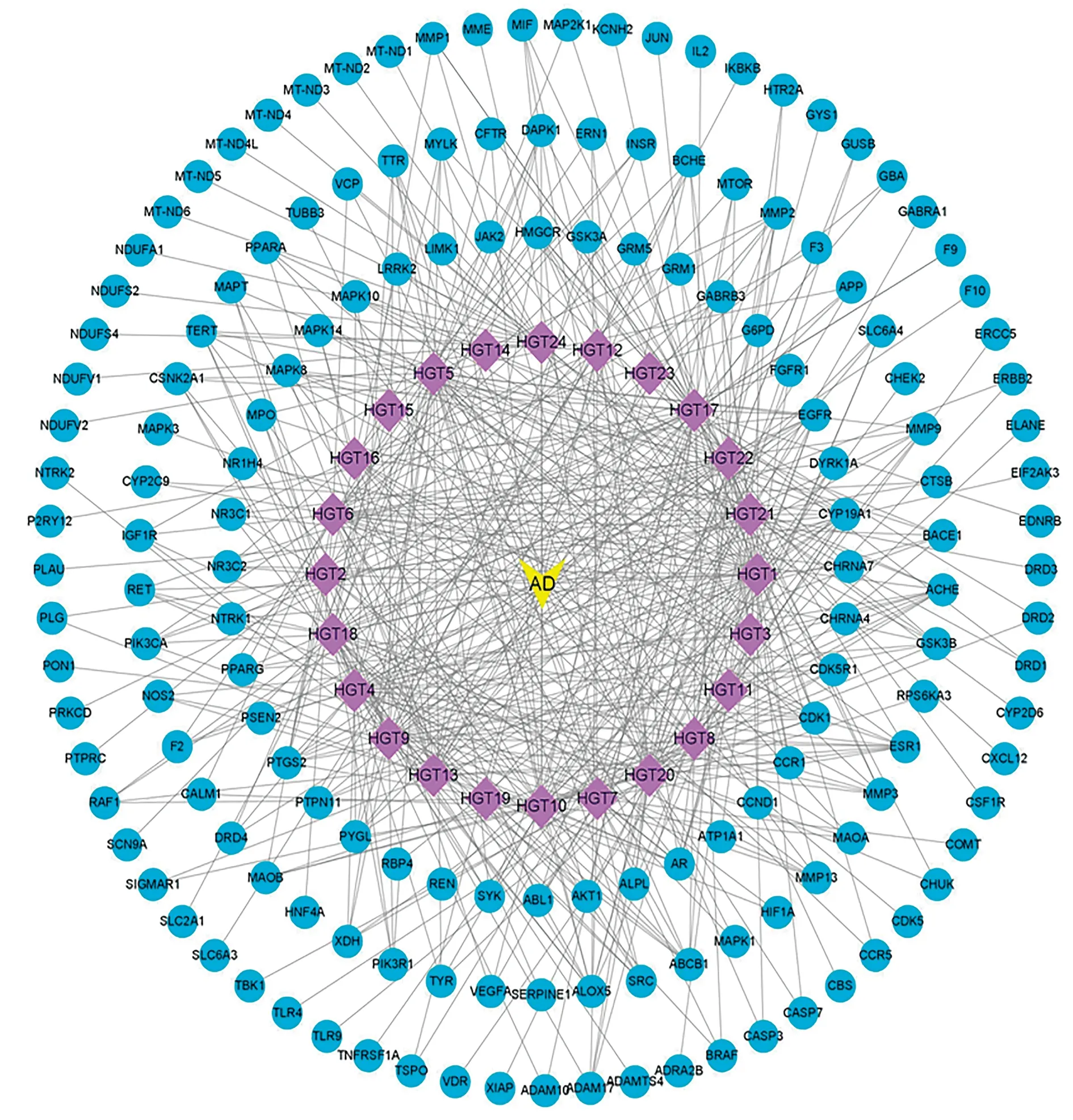
黃色“V”字形:AD;紫色菱形:活性成分;藍色圓形:交集靶點圖2 “成分-疾病-交集靶點”網絡
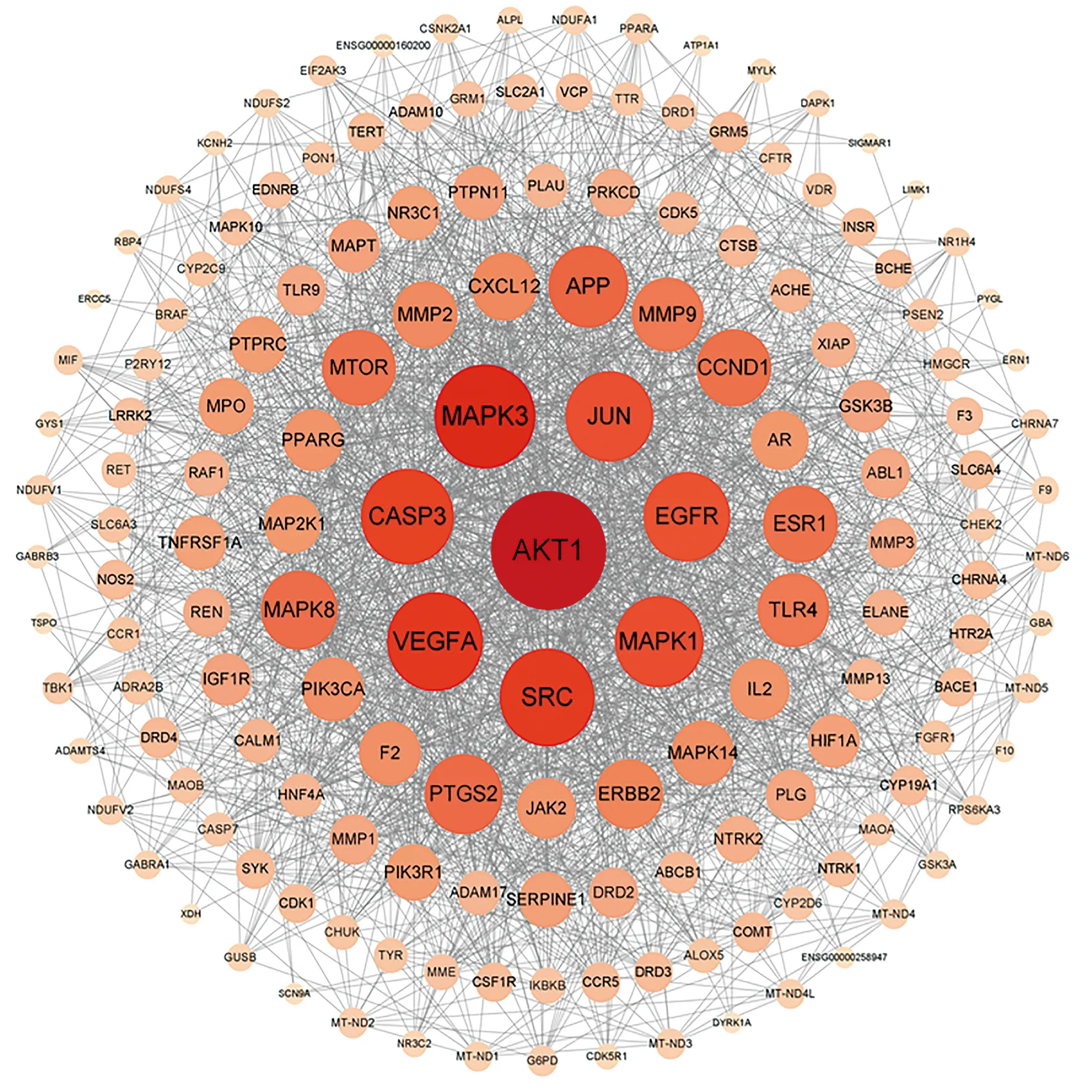
圖3 PPI網絡關系
2.5GO富集分析和KEGG信號通路分析 將159個交集靶點導入HIPLOT數據庫中,設置P<0.05、Q<0.05進行GO富集分析和KEGG信號通路分析。其中,GO富集分析得2 661條BP,涉及蛋白AKT活性的正調控、蛋白質的自磷酸化、神經細胞死亡等;587條MF條目,包括蛋白AKT活性、內肽酶活性、磷酸酶結合等;311條CC,涉及膜筏、膜微區、膜區等,根據基因數目排序,利用微生信平臺繪制3個聚類分析的前10條功能目錄的柱狀圖,見圖5。柱狀圖越高,表示在該通路上所富集的靶點越多,該通路越重要。KEGG信號通路分析得218個條目,結果表明基因主要富集于AD、神經退行性疾病的途徑-多發性疾病、炎癥和免疫(如卡波西肉瘤相關皰疹病毒感染)、癌癥中的蛋白多糖、人類巨細胞病毒感染、內分泌阻力、神經營養素信號傳導等相關通路。利用微生信繪制前20條信號通路的氣泡圖,見圖6。圖中橫坐標代表基因比率,縱坐標代表通路;氣泡越大表示在該通路上富集的基因數量越多,顏色越紅表示P值越小、富集的顯著性越高。
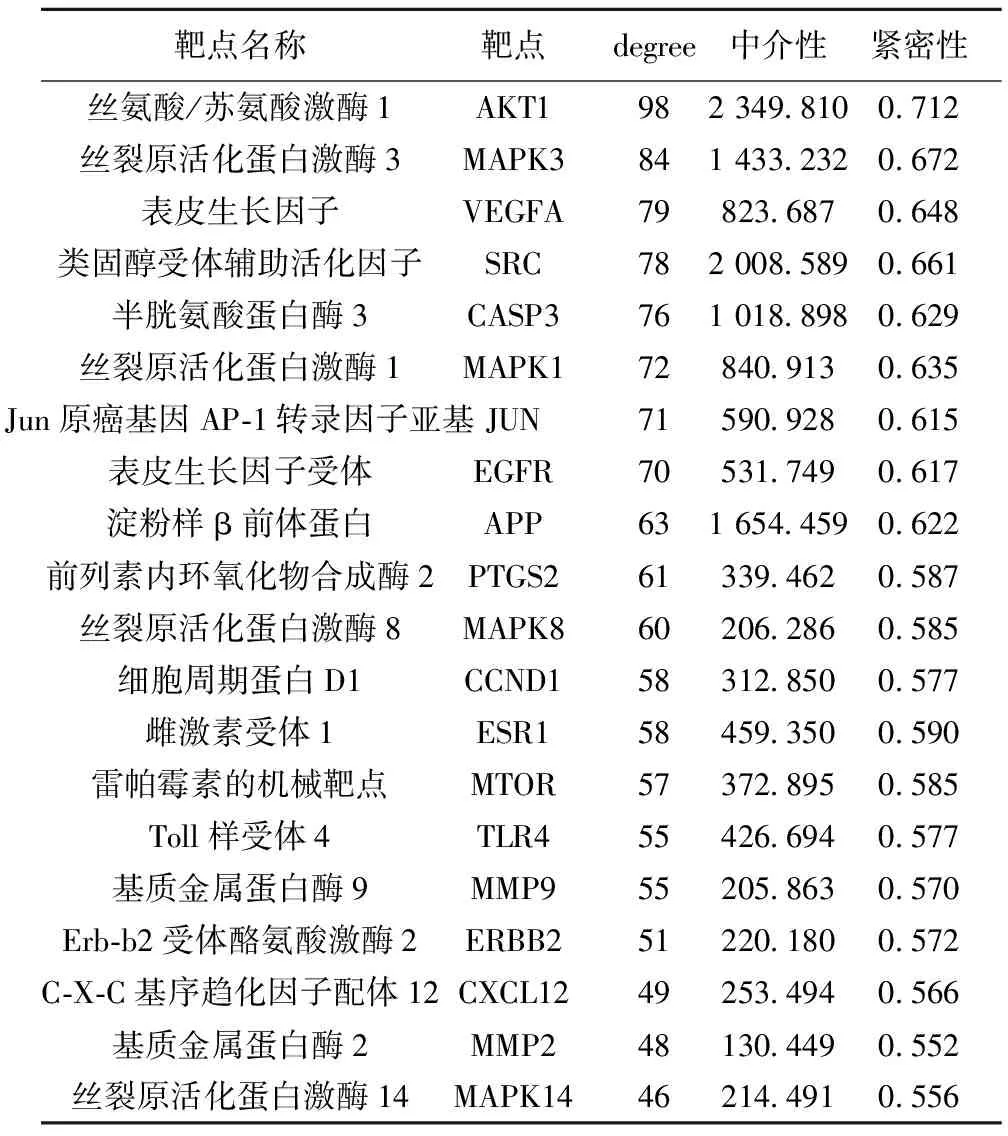
表2 PPI網絡核心靶點的拓撲參數(前20)
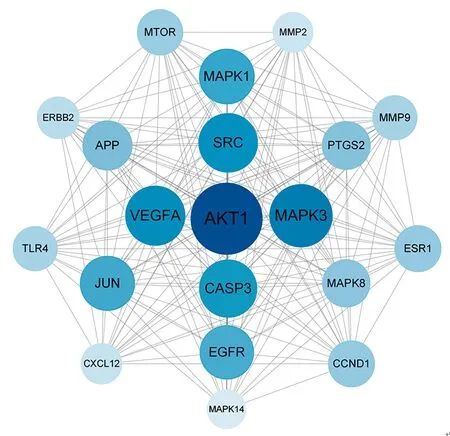
圖4 核心靶點(前20)
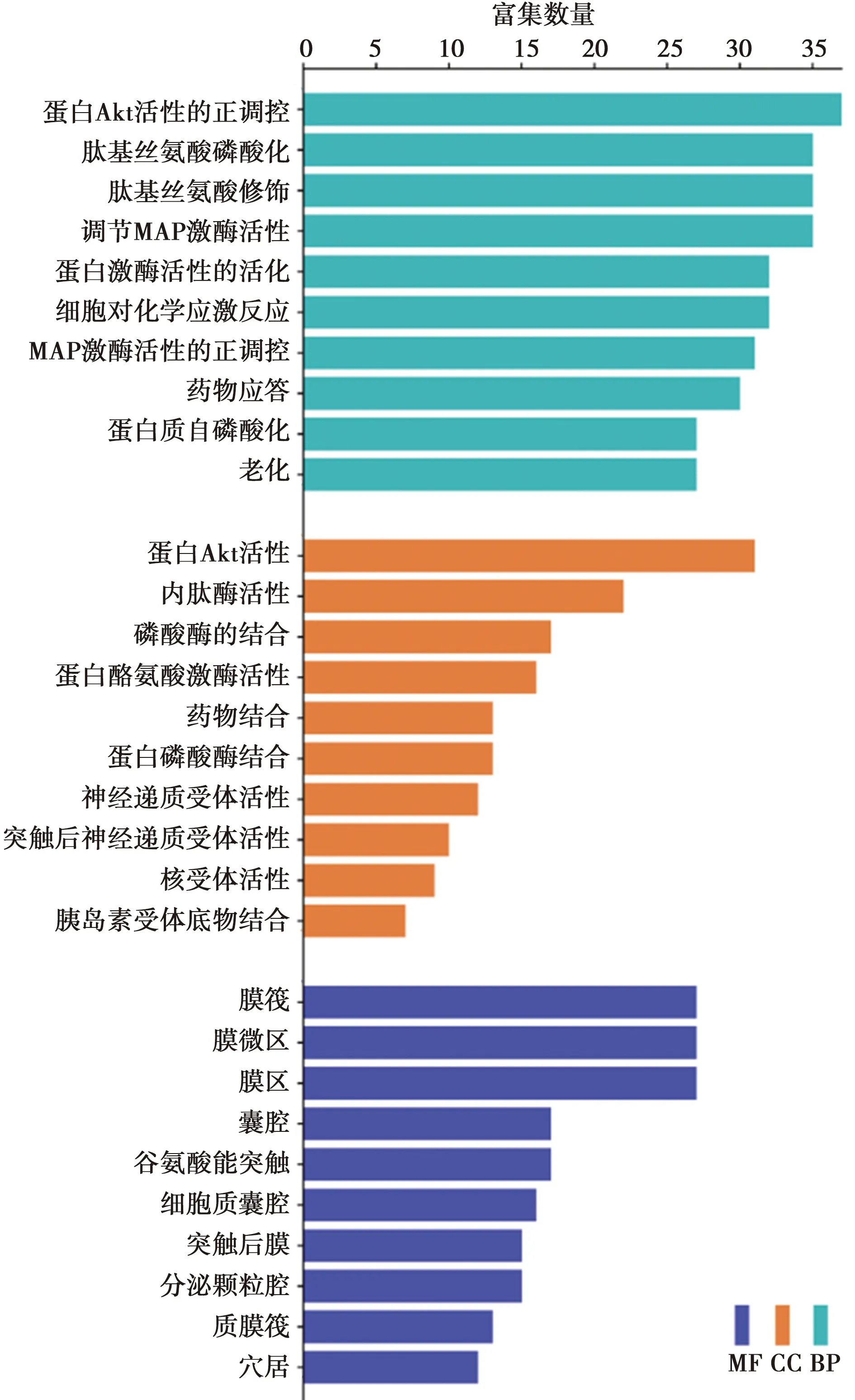
橫坐標:基因比率;縱坐標:通路圖5 苗藥黑骨藤抗AD潛在靶點的GO富集分析
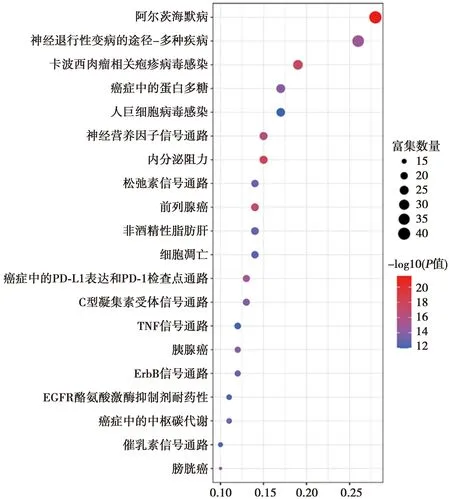
橫坐標:基因比率;縱坐標:通路圖6 苗藥黑骨藤抗AD潛在靶點的KEGG信號通路
2.6“活性成分-核心靶點-信號通路”圖的構建 利用Cytoscape3.8.0繪制“活性成分-核心靶點-信號通路”,根據degree值調節節點大小,degree值越大節點越大,說明其相互作用越強、對AD的影響越大,共有132個節點、720條邊,由圖7可知,苗藥黑骨藤治療AD是通過該藥中的24個活性成分作用于20個主要通路和88個靶點基因的結果。
2.7分子對接驗證 將24個活性化合物與5個核心靶點AKT1(PBD,ID:3OS5)、MAPK3(PBD,ID:6GES)、VEGFA(PBD,ID:6Z13)、SRC(PBD,ID:2PFH)、CASP3(PBD,ID:4QUJ)進行分子對接,最終得到120組受體-配體對接結果,見圖8。
成分與靶點的結合能及形成氫鍵數量是評價分子對接結果的重要依據〔23〕。一般認為結合能Affinity<0,化合物與蛋白可自發結合,結合能越低、氫鍵數量越多,結合就越穩定,靶點與分子作用的可能性就越大。分子對接結果顯示,120組受體-配體對接結合能Affinity均≤-5.0 kcal/mol,其中≤-9.0 kcal/mol的有33組,占27.5%,表明本研究中所預測的活性成分與關鍵靶點之間均具有較強的結合能力,證實了網絡藥理學預測結果的可靠性。將以上對接結果以PyMol2.4.1軟件進行可視化,部分結果見圖9。如圖所示,活性成分山柰酚、槲皮素、漢黃芩素等與關鍵靶點SRC、MAPK3、VEGFA等結合能均≤-9.0 kcal/mol,且氫鍵數量均≥3,表明其結合構象較穩定、結合能力較強。
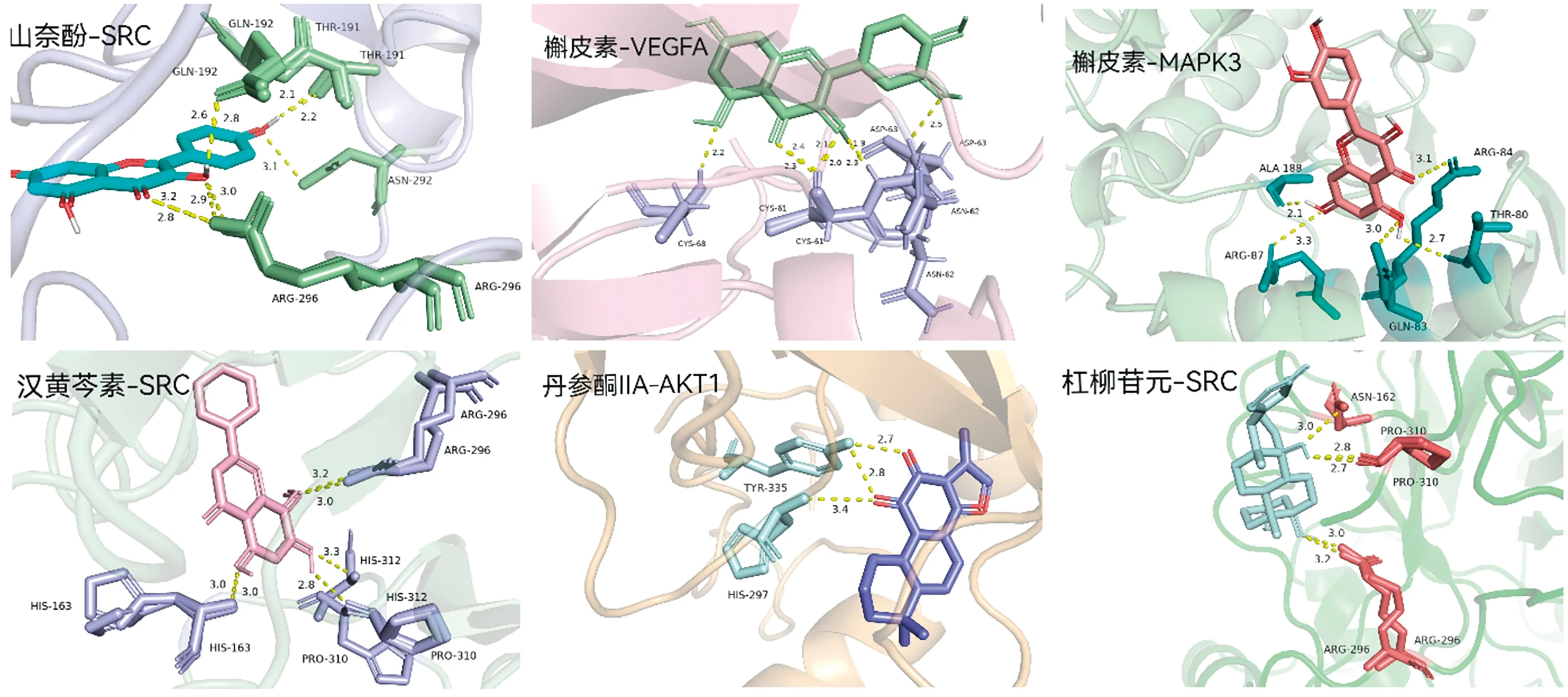
圖9 “核心成分-核心靶點”對接結果
3 討 論
本文采用網絡藥理學對苗藥黑骨藤的主要活性成分、作用靶點、相關生物信號通路及其抗AD的作用機制等進行了探討,并對其活性成分與相關核心靶點進行了分子對接。根據OB≥30%、DL≥0.18及符合類藥性五原則篩選獲得山柰酚、槲皮素、漢黃芩素、丹參酮ⅡA、杠柳苷元等24個潛在的活性成分。其中,槲皮素可提高體外培養神經元活性,改善氧化應激、炎癥反應,抑制AD動物腦內毒性片段β-淀粉樣蛋白(Aβ)1~42聚集、延緩Aβ的沉積速度,以改善AD大鼠記憶功能而達到治療AD的目的〔24,25〕。山柰酚可通過調節炎癥反應、改善膽堿能系統認知功能、抑制腦內Aβ的形成產生抗AD效應〔26~28〕。丹參酮ⅡA可通過抑制AD誘導的一氧化氮合酶(iNOS)及基質金屬蛋白酶(MMP)-2蛋白的表達,減少氧化性毒害自由基的產生來緩解AD癥狀〔29〕。漢黃芩素可抑制小膠質細胞的遷移率、減少趨化因子單核細胞趨化因子(MCP)-1和正常T-細胞表達分泌因子(RANTES)的分泌減緩AD進程〔30〕。杠柳苷元是黑骨藤中具有抗增殖作用的成分,可通過改變死亡受體介導的細胞凋亡,特異性地殺傷脂肪肉瘤細胞,進而治療AD〔31〕。
本研究共獲得黑骨藤活性成分作用靶點與AD疾病靶點的交集靶點159個,這159個靶點可能是該藥材抗AD潛在靶點。結合PPI網絡與分子對接結果發現,AKT1、MAPK3、SRC、CASP3及VEGFA等核心靶點與黑骨藤活性成分具有較好的結合性能。相關研究表明,AKT1在神經系統發育中是一個用于神經細胞調節的關鍵調控因子,其氧化修飾作用可導致突觸功能障礙,致使AD患者產生認知功能障礙〔32〕。MAPK能夠參與調節神經細胞的整個生命過程,激活MAPK可使神經元中tau蛋白磷酸化水平增加;而抑制海馬區MAPK表達可明顯改善記憶、認知功能和突觸可塑性,證明MAPK可能是治療AD的一個潛在靶點〔33,34〕。SRC是生長因子受體信號通路中重要組成部分,而CASP3、VEGFA等均與細胞凋亡密切相關〔35,36〕。因此,以上靶點可能在苗藥黑骨藤治療AD中發揮重要作用。
本文結果提示,黑骨藤治療AD呈現多成分、多靶點、多途徑的作用特點。本文KEGG代謝通路富集結果顯示,黑骨藤抗AD涉及的信號通路。排名最前的即為AD相關的信號通路,體現出苗藥黑骨藤治療AD具有較強的靶向性。炎癥在AD的發病過程中起著至關重要的作用〔37〕,Aβ的聚集會引起小膠質細胞和星形膠質細胞的激活,促炎細胞因子增多,激活的小膠質細胞,會產生更多的Aβ,進而導致額外的神經元損傷〔38〕。神經營養素信號傳導通路通過連接多種細胞內信號轉導調節,對于神經發育、學習記憶起著重要作用〔39〕。因此,結合分子對接和KEGG代謝通路富集分析結果發現,黑骨藤活性成分可能通過減少炎性因子分泌、激活神經營養蛋白信號通路、增加神經營養蛋白因子含量,發揮抗AD作用。
綜上,預測苗藥黑骨藤治療AD的活性成分、靶點、信號通路及發現黑骨藤可能是通過抗炎、激活神經營養蛋白信號通路及增加神經營養蛋白因子含量等方面治療AD,為黑骨藤抗AD藥效物質基礎及作用機制的深入研究奠定了研究基礎,后續尚需進行體內外藥效實驗驗證,為黑骨藤在臨床治療AD的應用提供理論支撐。

