以肺亞段為解剖單元的肺結節切除術單中心回顧性分析
孫翔翔,徐美青,章傳凱,柳常青,熊燃,吳漢然
中國科學技術大學附屬第一醫院(安徽省立醫院)胸外科,合肥 230001
肺癌作為全球第4位高發的腫瘤[1],在我國的發病率與病死率也逐年上升,治療方式也在不斷地探索與進步[2-3]。有學者[4-5]嘗試探索進行解剖性聯合亞肺段切除術,在保證切緣的前提下,能切除更少的肺組織,保留的肺組織功能仍接近生理狀態。鑒于該手術的復雜性,和對復發率以及死亡率的擔憂,該手術方式的臨床研究結果較少,適應證仍存在爭議。因此,本研究回顧性分析對比了以肺亞段為解剖中心行肺亞段切除術及肺段切除術患者的圍術期治療和短期隨訪結果,以探討該手術方式在治療早期肺癌的安全性和有效性。
1 資料與方法
1.1 一般資料 回顧性分析2019年5月至2021年10月于中國科學技術大學附屬第一醫院胸外科同一手術者行單孔胸腔鏡解剖性肺亞段切除術治療的肺小結節44例患者病歷資料(亞段組),包括單亞段切除和聯合亞段切除;另隨機選擇同期44例同一手術者行肺段切除術患者病歷資料(肺段組),包括肺段切除和聯合肺段切除。納入標準:(1)直徑≤2 cm的周圍型肺癌。排除標準:(1)擴大切除病灶;(2)存在淋巴結轉移;(3)術后病理提示良性病變。亞段組女性32例,男性12例;肺段組女性29例,男性15例。亞段組年齡(50.7±11.8)歲,肺段組(51.2±13.3)歲。亞段組體重指數(BMI)為(22.69±2.84)kg/m2,肺段組BMI(23.81±3.55)kg/m2。亞段組結節長徑為7.00(6.00~10.00) mm,肺段組結節長徑為7.00(6.00~9.75) mm,2組患者性別、年齡、體重指數(BMI)、結節長徑資料差異均無統計學意義,具有可比性。
1.2 研究方法
1.2.1 術前檢查 亞段組與肺段組術前均行CT薄層掃描+三維重建,亞段組結節中位直徑7(6~10)mm與肺段組7.00(6.00~9.75)mm比較,差異無統計學意義。術前常規檢查排除手術禁忌。
1.2.2 術前定位 術前采用CT引導下肺結節定位針定位(寧波勝杰康生物科技有限公司生產),以利于術中定位,縮短手術時間。
1.2.3 麻醉方法 雙腔氣管插管,健側臥位,單肺通氣。
1.2.4 切口選擇 上肺結節通常選擇腋前線第4或第5肋間,下肺結節通常選擇腋前線第5肋間。
1.2.5 靶段選擇 術前依據CT三維重建判斷結節所在位置,切除結節所在的肺段或肺亞段;如果結節處于2個肺段交界處,則行相鄰2個肺亞段聯合切除。
1.2.6 手術過程 在單孔胸腔鏡下使用電鉤或超聲刀進行肺門及靶段血管支氣管的解剖,由淺入深,靶段動脈及靜脈絲線結扎后超聲刀切斷,靶段支氣管使用內鏡直線切割縫合器切斷或絲線結扎后超聲刀切斷。“膨肺萎陷法”確定段平面,使用內鏡直線切割縫合器切斷亞段/段平面的肺組織。肺結節及淋巴結標本取出后立即送快速冰凍切片檢查明確病理性質。如為肺癌伴淋巴結陽性,則改為肺葉切除+系統性淋巴結清掃。良性結節或惡性結節但淋巴結陰性則結束手術。
1.2.7 術后隨訪 2組術后1個月及1年門診隨訪,復查胸部CT,評估疾病復發及生存情況。
2 結果
2.1 圍術期比較 2組患者清掃淋巴結數、胸液量、帶管天數差異無統計學意義。亞段組手術時間長于肺段組[132.5(107.5~158.0)min比90.0(80.0~120.0)min,P<0.05],并且亞段組術中出血量多于肺段組[20(20~30)mL比20(10~20)mL,P<0.05]。亞段組術后住院天數少于肺段組[4.00(3.00~4.75)d比4.00(3.25~5.00)d,P<0.05]。見表1。
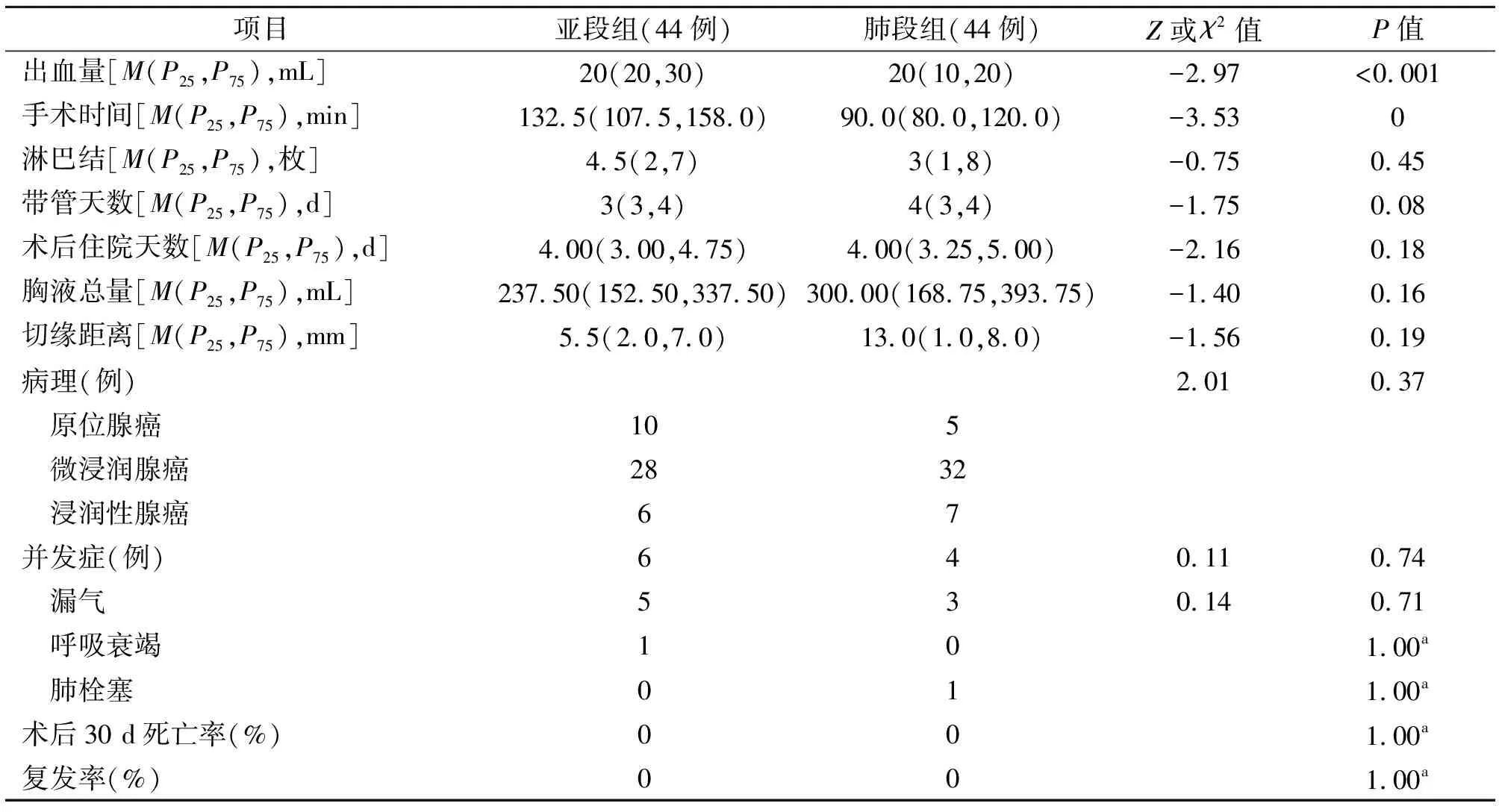
表1 匹配后單孔胸腔鏡肺亞段及肺段切除術圍術期及近期隨訪資料
2.2 并發癥及病理比較 術后亞段組發生漏氣5例,呼吸衰竭1例,肺栓塞0例;肺段組漏氣3例,呼吸衰竭0例,肺栓塞1例;2組并發癥之間差異無統計學意義(P=0.74)。亞段組病理提示原位腺癌10例,微浸潤腺癌28例,浸潤性腺癌6例;肺段組病理提示原位腺癌5例,微浸潤腺癌32例,浸潤性腺癌7例;2組病理類型差異無統計學意義(P=0.37)。見表1。
2.3 近期隨訪比較 2組1年后門診復查胸部CT,均無局部復發或轉移病例。
3 討論
1995年,Ginsberg和 Rubinstein進行了一項隨機對照試驗[6],比較了肺葉切除術和亞肺葉切除術對NSCLC患者術后效果的差別。自此,肺葉切除術和縱隔淋巴結清掃術便成為治療NSCLC 的標準手術方法[7]。高分辨率計算機斷層掃描(CT)在臨床得到廣泛使用,NSCLC能夠更早期的被發現[8]。CT上表現為磨玻璃樣結節(GGO)通常是早期肺癌,特別是早期肺腺癌的表現[4]。Saji和Okada將直徑<2 cm的肺結節進一步分組研究(JCOG0802/0804),歷經12年研究證實肺段切除在總生存期及肺功能方面顯著優于肺葉切除,對于最大徑不超過2 cm的周圍性肺結節,亞肺葉切除是一個不亞于肺葉切除的選擇[9]。對于胸膜下結節,楔形切除術可以滿足切緣足夠的要求[10]。深部結節可選擇肺段切除術,即能有足夠的切緣距離。若結節位于兩個段裂之間,肺段切除聯合肺楔形切除術方能保證足夠的切緣距離,但切除的肺組織較多[11];聯合肺亞段切除則能在保證足夠切緣距離的前提下,切除的肺組織更少[10]。但亞段切除以及聯合亞段切除手術難度較大,學習成本較高,開展較少。隨著三維立體成像技術的普及,手術難度得以降低,越來越多的醫生選擇開展亞段以及聯合肺亞段切除手術。
亞段及聯合亞段切除手術起步較晚,隨訪時間尚短,可行性及療效尚無統一結論。在規劃手術方式時,需要將患者身體狀況以及肺結節大小等多方面因素考慮在內。本研究中,經傾向性評分匹配后患者在年齡、性別、BMI、結節大小和病理類型等方面差異均無統計學意義。我中心結合術前三維重建技術,在術前即規劃好合適的手術路徑,以精準切除肺結節。術前識別腫瘤和血管的相對位置,有助于在使用胸腔鏡入路時確保足夠的安全距離[12-13]。同時,術前行CT引導下穿刺定位,以保證手術切除的準確性。聯合肺亞段切除術從葉間裂游離靶區域的動脈、氣管和靜脈[4],切除2個亞段的段間靜脈,而保留其他亞段之間的段間靜脈,不影響靜脈回流,使保留的肺組織接近生理狀態[10]。因為有側支循環通氣,處理完血管后,本研究沒有使用選擇性噴射技術,而是選擇膨肺萎陷法觀察亞段間平面,萎陷15 min即可觀察到亞段界限。有學者[12]報道,通過注射吲哚菁綠,可以在不使用膨肺的情況下使用熒光腔鏡識別段間平面,該技術需要熒光腔鏡等設備支持,顯示更快,界限明顯。本研究中2組均采用膨肺萎陷法觀察段間或亞段間平面,傾向性評分匹配后,亞段組手術時間長于肺段組,并且亞段組術中出血量多余肺段組,說明亞段切除術較肺段切除術存在較高難度及復雜程度更高。
淋巴結轉移是肺癌轉移的主要途徑之一,淋巴結受累情況是影響肺癌分期和預后的重要因素[7]。本研究中,圍術期淋巴結采樣數和淋巴結陽性數在2組間差異均無統計學意義。腫瘤切緣距離是預防局部復發的重要指標,切緣距離大于腫瘤直徑是預防復發的最佳選擇[14]。本研究中腫瘤切緣距離明顯大于腫瘤直徑,傾向性評分匹配后亞段組與肺段組在切緣距離上差異無統計學意義。Lopez-pastorini等[15]報道稱肺段切除術能夠有效減少術后引流液和住院時間。本研究中術后胸液總量和術后帶管天數等方面,亞段及聯合亞段切除術差異均無統計學意義,這確定了該術式的可行性,與Okamoto等[16]研究結果相同。本研究中2組并發癥以及30 d死亡率差異均無統計學意義,與相關報道[5]相同。因開展亞段及聯合亞段切除術時間較短,本組隨訪1年,2組均無局部復發及轉移患者。由此可以肯定,肺亞段及聯合亞段切除術在肺結節的治療上,與肺段切除術短期效果一致。
本研究旨在探索以肺亞段為解剖中心的肺亞段及聯合亞段切除術的可行性與安全性,存在以下局限性:首先,本研究為單中心回顧性研究,患者數量相對較少,本研究結果的代表性有限,該研究將繼續加大樣本量進行進一步驗證。其次,術后肺功能未能及時復查,對于該術式在肺功能方面的保護只能參考其他文獻。對于肺功能的保護,以及時間、鍛煉對肺功能的影響無法做到進一步研究。再次,該研究隨訪時間不足,不能嚴格的評判手術的長期效果。

