亞甲基四氫葉酸還原酶和纖溶酶原激活劑抑制物基因多態性與老年慢性腎衰竭的相關性
胡常暉,侯儆,張建軍,靳志雄
張家口市第一醫院,a 腎內科,b 急診科,c 普外一科,張家口 075000
慢性腎衰竭(CRF)是臨床常見疾病,其患病率在老年群體中日益增加,據統計,全球每年約有數百萬人死于腎臟疾病,老年CRF是其中的主要原因之一[1]。腎衰竭是一種臨床綜合征,通常由各種病因引起,如糖尿病、高血壓、腎小球腎炎等,然而研究表明遺傳因素也可能對腎衰竭的發生和進展起到重要作用[2]。亞甲基四氫葉酸還原酶(MTHFR)基因和纖溶酶原激活劑抑制物-1(PAI-1)基因是與老年CRF密切相關的兩個基因,其中MTHFR基因參與了體內甲基代謝途徑,與血液中同型半胱氨酸水平的調節有關,PAI-1基因編碼血管內皮細胞產生的重要調節因子,與血管內皮功能紊亂相關,因此這些基因的變異可能導致腎臟結構和功能的改變,從而增加腎衰竭的風險[3]。本研究旨在探究MTHFR和PAI-1基因多態性與老年CRF的關系,以期為腎衰竭的預防和治療提供更有效的基因遺傳學方面的指導。
1 對象與方法
1.1 研究對象 納入2020年2月至2023年2月張家口市第一醫院收治的100例老年CRF患者作為CRF組,同時期老年健康體檢者100例作為對照組。納入標準:①符合CRF診斷標準[4](CRF組);②尿毒癥期CKD 3~4期(CRF組);③腎功能正常(對照組);④年齡≥60歲;⑤能夠配合完成研究相關的檢查;⑥簽署知情同意書并同意參與本研究。排除標準:①肝功能異常者;合并心肌梗死、心力衰竭、嚴重心律失常等心血管疾病者;②合并活動性感染或正在接受抗生素治療者;③急性腎損傷或腎功能不穩定者;④妊娠或哺乳期女性;⑤存在其他嚴重疾病或嚴重生活不能自理的情況。CRF組男53例,女47例;年齡62~78(68.3±3.5)歲;對照組男51例,女49例;年齡60~80(67.9±5.1)歲。2組性別、年齡比較,差異無統計學意義(P>0.05),具有可比性。本研究方案經張家口市第一醫院醫學倫理委員會批準。
1.2 檢測方法
1.2.1 樣本采集 采集所有受試者外周血樣本及CRF組患者尿液樣本。
1.2.2 MTHFR基因型測定 采用酚/氯仿法提取血液樣本白細胞基因組DNA。根據選取的MTHFR、PAI-1等位基因,參照NCBI GeneBank進行引物序列設計,MTHFR C677T正向引物1:5-GAGAAGGTGTCTGCGGGAGC-3,正向引物2:5-GGAGAAGGTGTCTGCGGGAGT-3,反向引物:5-CGCTGTGCAAGTTCTGGACC-3,引物均由上海invitrogen生物工程公司合成。以基因組DNA為模板,進行聚合酶鏈式反應(PCR)擴增,擴增產物通過限制性內切酶切割,獲得目標DNA片段,通過凝膠電泳分析,得到不同基因型對應的DNA條帶圖譜,根據分析結果確定MTHFR C677T基因型。
1.2.3 PAI-1基因型測定 采用酚/氯仿法提取血液樣本白細胞基因組DNA。根據選取的MTHFR、PAI-1等位基因,參照NCBI GeneBank進行引物序列設計,PAI-1基因4G/5G多態性片段引物設計:正向4G引物P1:5′-GTCTGGACACGTGGGGA-3′;上游正向5G引物P2:5′-GTCTGGACACGTGGGGG-3′;上游遠端對照正向引物P3:5′-AAGCTTTTACCAT-GGTAACCCCTGGT-3′;共同的下游反向引物P4:5′-TGCAGCCAGCCACGT-GATTGTCTAG-3′,引物均由上海invitrogen生物工程公司合成。以基因組DNA為模板,進行PCR擴增,擴增產物通過限制性內切酶切割,獲得目標DNA片段,通過凝膠電泳分析,得到不同基因型對應的DNA條帶圖譜,根據分析結果確定PAI-1基因型。
1.2.4 腎功能指標 采用酶法測定血尿素氮、肌酐水平,腎小球濾過率采用改良MDRD公式進行估算。
1.3 觀察指標 比較CRF組與對照組MTHFR、PAI-1基因型與基因頻率分布情況,以及CRF患者MTHFR、PAI-1不同基因型血尿素氮、血肌酐、腎小球濾過率水平,采用logistics回歸分析MTHFR、PAI-1基因多態性與CRF患病的關系。
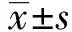
2 結果
2.1 2組MTHFR、PAI-1基因型與基因頻率分布比較 CRF組MTHFR C677T基因位點TT基因型、T等位基因占比及PAI-1 4G/5G基因位點4G/4G基因型、4G等位基因占比均高于對照組(P<0.05)。見表1、表2。

表1 2組MTHFR C677T基因型、基因頻率分布比較[例(%)]

表2 2組PAI-1 4G/5G基因型分布[例(%)]
2.2 CRF患者MTHFR不同基因型尿素氮、肌酐水平比較 MTHFR基因TT基因型的CRF患者尿素氮、肌酐水平均高于其他基因型(P<0.05),腎小球濾過率低于其他基因型(P<0.05)。見表3。
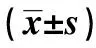
表3 CRF患者MTHFR C677T各基因型尿素氮、肌酐水平比較
2.3 CRF患者PAI-1不同基因型尿素氮、肌酐水平比較 PAI-1基因4G/4G基因型的CRF患者尿素氮、肌酐水平均高于其他基因型(P<0.05),腎小球濾過率低于其他基因型(P<0.05)。見表4。
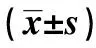
表4 CRF患者PAI-1各基因型尿素氮、肌酐水平比較
2.4 MTHFR、PAI-1基因多態性與CRF的關系分析 多因素logistics回歸分析顯示,MTHFR TT基因型、PAI-1 4G/4G基因型均為老年人CRF患病的獨立危險因素(P<0.05)。見表5。

表5 MTHFR、PAI-1基因多態性與CRF的關系分析
3 討論
老年人群中CRF的發病率較高,且其病因復雜,涉及多種遺傳和環境因素,研究基因多態性與老年CRF的相關性,可幫助我們深入了解該疾病的病因和發病機制,為CRF的診斷、預防和個體化治療提供科學依據和理論支持。
本研究探討了MTHFR和PAI-1基因多態性與老年CRF的相關性,結果表明,MTHFR C677T位點的TT基因型和PAI-1 4G/5G位點的4G/4G基因型與老年CRF的發生相關。MTHFR是一種關鍵的酶,在維持同型半胱氨酸代謝過程中發揮著重要的作用,其功能是在脫氧核苷酸合成途徑中將5,10-甲基四氫葉酸還原為5-甲基四氫葉酸,從而供給單碳基團進行DNA和RNA的合成[5]。MTHFR酶活性與C677T位點的基因型密切相關,其中TT基因型與酶活性的降低有關,因此會導致同型半胱氨酸水平升高。同型半胱氨酸是一種代謝產物,已經被證實與多種疾病的發生相關,可經腎臟過濾并通過腎小管排出體外,而高水平的同型半胱氨酸可導致腎小管細胞的損傷和腎小球的硬化,尤其是老年人體內腎小球硬化和腎小管細胞損傷的累積,可進一步增加CRF的發生風險[6-8]。本研究結果顯示,MTHFR C677T位點的TT基因型與老年CRF的發生相關,且MTHFR基因TT基因型的CRF患者尿素氮、肌酐水平均高于其他基因型,腎小球濾過率低于其他基因型,與既往研究[9]一致,表明MTHFR C677T位點TT基因型的個體更容易患上CRF,且該基因型的CRF患者腎功能損害更明顯。
PAI-1是一種重要的凝血系統調節因子,其主要作用是抑制纖溶酶原激活物的活性,從而影響纖溶酶原系統[10]。PAI-1的基因位點4G/5G位于PAI-1基因的啟動區域,已被證實與PAI-1的表達水平相關,4G等位基因的存在導致PAI-1表達水平增加,從而引起凝血和纖溶平衡失調[11-12]。本研究結果顯示,CRF組PAI-1 4G/5G基因位點4G/4G基因型和4G等位基因占比高于對照組,與既往相關研究[13]一致。本研究還發現PAI-1基因4G/4G基因型的CRF患者尿素氮、肌酐水平均高于其他基因型,腎小球濾過率低于其他基因型,這一結果表明PAI-1基因的多態性可能與老年CRF患者的腎功能損傷程度有關。分析其原因,PAI-1可能通過影響血管內皮功能、血液凝固和纖溶系統的平衡,從而影響腎小球的血流動力學,導致腎小球硬化,進一步影響腎小管功能。PAI-1基因4G/4G基因型在其他疾病中也被發現是一個危險因素,包括心臟病、糖尿病、高血壓等,這些疾病與腎臟疾病有許多共同的危險因素,如高膽固醇、肥胖等,這些共同的危險因素也可能與老年CRF的發生有關[14]。此外,MTHFR、PAI-1的遺傳多態性可能與環境因素相互作用,共同導致CRF的發生,因此進一步研究MTHFR、PAI-1基因多態性與老年CRF的關系,還需考慮環境因素和其他危險因素的影響[15]。本研究通過進一步的多因素logistics回歸分析顯示,MTHFR TT基因型、PAI-1 4G/4G基因型均為老年人CRF患病的獨立危險因素,提示MTHFR TT基因型和PAI-1 4G/4G基因型均為老年人CRF患病的獨立危險因素,且他們的影響可能是相互獨立的。
綜上所述,MTHFR C677T位點的TT基因型及PAI-1 4G/5G位點的4G/4G基因型均與老年CRF的發生相關,在老年人中應重視這兩種基因遺傳多態性對腎功能的影響。通過研究MTHFR和PAI-1基因多態性與老年CRF的相關性,還可以為其他相關疾病的研究提供參考和借鑒,許多疾病如心血管疾病、糖尿病、下肢深靜脈血栓等,也涉及基因多態性的影響。對基因與疾病之間關系的研究,不僅對于CRF的治療和預防具有重要的意義,也有助于推動其他疾病的研究和治療進程以及遺傳學和基因醫學領域的發展。

