山東省依企業申請藥品生產質量管理規范符合性檢查質量風險分析
曹鴻雁,趙杰,柴發永,張杰,柏建學
(山東省食品藥品審評查驗中心,山東 濟南 250014)
2019年12月1日起施行的《藥品管理法》[1]取消了藥品生產質量管理規范(以下簡稱GMP)認證,但GMP仍然是藥監部門檢查和企業從事藥品生產質量管理的根本遵循。《藥品管理法》《藥品注冊管理辦法》《藥品生產監督管理辦法》《藥品檢查管理辦法(試行)》等法律法規更新升級后,提出了藥品生產質量管理規范(以下簡稱“藥品GMP”)符合性檢查概念,并提出了新的更高要求。本文通過研究分析2021和2022年度依企業申請開展的藥品GMP符合性檢查情況,梳理總結各類檢查情形和分析檢查發現的質量風險,并有針對性地提出對策與建議。
1 藥品GMP符合性檢查依據的法律法規
藥品GMP符合性檢查,是藥品監督管理部門依據法規規章等有關規定對藥品上市許可持有人(以下簡稱持有人)、藥品生產企業實施藥品生產質量管理規范情況開展的監督檢查。藥品GMP符合性檢查分為依企業申請和依監管需要兩種情形。
更新后的國家法律法規對藥品GMP符合性檢查情形進行了明確規定:《藥品注冊管理辦法》[2]第四十七條、第四十八條、《藥品生產監督管理辦法》[3]第十六條、第五十二條以及有關實施公告第三條、《藥品上市后變更管理辦法(試行)》[4]第八條、《藥品檢查管理辦法(試行)》[5]第三十四條等。
藥品GMP符合性檢查涉及的法律法規較多,檢查情形較為復雜。為進一步加強藥品GMP符合性檢查工作,全國多個省局結合本省情況,先后出臺了相關政策文件,指導藥品GMP符合性檢查工作的開展。其中山東省藥監局印發了《山東省藥品生產質量管理規范符合性檢查工作程序》[6],分別對依企業申請和依監管需要開展藥品GMP符合性檢查進行了明確規定,并通過政策解讀對依企業申請的藥品GMP符合性檢查情形進行了闡述。
2 山東省依企業申請開展的藥品GMP符合性檢查情況
2.1 依企業申請開展的藥品GMP符合性檢查總體情況從新法實施后,依企業申請開展的藥品GMP符合性檢查數據顯示,2020年度開展61家次、2021年度開展135家次、2022年度開展140家次。從歷年檢查數據看,企業申報數量逐年增加,且情形復雜多樣。
梳理2021和2022年度依企業申請開展的藥品GMP符合性檢查發現,2022年度和2021年度申報數量差別不大,但2022年原料藥申報數量比2021年增加了67.6%,中藥飲片減少了64%。2021和2022年度檢查劑型/種類、家/次數詳見表1。

表1 2021和2022年度檢查劑型/種類、家/次數統計
2.2 依企業申請開展的藥品GMP符合性檢查辦理情形新修訂法律法規提出了系列藥品GMP符合性檢查的要求,通過研究分析發現,2021和2022年度的申報檢查情形基本一致。按現行國家法規體系,原料藥不得委托他人生產,所以從檢查情形看,原料藥不涉及委托生產,無菌制劑和非無菌制劑申報檢查情形基本一致。從表2中可看出,生產場地變更占比最高,該類檢查情形主要涉及自產增加委托、自產變更委托、委托變更自產或在原址新建、改擴建生產車間/生產線等情形。2021和2022年度依企業申請開展的藥品GMP符合性檢查情形見表2。

表2 2021和2022年度依企業申請開展的藥品GMP符合性檢查情形
3 依企業申請開展的藥品GMP符合性檢查發現的質量風險分析
GMP認證經過了多個發展過程,目前藥品企業生產質量管理水平整體較好[7],依據藥品GMP正文及附錄內容對2021和2022年度的檢查數據進行分類匯總分析發現,缺陷最多的章節都是集中在質量控制與質量保證、文件管理、設備方面,GMP附錄涉及的缺陷項目也較多。2021和2022年度依企業申請開展的藥品GMP符合性現場檢查缺陷分類情況見圖1。
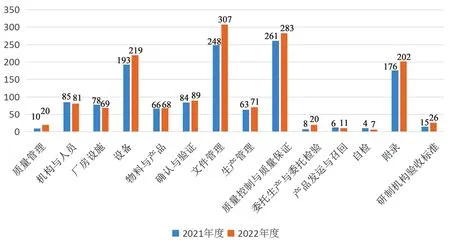
圖1 2021和2022年度藥品GMP符合性現場檢查缺陷分類情況
從現場檢查發現缺陷的風險程度看,不同企業、不同劑型的生產質量管理水平仍存在差異,其中在質量管理、生產管理、確認與驗證等方面發現的問題比較典型,存在一定質量風險。
3.1 質量管理方面的問題質量風險主要集中在風險評估、持有人委托生產方面,典型問題有:①質量風險評估不到位:如個別企業未充分評估不同無菌類型產品共線生產可能存在的風險;②持有人委托管理不規范:持有人駐廠QA對委托生產的監督內容中缺少對生產管理、檢驗管理進行監督的具體規定;持有人對受托方現場審計、生產監督不規范;持有人與受托方部分公用文件內容規定不一致,可操作性不強,如變更、偏差、信息溝通等都有文件規定,但雙方文件規定不一致。
質量風險管理是藥品生產質量管理體系的重要組成部分,企業質量風險評估不充分或不到位,特別是尚未識別到的風險,會給產品質量帶來安全隱患。隨著藥品上市許可持有人(MAH)制度的頒布實施,質量風險管理增加了新的內容,對MAH委托生產活動提出了新的挑戰,在委托生產前、后,MAH應基于風險管理理念,根據科學知識及經驗對受托企業開展全面有效的評估,特別是共線生產評估,確保將風險降低到可接受水平;另外,從檢查數據分析看,MAH委托在現場審計、過程監督、文件銜接等方面也暴露出了問題,MAH應建立涵蓋藥品全生命周期的質量管理和文件管理體系[8],確保委托產品生產質量管理全過程受控。
3.2 生產管理方面的問題質量風險主要集中在生產管理不到位、防混淆防交叉污染能力方面,典型問題有:①無菌操作不規范:B級區操作人員走動步幅較大;分裝操作人員多次進行扶倒瓶、剔除廢瓶的干預操作,干預頻率大于崗位操作規程規定次數;②顯示已清潔的設備罐內存在部分白色膏狀物殘留;離心機相連物料管道三通處存在盲管,易殘留物料,不易清潔;中藥前處理提取車間集塵間的排風口已堵塞,未及時清潔維護;③潔凈功能間個別中效、高效壓差出現異常情況,未及時進行處理;④個別超過復驗期的中藥材已取樣但未復檢卻用于投料生產。
產品是生產出來的,產品生產管理至關重要。從檢查數據分析看,生產管理方面的風險,特別是無菌操作規范性方面的,會給產品質量帶來風險。無菌制劑作為高風險產品,具有復雜性和特殊性[9],一直是檢查的重點劑型。歐盟于2022年8月25日發布了新版《無菌藥品的生產》GMP附錄(2023年8月25日生效),對無菌藥品生產和質量體系提出了新的更高要求,給無菌制劑生產企業帶來了更大的挑戰,企業應高度重視無菌制劑生產質量管理,科學評估無菌保障措施的有效性和適用性。
3.3 確認與驗證方面的問題質量風險主要集中在確認與驗證方案不完善、不全面,典型問題有:①企業未驗證除菌過濾器重復使用次數;②原料藥批量變更后企業進行了質量對比、雜質對比和1批穩定性考察,未進行工藝驗證;③清潔驗證擦拭取樣點的選取不充分,未涵蓋所有可能的風險點;④設備性能驗證參數未涵蓋實際使用參數;⑤培養基模擬灌裝驗證,未涵蓋模擬傳送軌道、自動進出料系統操作工位上的干預操作等。
確認與驗證涉及面廣,涵蓋廠房設施與設備驗證、工藝驗證、清潔驗證、分析方法驗證、計算機化系統驗證等方面[9]。從檢查數據分析看,風險主要出現在設備驗證、工藝驗證、清潔驗證方面,分析原因可能是評估不充分或考慮問題不全面,未合理確定驗證的范圍和程度,未科學評價驗證產生的數據,導致相關工作做得不全面、不規范。
另外,在檢查缺陷分析過程中發現,企業在數據管理方面也存在突出問題,質量風險主要集中在數據不完整、記錄不及時、不便于追溯方面,典型問題有:①在原料藥現場檢查中發現數據真實性案例:動態生產工藝與《化藥原料藥生產工藝信息表》不一致,現場檢查未通過;②氣流粉碎機除塵濾網規定使用次數,但實際無證明使用次數的記錄或臺賬;③灌裝崗位人員剔除碎瓶的干預操作完成后未及時進行記錄;④未記錄退回物料的車間來源;⑤模擬灌裝記錄中未體現開門干擾和維修開門干擾的具體操作內容和時限。
《藥品記錄與數據管理要求(試行)》[10]明確了對記錄與數據的基本要求,記錄方面要求“保證全過程信息真實、準確、完整和可追溯”,數據方面要求“保證數據真實、準確、完整和可追溯”。記錄與數據的管理貫穿藥品生產質量管理的全過程,從檢查數據分析看,企業在真實性、完整性、可追溯性方面存在一定風險,分析其原因可能是企業對記錄與數據管理的認識或文件規定內容執行不到位,企業應高度重視記錄與數據管理工作,科學評估數據可靠性管理以及數據在其生命周期內的每一個環節與期望之間的差距以及可能帶來的數據管理風險[11],確保記錄和數據真實、準確、完整、可追溯。
4 對策與建議
通過對山東省2021和2022年度依企業申請開展的藥品GMP符合性檢查情況分析發現,隨著藥品法律法規及政策紅利的持續釋放,企業申報的檢查情形日趨多樣化復雜化,為進一步做好依企業申請開展的藥品GMP符合性檢查工作,從企業和監管兩個方面提出以下幾點建議。
4.1 從企業角度①進一步落實持有人主體責任。MAH應當遵守《藥品管理法》等相關法律法規,嚴格落實持有人主體責任,嚴格貫徹落實GMP及附錄和不斷更新的藥品相關技術規范要求,不斷健全完善藥品質量管理體系,依法對藥品生產全過程中藥品的安全性、有效性、質量可控性負責;應強化風險管理,重點關注在生產質量管理方面存在的薄弱環節,加強對全生命周期的質量管理,特別是委托生產,要按照相關要求做好對受托方質量管理體系的審核和生產全過程的質量監督,做好委托方與受托方的體系銜接,保證產品質量;②進一步做好藥品上市后變更管理工作。企業應加強對變更相關法規政策、技術指導原則的學習研究,與企業實際情況緊密結合,合理判斷并準確厘清申請主體、申請范圍、申請情形等,特別是變更生產場地,是上市后變更最復雜的情形,往往關聯到生產工藝變更、工藝參數調整、生產設備更新、物料供應商變更、批量擴大等[12]。企業要確保經科學評估和必要的驗證確定變更類別再實施變更,在貫徹實施GMP時落實好變更管理相關要求,有效預防合規風險。
4.2 從監管角度①精準把握藥品法律法規政策。《藥品管理法》實施后,藥品相關法律法規、指導原則、技術指南等文件更新較為頻繁,鑒于當前法規政策要求與企業申報情形的多樣化、復雜性,需精準把握各藥品相關法律法規的內涵及要求,科學高效開展現場檢查;②明確藥品GMP符合性檢查重點。針對不同劑型、不同檢查情形,明確檢查重點[13-15],如,針對場地變更情形,應重點關注變更研究、變更評估及相關驗證工作;針對原料藥轉“A”后上市前符合性檢查事項,應在全面評估企業質量管理體系的前提下,重點關注企業現行工藝與已批準的化學藥品工藝信息表的一致性,特別是基于風險未啟動注冊現場核查的品種。
總之,執行藥品 GMP,是從事藥品生產活動的基本要求。隨著國家藥品法律法規體系的不斷完善更新,藥品GMP符合性檢查將在藥品全生命周期發揮重要作用[7]。MAH應不斷強化風險管理理念,落實好持有人主體責任;監管部門要不斷增強識別風險的能力,督促持有人落實好主體責任,全面保障藥品質量安全。

