基于呂氏泰勒蟲4種靶基因的PCR檢測方法比較
田萬年,李 奇,寧宇春,杜秋明,鄭秀紅
(1. 吉林農業科技學院動物科技學院,吉林 吉林 132101 ; 2. 延邊州動物疫病預防控制中心,吉林 延吉 133000 ; 3. 龍井市德新鄉綜合服務中心,吉林 龍井 133400)
羊泰勒蟲病是由泰勒科、泰勒屬的原蟲寄生于羊的紅細胞和淋巴細胞所引起的一種血液原蟲病[1]。本病對羔羊和外地引進羊危害嚴重,病羊感染后臨床癥狀多表現為消瘦、貧血、黃疸和血紅蛋白尿,本地羊多表現為帶蟲免疫[2]。我國已報道的可感染羊的泰勒蟲主要有呂氏泰勒蟲(Theilerialuwenshuin)、尤氏泰勒蟲(Theileriauilenbergi)和綿羊泰勒蟲(Theileriaovis)[3]。呂氏泰勒蟲病病原檢測主要依靠血液涂片鏡檢,由于隱性感染羊的血液染蟲率較低,血液涂片檢測易漏診或誤診,PCR檢測方法具有更高的特異性和敏感性,對病原體的診斷更加可靠、準確。
目前,用于呂氏泰勒蟲病PCR檢測的靶基因有核糖體小亞基RNA(Small subunit ribosome RNA,18S rRNA)基因、主要表面蛋白(Major piroplasm surface protein,MPSP)基因、內轉錄間隔區(Internal transcribed spacer,ITS)基因和線粒體細胞色素C氧化酶1(Cytochrome C oxidase subunit 1,Cox1)基因[4-8]。本試驗選取以上4種靶基因對呂氏泰勒蟲進行PCR檢測,對比不同靶基因PCR檢測方法的特異性和敏感性,通過對45份臨床綿羊血液樣本進行PCR檢測,篩選出呂氏泰勒蟲最佳PCR檢測方法用于該病的診斷和流行病學調查。
1 材料與方法
1.1 樣本來源 綿羊血液樣本于2019年6月采自吉林省圖們市散養綿羊,共45份,同時制作血液涂片,吉姆薩染色鏡檢。呂氏泰勒蟲陽性DNA由本實驗室分離并保存[9]。中華泰勒蟲DNA、附紅細胞體DNA和卵形巴貝斯蟲DNA由延邊大學薛書江博士惠贈。
1.2 主要試劑 血液基因組DNA提取試劑盒、瓊脂糖凝膠DNA回收試劑盒和DL2 000 DNA Marker,均購自寶日醫生物技術(北京)有限公司;TaqPreMix,購自于天根生化科技(北京)有限公司。
1.3 主要儀器 高速低溫離心機(5810R),德國艾本德公司;PCR儀(9700),美國ABI公司;瓊脂糖水平電泳槽(DYCP-31C)和凝膠成像分析系統(WD-9413B),均購自北京六一生物科技有限公司。
1.4 引物的設計和合成 根據參考文獻[5-8]合成呂氏泰勒蟲18S rRNA、MPSP、ITS和cox1基因引物,篩選出檢測呂氏泰勒蟲的最佳靶基因。根據GenBank上呂氏泰勒蟲18S rRNA序列(登錄號:AY262119)設計5對引物(表1),篩選擴增18S rRNA基因的最佳引物。所有引物均由吉林省庫美生物科技有限公司合成。

表1 引物信息Table 1 Primer details
1.5 血液DNA提取 采用血液基因組DNA提取試劑盒提取羊血液樣本基因組DNA,取5 μL提取的基因組DNA,通過1%瓊脂糖凝膠電泳檢測,凝膠成像分析系統拍照記錄。
1.6 PCR擴增 基于18S rRNA、MPSP、ITS和cox1基因的PCR反應體系(25 μL):ddH2O 9 μL,TaqPreMix 12.5 μL,基因組DNA 2.5 μL,上、下游引物各0.5 μL。PCR反應條件:95 ℃預變性3 min;94 ℃變性45 s,56~60 ℃ 退火45 s,72 ℃延伸30 s,34個循環;72 ℃延伸7 min。不同靶基因陽性PCR產物分別膠回收后,連接到pMD-19T載體,轉化至大腸桿菌DH5α 感受態細胞中,提取質粒DNA進行PCR鑒定,鑒定為陽性的重組質粒送往吉林省庫美生物科技有限公司測序。
1.7 特異性試驗 以呂氏泰勒蟲、中華泰勒蟲、卵形巴貝斯蟲和附紅細胞體DNA為模板,分別應用4對引物進行PCR擴增,分析不同靶基因PCR檢測方法的特異性。
1.8 敏感性試驗 分別對呂氏泰勒蟲4種靶基因重組質粒DNA進行濃度測定,換算成拷貝濃度,將4種質粒DNA按10倍倍比稀釋。分別進行4種靶基因的PCR擴增,對比不同靶基因PCR檢測方法的敏感性。
1.9 18S rRNA基因PCR擴增引物篩選 經鑒定18S rRNA基因為呂氏泰勒蟲PCR檢測最佳靶基因,對18S rRNA基因PCR擴增最佳引物的特異性和敏感性進行檢測,篩選最佳引物。
1.10 臨床樣本檢測 應用不同靶基因的4對引物,對45份綿羊血液樣本進行PCR檢測,比較4種靶基因PCR檢測方法的檢出率。
2 結果
2.1 血液涂片鏡檢 羊血液涂片經吉姆薩染色鏡檢,可見紅細胞內有梨籽形、圓點形蟲體,初步鑒定為羊泰勒蟲(圖1)。
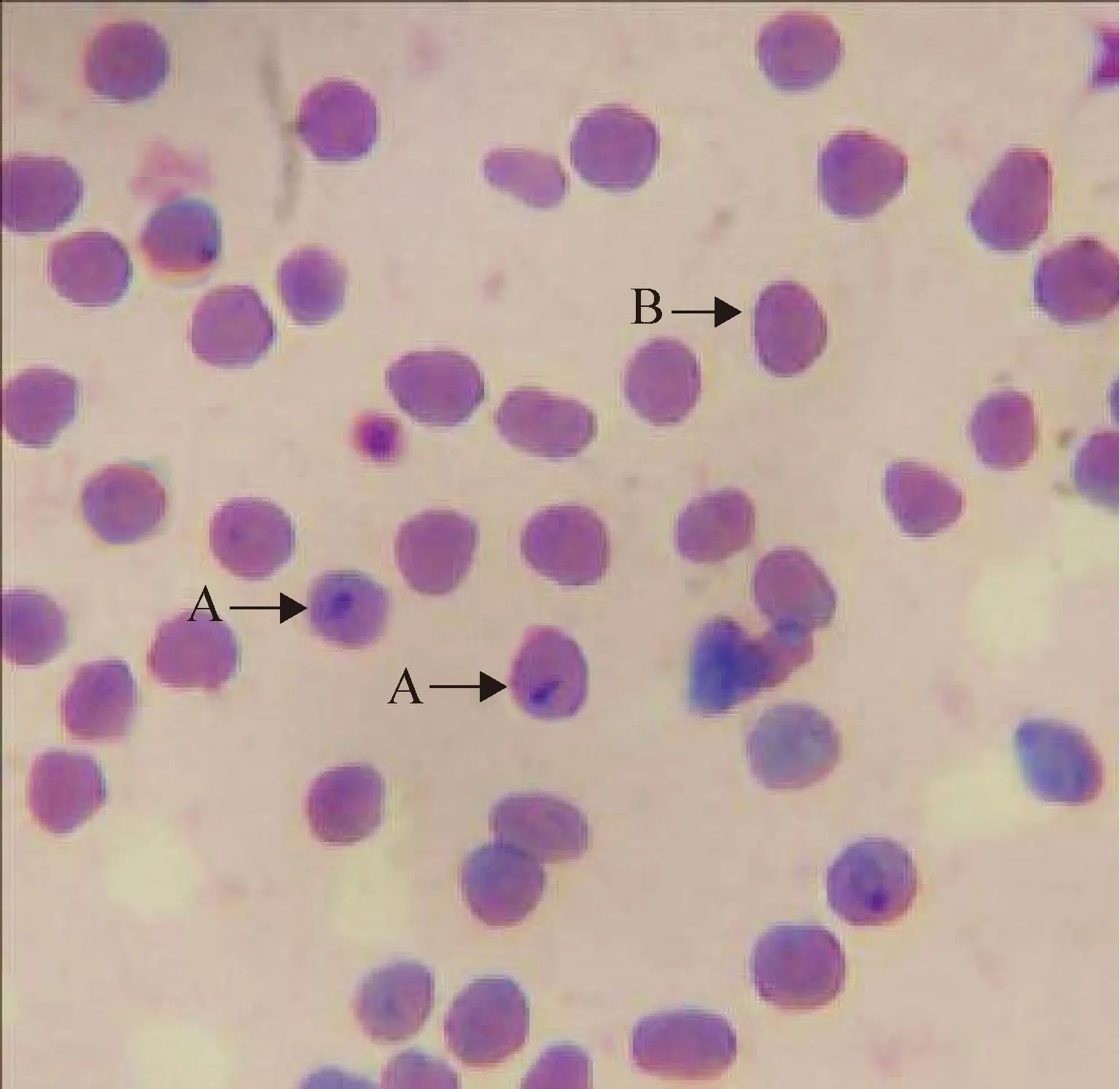
圖1 血液涂片吉姆薩染色鏡檢(1 000×)Fig.1 Giemsa staining microscopic examination of blood smears (1 000×)A:羊泰勒蟲; B:紅細胞A:Ovine Theileria; B:Red blood cell
2.2 血液DNA提取 提取的基因組DNA經瓊脂糖凝膠電泳檢測條帶較清晰,可用于下一步試驗(圖2)。
圖2 基因組DNA的瓊脂糖凝膠電泳檢測Fig.2 Agarose gel electrophoresis detection of genomic DNAM:DL2 000 DNA Marker; 1~4:血液樣本編號M:DL2 000 DNA Marker; 1-4:Blood sample numbers
2.3 特異性試驗 以4種寄生蟲陽性DNA為模板,分別用呂氏泰勒蟲4種靶基因的PCR引物進行PCR檢測。結果如圖3所示,4種靶基因引物均只可擴增出呂氏泰勒蟲DNA,擴增不出卵形巴貝斯蟲、中華泰勒蟲和附紅細胞體DNA,具有較好的特異性。
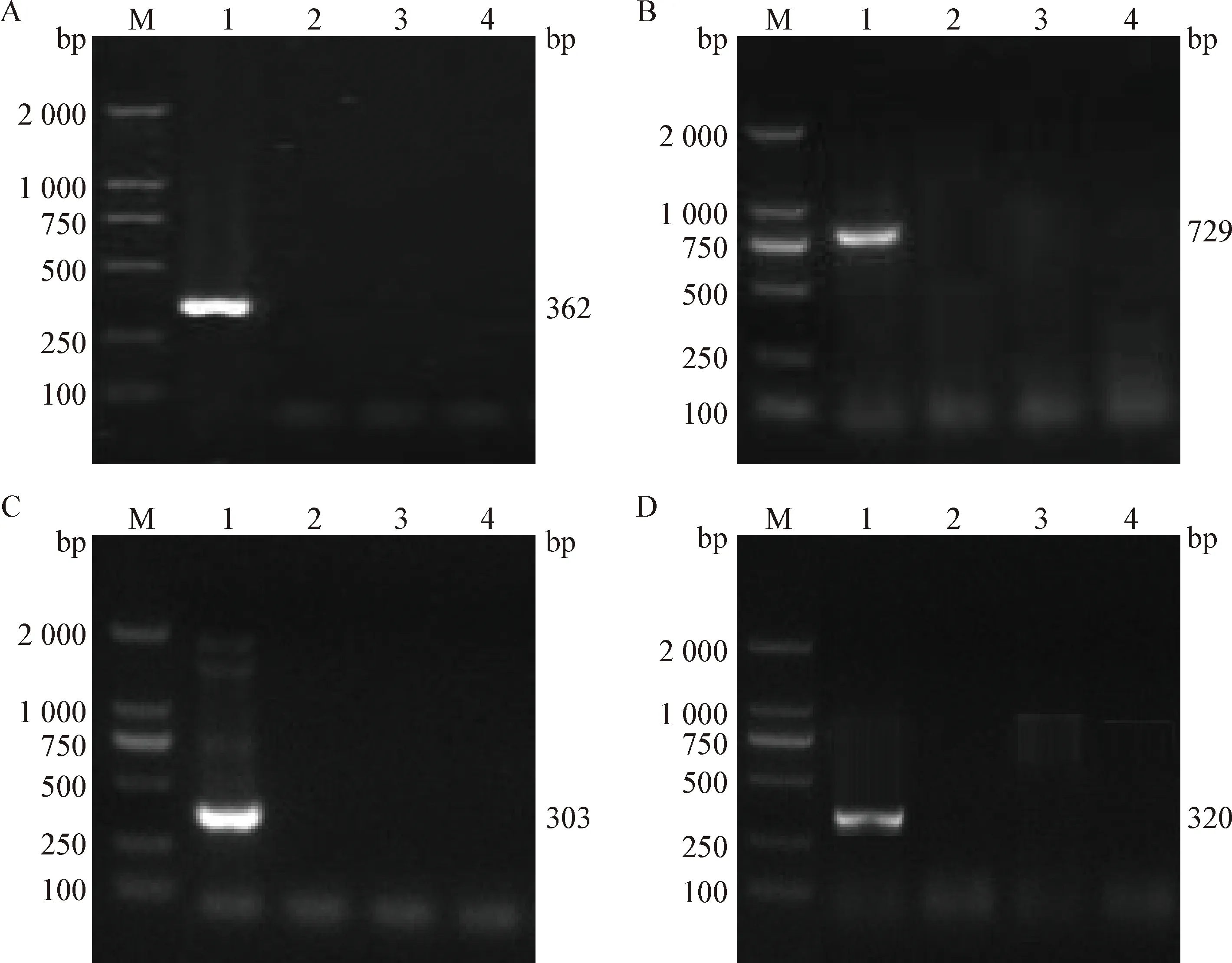
圖3 不同靶基因的4種PCR檢測方法的特異性試驗Fig.3 Specificity test of four PCR detection methods based on different target genesA:18S rRNA基因; B:MPSP基因; C:ITS基因; D:cox1基因(M:DL2 000 DNA Marker; 1:呂氏泰勒蟲; 2:附紅細胞體; 3:中華泰勒蟲; 4:卵形巴貝斯蟲)A:18S rRNA gene; B:MPSP gene; C:ITS gene; D:cox1 gene(M:DL2 000 DNA Marker; 1:Theileria luwenshuin; 2:Mycoplasma suis; 3:Theileria sinensis; 4:Babesia ovata)
2.4 敏感性試驗 以18S rRNA、MPSP、ITS和cox1為靶基因的重組質粒DNA濃度分別為41.17、14.74、1.36和0.69 ng/μL。調整重組質粒DNA濃度并10倍倍比稀釋,使4種靶基因重組質粒濃度均為9.82×102~9.82×109copies/μL。以相同拷貝數的不同靶基因的質粒DNA為模板,分別進行PCR檢測,結果如圖4所示,以cox1為靶基因最低檢測量為9.82×105copies/μL,敏感性最低;以18S rRNA為靶基因最低檢測量為9.82×103copies/μL,敏感性最高。

圖4 不同靶基因的4種PCR檢測方法的敏感性試驗Fig.4 Sensibility test of four PCR detection methods based on different target genesA:18S rRNA基因; B:MPSP基因; C:ITS基因; D:cox1基因(M:DL2 000 DNA Marker; 1~8:分別為9.82×109~9.82×102 copies/μL)A:18S rRNA gene; B:MPSP gene; C:ITS gene; D:cox1 gene(M:DL2 000 DNA Marker; 1-8:9.82×109-9.82×102 copies/μL,respectively)
2.5 18S rRNA基因PCR擴增引物篩選 以呂氏泰勒蟲陽性DNA為模板,將相同濃度的DNA分別用已設計的5對引物進行PCR檢測,結果如圖5所示,以引物P3和P1特異性好,無雜帶,擴增效果較好;引物P1、P2和P4出現雜帶,PCR擴增效果不理想。
2.6 18S rRNA基因PCR擴增的特異性試驗 分別以呂氏泰勒蟲、中華泰勒蟲、附紅細胞體和卵形巴貝斯蟲DNA為模板,用引物P3和P1進行PCR檢測,結果如圖6所示,引物P3和P1均只可擴增出呂氏泰勒蟲DNA,擴增不出卵形巴貝斯蟲、中華泰勒蟲和附紅細胞體DNA,具有較好的特異性。
2.7 18S rRNA基因PCR擴增的敏感性試驗 以呂氏泰勒蟲重組質粒DNA為模板,經10倍倍比稀釋重組質粒濃度為9.82×10~9.82×109copies/μL。用引物P1和P3進行PCR擴增,結果如圖7所示,引物P3最低檢測含量為9.82×102copies/μL;引物P1最低檢測含量為9.82×103copies/μL,引物P3敏感性是引物P1的10倍。
2.8 臨床樣本檢測 臨床樣本檢測結果如表2所示,以18S rRNA為靶基因,引物P3的PCR檢測方法的陽性率最高,陽性率為33.33%(15/45);以cox1為靶基因的PCR檢測方法的陽性率最低,陽性率為22.22%(10/45);以MPSP和ITS為靶基因的PCR檢測方法的陽性率均為26.67%(12/45)。
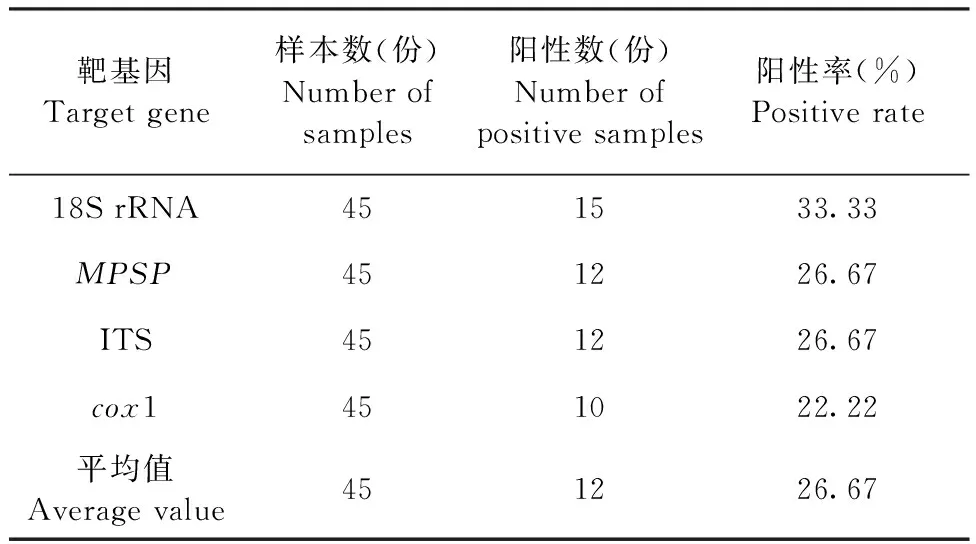
表2 臨床樣本的PCR檢測結果Table 2 PCR detection results of clinical samples
3 討論
在目前已建立的呂氏泰勒蟲檢測方法中,PCR方法具有敏感性高、特異性強等優點,可對呂氏泰勒蟲病進行早期診斷,更適合臨床檢測。研究發現,PCR方法選擇的靶基因不同,其敏感性和特異性存在較大差異[10-12]。本試驗對以18S rRNA、MPSP、ITS和cox1為靶基因的4種呂氏泰勒蟲PCR檢測方法進行了特異性、敏感性和臨床樣本檢測對比,結果顯示,以18S rRNA為靶基因的PCR方法敏感性最高,比以MPSP為靶基因的PCR方法敏感10倍,比以cox1和ITS為靶基因的PCR方法敏感100倍。分析原因可能是18S rRNA為線粒體DNA,在生物體內含量高于其他基因含量。MPSP是梨形蟲表面膜蛋白,是泰勒蟲感染紅細胞階段蟲體分泌的一種膜內蛋白,在其他階段該蛋白含量較低,因此,其基因檢測的敏感性低于18S rRNA,與金超等研究結果相類似[13]。本試驗臨床樣本檢測結果顯示,以18S rRNA為靶基因的PCR檢測方法對臨床樣本的陽性檢測率最高,可能與該基因具有較高的保守性有關。本試驗在篩選檢測呂氏泰勒蟲PCR方法最佳靶基因的基礎上,對最佳靶基因18S rRNA的檢測引物進行了篩選,在設計引物時根據18S rRNA基因特點,通過與其他蟲體序列進行比對,上、下引物序列選擇在可變區,使其具有較高特異性。18S rRNA基因引物篩選結果顯示,引物P3在特異性和敏感性方面優于其他引物,是檢測呂氏泰勒蟲的最佳引物。
羊呂氏泰勒蟲病在我國新疆維吾爾自治區、甘肅省、吉林省等19個省(直轄市)均有報道,感染率介于4.1%~80.0%[14-17]。隨著養羊業的迅速發展,不同品種羊和羊肉產品的交流日趨頻繁,羊泰勒蟲病的流行區域正日益擴大,已成為嚴重威脅養羊業健康發展的重要疾病之一,應引起動物檢疫部門重視,采取措施控制疾病的流行[18,19]。本試驗對現有的羊呂氏泰勒蟲靶基因序列,應用PCR方法進行了對比分析,篩選出18S rRNA基因為最佳靶基因,在此基礎上對18S rRNA基因PCR檢測引物進行篩選優化,為羊呂氏泰勒蟲病的臨床診斷提供了特異、敏感的PCR檢測方法。

