腎透明細胞癌炎癥相關基因預后風險評分模型的建立及驗證
程輝 章俞昕 陳濱海 陳衛建*
腎癌是泌尿系統最常見的惡性腫瘤之一,以腎細胞癌為主,其中約70%為腎透明細胞癌(ccRCC),其預后差異較大,早期ccRCC 的預后較好,但相當一部分患者在初診時已經發生了轉移,其5 年生存率僅12%左右,故ccRCC 患者病死率仍然居高不下[1]。目前進展期ccRCC 的治療以靶向治療和免疫治療單用或聯合為主,為晚期不可切除及轉移性ccRCC 提供更多選擇,但耐藥的出現等局限性嚴重影響ccRCC 預后[2]。新靶點、新信號通路和相關生物標志物的挖掘可能對ccRCC耐藥和免疫逃逸機制進行解釋,也為治療和預測預后帶來更精準和多樣的選擇。炎癥是繼發于各種原因導致的組織損傷后的機體防御措施,是一種公認的腫瘤危險因素[3]。在腫瘤發生發展過程中,炎癥參與包括細胞轉化、增殖、侵襲、血管生成和轉移等各個途徑,并有破壞免疫反應、干預組織修復、參與表觀遺傳學的變化及影響藥物療效等作用[4]。本研究篩選ccRCC 的炎癥相關基因,并構建具有獨立預后價值的預后模型風險評分,并進行驗證。
1 資料與方法
1.1 數據收集 從TCGA 數據庫下載ccRCC 的轉錄數據及臨床資料,共下載611 個樣本,其中包含539 個腎透明細胞癌組織和72 個正常組織。采用Active Perl(版本5.26,64-bit)對基因表達數據和臨床資料進行提取和整理。
1.2 數據分析 (1)炎癥相關基因差異表達分析:使用R 軟件包limma、ggplot2、pheatmap 對腫瘤組與正常組數據進行DEGs 的表達分析和可視化處理。(2)建立預后風險模型:通過R 軟件包“survival”對炎癥相關的DEGs 進行單因素COX 回歸分析。通過多因素COX回歸分析建立預后風險模型并構建風險評分公式,然后根據中位數將患者分為高風險組和低風險組,采用R 軟件包“regplot”繪制列線圖對預后模型進行可視化。(3)預后模型評價:采用 Kaplan-Meier 生存曲線分析高風險組及低風險組的生存差異。在單因素和多因素COX回歸模型中納入風險評分及臨床病理因素,如TNM 分期、組織分級、病理分期、年齡(≤65 歲,>65 歲)和性別,以分析影響ccRCC 患者生存的因素,并采用ROC 曲線評估預后風險模型的準確性。(4)預后模型驗證:采用SPSS 軟件將ccRCC 樣本隨機分為訓練集與測試集,根據風險評分分為高風險組與低風險組,采用Kaplan-Meier 生存曲線、ROC 曲線對預后風險模型進行驗證。(5)功能分析:通過GSEA 軟件進行GO 富集分析、KEGG 集分析,以此來比較預后風險模型所分類的亞組間基因功能和途徑的差異。(6)免疫分析:基于R軟件包“GSVA”對亞組間的免疫細胞功能差異進行分析。基于Cibersort 算法對亞組間的免疫檢查點進行差異分析。使用ESTIMATE 算法估計腫瘤組織中的基質和免疫細胞計算基質評分、免疫評分和腫瘤純度。
2 結果
2.1 ccRCC 組織與正常組織間炎癥相關DEGs 的鑒定 從TCGA 數據庫中提取611 個樣本數據,包括539個ccRCC 組織和72 個正常組織,比較其中188 種與炎癥相關的基因表達水平,并由此鑒定出包括ABCA-1,ADM 在內的113 種DEGs(P<0.05),其中表達上調的DEGs 有96 個,下調的有17 個。見圖1。
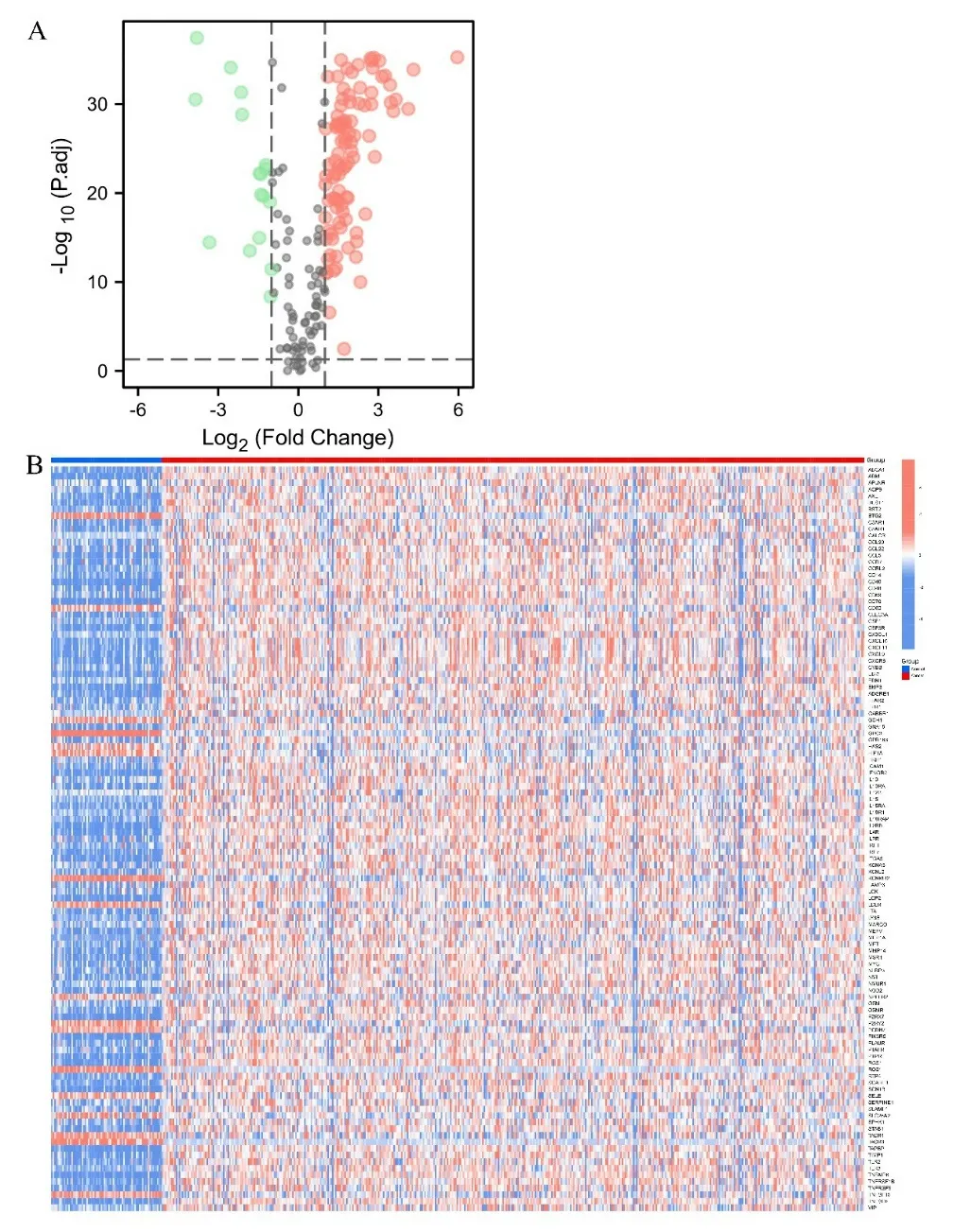
圖1 A. 火山圖(紅色為上調基因,綠色為下調基因);B. 正常組織(N,藍色)和腫瘤組織(T,紅色)間的炎癥相關DEGs分布熱圖
2.2 炎癥相關DEGs 預后風險評分模型的建立 共得到526 個ccRCC 樣本。單因素COX 回歸分析顯示113個炎癥相關DEGs 與ccRCC 預后存在相關性(P<0.01),從而初步篩選出與該腫瘤生存相關的炎癥基因。見圖2A,共獲得39 個與ccRCC 預后相關的炎癥基因,其中APLNR、BTG2、CALCRL、CX3CL1、EDN1、TACR1、TLR3 這7 個基因與ccRCC 較好的預后相關(HR<1),可能是保護性基因,而包括AQP9、AXL 在內的32 個基因則與ccRCC 較差的生存相關,可能是高風險基因。對這39 種炎癥基因進行多因素COX 比例風險回歸分析,見圖2B,10 種炎癥基因可能是ccRCC 的獨立預后因子,其中包括APLNR、BTG2、CX3CL1、SPHK1 在內的四個基因是ccRCC 良好預后的獨立預測因素,而CSF1、GABBR1、HAS2、ICAM1、P2RY2、TIMP1 等6個基因是ccRCC不良預后的獨立預測因素,并構建風險評分公式如下:(-0.0153×APLNR)+(-0.0073×BTG2)+0.0225×CSF1+(0.0107×CX3CL1)+0.1888×GABB R1+0.1528×HAS2+0.0088×ICAM1+0.3952×P2RY2+(-0.0442×SPHK1)+0.0006×TIMP1。對526 個ccRCC樣本按該公式打分,以中位數作為閾值,將樣本分為高低風險兩組,每組263 個樣本。對高低風險組進行Kaplan-Meier 生存分析,結果顯示高風險組生存率低于低風險組(P<0.001),見圖2C。根據計算的風險評分,將樣本分為高、低危組,與低危組相比,隨著風險評分的升高,高危組患者死亡人數更多,生存時間更短,見圖2D。基于納入樣本生存狀態的散點圖見圖2E。不同臨床特征及炎癥基因在不同亞組間的表達以熱圖形式見圖2F,其中APLNR、BTG2、CX3CL1 在低風險評分組中富集表達,CSF1 等7 個基因則傾向于在高風險組中高表達。且更高的風險評分對應更晚的TNM 分期和組織學分級。同時,為了提高預后風險評分模型結果的可視化效果,構建一個臨床病理因素與風險評分的列線圖,見圖2G,結果顯示,高風險組對應更高的評分,意味著更短的生存時間及更差的預后。
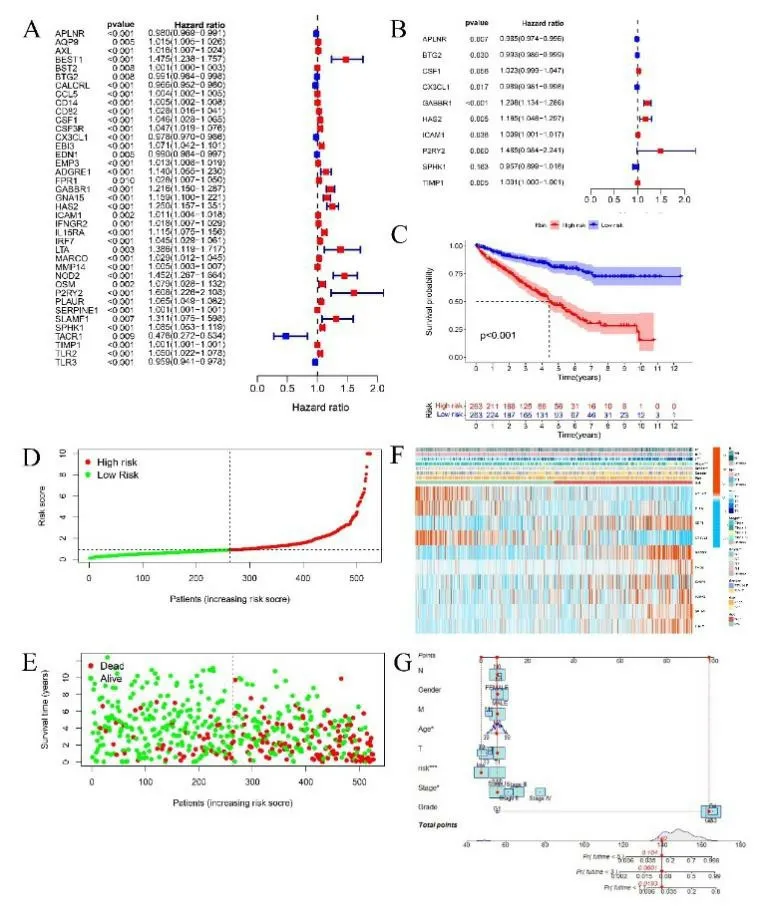
圖2 A. 炎癥相關DEGs與ccRCC 預后的單因素COX回歸分析;B. 炎癥相關DEGs與ccRCC預后的多因素COX回歸分析;C. 高風險和低風險組患者總生存的Kaplan-Meier曲線;D.基于納入樣本的風險評分的風險曲線;E. 基于納入樣本生存狀態的散點圖(綠點和紅點分別表示生存和死亡);F. 高風險和低風險組臨床特征和炎癥相關DEGs的熱圖(藍色代表低風險組,紅色代表低風險組,而紅色代表高表達,綠色代表低表達);G. 基于臨床病理因素和風險評分的列線圖
2.3 預后風險評分模型的獨立預后價值 單因素COX回歸分析顯示,年齡、分級、階段、TNM 分期、風險評分(P<0.001,HR=1.157)均與ccRCC 的預后相關,見圖3A。多因素回歸分析顯示風險評分是ccRCC 預后不良的獨立預后因素(P<0.01,HR=1.100),見圖3B。ROC 曲線評估預后風險評分模型的預測價值。曲線下面積(AUC)為0.770,具有良好的預測價值。為評估預后風險評分模型的預測精度,分別在第1、3、5 年進行ROC 分析,其AUC 分別為0.770,0.742,0.757,見圖3C。多指標ROC 曲線分析各臨床因素對ccRCC 5 年生存預測價值,其中該預后風險評分模型ROC 曲線的AUC 值最高,為0.757,提示該預后風險評分模型預測預后能力良好,見圖3D。
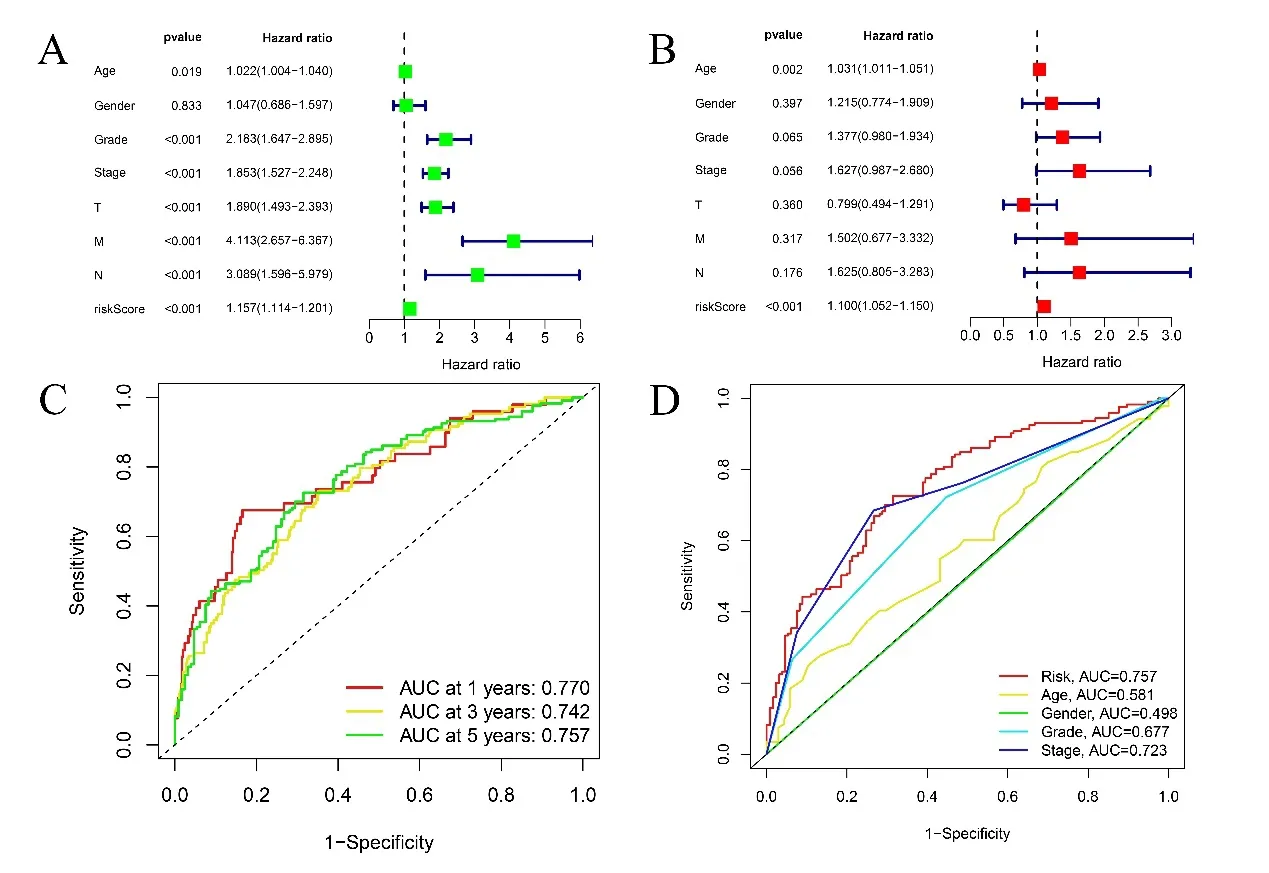
圖3 A. 臨床因素(包括預后風險評分模型)與ccRCC總生存之間的單變量COX回歸分析;B. 臨床因素(包括預后風險評分模型)與ccRCC總生存之間的多變量COX回歸分析;C. 基于預后風險評分模型的第1、3、5年總生存的ROC曲線分析;D. 多指標ROC曲線分析
2.4 預后風險評分模型的驗證 將526 名ccRCC 樣本隨機分為訓練集與測試集。根據風險評分公式計算訓練集和測試集中ccRCC 患者的風險評分,按照中位風險評分值將訓練集和測試集的患者分為高風險或低風險組(見圖4A、B),并對訓練集和測試集樣本的生存狀態分別進行了分析(見圖4C、D),訓練集和測試集生存狀態分布基本與整體一致,即低風險組相對高風險組在一段時間的隨訪后展現出更優的生存率和更長的生存時間。KM 生存曲線分析顯示,訓練集與測試集中兩個風險組間的總生存率差異有統計學意義(P<0.001)(見圖4E、F),高風險組生存率低于低風險組。1 年、3年和5 年生存的AUC 在訓練集中分別為0.763、0.705、0.730,在測試集中分別為0.780、0.784、0.781(見圖4G、H)。
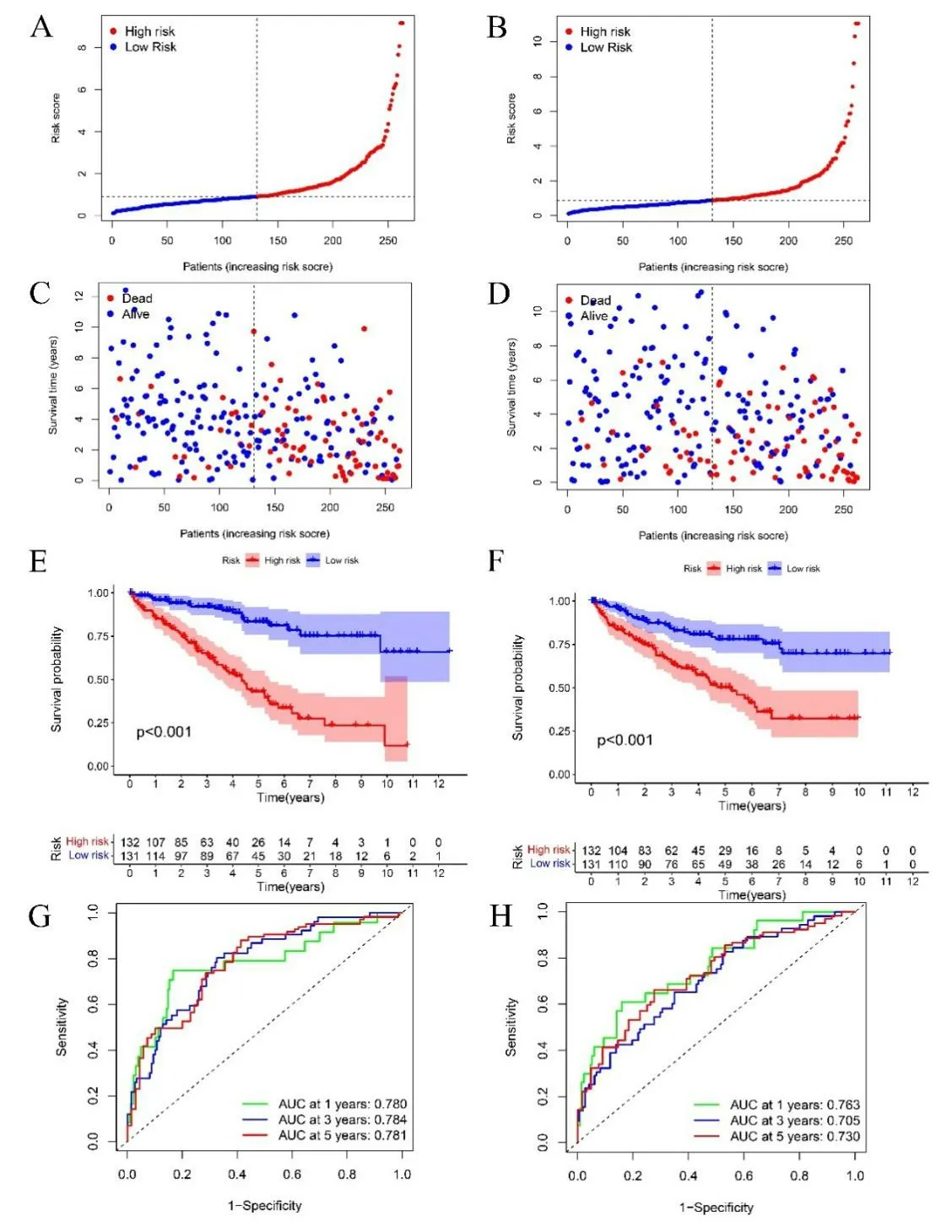
圖4 A. 基于訓練集風險評分的風險曲線;B. 基于測試集風險評分的風險曲線;C. 訓練集的生存狀態分布圖;D. 訓練集的生存狀態分布圖;E. 訓練集總生存的 KM生存曲線;F. 測試集總生存的 KM生存曲線;G. 訓練集總生存的時間相關ROC曲線;H. 測試集總生存的時間相關ROC曲線
2.5 基于預后風險評分模型的Gsea GO 分析結果分為生物過程(BP),細胞組分(CC),生物功能(MF)三個方面,GO 分析顯示(見圖5A),在高危組中,纖毛運動,微管束形成,細胞因子活性,纖毛或鞭毛依賴性細胞運動,減數分裂I 細胞周期過程富集,對比之下,細胞頂端脂質氧化,頂端質膜,微體,腎系統過程等在低風險組樣本中富集。鑒定KEGG 通路(見圖5B),發現同源重組,α 亞麻酸代謝,甘油磷脂代謝在高風險組富集,而加壓素調節水重吸收、過氧化物酶體、近端小管再吸收、纈氨酸亮氨酸和異亮氨酸降解、脂肪酸代謝等通路則被發現在低風險組富集。
2.6 高風險組與低風險組在ccRCC 微環境及腫瘤異質性的差異,高危組和低危組在APC 共刺激、內生肌酐清除率、檢查點、溶細胞活性、人類白細胞抗原、炎癥促進、副炎癥、T 細胞功能包括共抑、共刺激以及II型干擾素反應有顯著差異,除II 型干擾素反應外,高風險組其余9 種免疫通路活性均高于低分險組(見圖6A)。基于TIMER、CIBERSORT、QUANTISEQ、MCP counter、XCELL、EPIC 繪制免疫應答熱圖(見圖6B)。免疫檢查點是免疫細胞表達的分子標志物,是腫瘤微環境的一部分,鑒于當前ccRCC 治療中免疫檢查點抑制劑的重要性,進一步分析兩組免疫檢查點表達的差異(見圖6C),結果顯示高低風險組在36 個免疫檢查點的表達差異均有統計學意義,除HHLA2、KIR3DL1、TNFSF18、NRP1 表達在低風險組中較高外,其余包括PD-1、CTLA-4、LAG3、BTLA、TIGIT 在內的32 個免疫檢查點在高風險組表達量均高于低風險組。ccRCC 腫瘤微環境的差異在宏觀上構成腫瘤的異質性。為進一步判斷腫瘤樣本的異質性,判斷腫瘤微環境中非腫瘤細胞的浸潤差異,利用ESTIMATE 工具評價了高風險與低風險組樣本中的腫瘤純度。ImmuneScore 顯示,ccRCC 中高風險組的免疫細胞含量高于低風險組(P<0.001)(見圖6D),而StromalScore 則顯示兩組間的基質細胞沒有差異(見圖6E)。ESTIMATE score 顯示綜合得分高風險組高于低風險組(見圖6F)。通過ESTIMATE score 計算腫瘤純度,結果顯示高風險組腫瘤純度較低風險組低,異質性更大(見圖6G)。


圖6 A. 低風險組和高風險組在13種免疫途徑中的富集;B. 低風險和高風險組的免疫應答熱圖;C. 36個免疫檢查點在低風險和高風險人群中的基因表達;D.低風險和高風險組的免疫評分;E. 低風險和高風險組的基質評分;F. 低風險和高風險組的ESTIMATE評分;G. 低風險和高風險組的腫瘤純度
3 討論
ccRCC 是腎細胞癌中最常見的亞型,進展期治療方法主要為靶向治療和免疫治療,其部分改善患者生存,但后線治療選擇缺乏加上療效欠佳,其死亡率仍居高不下[5-6]。目前分子生物學和癌癥基因組學的發展為晚期ccRCC 治療帶來希望,但仍缺乏良好的預后模型,以預測ccRCC 的預后并為有潛力的相關治療靶點的篩選帶來啟示[7]。ccRCC 作為一種異質性較高的瘤種,與單一生物標志物相比,將多個相關基因標志物納入同一預后模型,可以提高對預后預測的準確性[8]。炎癥被發現在癌癥的發生發展中起重要作用,有研究顯示癌細胞及間質細胞與炎性細胞相反應,形成炎性腫瘤微環境(TME),因其強大的可塑性,能夠動態干預腫瘤的發生發展及轉移等途徑,其成員基因在ccRCC 中的生物標志物作用也在逐漸被揭示[9-10]。
本研究中,應用TCGA 數據庫篩選出10 個ccRCC的獨立預后炎癥相關基因,目前有研究揭示其中部分基因與ccRCC 預后相關,APLNR 在高級別、高分期和轉移性ccRCC 腫瘤中表達降低,與腫瘤的侵襲性呈負相關[11];BTG2 與ccRCC 負相關,過表達BTG 2 可抑制人ccRCC 的增殖、遷移和侵襲[12];而CSF1 的高表達會導致腎切除術后ccRCC 患者復發和預后不良等[13]。構建預后模型風險評分公式,并對該模型中的高低風險人群進行分層分析,結果顯示低風險組生存時間更長,證實了該預后風險評分模型對ccRCC 的預后有獨立且較穩定的預測價值,在遠期預后的預測方面優于其他臨床特征,并對其進行內部驗證。
基于該預后風險評分模型,進行基因富集分析,結果發現在GO 分析中高風險組主要富集于細胞器的形成和細胞周期中,當前研究揭示部分環節和腫瘤發生的關系,如纖毛由微管核心軸突構成作為一種孤立細胞器能夠導致腫瘤的進展及耐藥的出現[14];部分細胞因子如IL-30 能促進癌癥發生[15],低氧誘導因子-1(HIF-1)能通過調節靶基因參與腫瘤生長,免疫逃逸、代謝和耐藥[16]。高危組進行KEGG 分析顯示其在同源重組、α-亞麻酸代謝、甘油磷脂代謝等通路聚集,以往研究認為同源重組缺陷(HRD)會導致包括ccRCC 在內多種腫瘤的發生[17-18],基于此機制研制的PARP 抑制劑展現出強大的泛抗癌作用,陸續在多個瘤種中獲批[19]。故炎癥相關基因可能通過對細胞因子的表達和細胞周期的轉變等,參與DNA 的損傷及修復障礙和代謝變化,最終導致ccRCC 的發生。
本研究結果提示高風險組PD-1、CTLA-4、LAG3等熱點免疫檢查點表達量均高于低風險組,提示高風險組可能在應用相關免疫檢查點抑制劑時有更好的療效,這也部分解釋了目前最新指南僅將靶免聯合或免疫聯合治療作為轉移性或不可切除的中高風險ccRCC 一線治療1A 類推薦,而低風險人群的一級推薦仍是靶向治療的原因[20]。同時,高風險組ccRCC 免疫細胞含量更高,腫瘤純度更低,異質性高,ARAN 等[21]研究提示隨著ccRCC 的進展,包括更晚的分期和更高的組織學分級,其腫瘤純度降低,同時對應較差的預后,這與本研究結果一致。
綜上,本研究基于TCGA 數據庫,建立一個ccRCC炎癥基因相關的預后風險評分模型,其對ccRCC 有獨立預后價值,并探討其在包括基因及通路富集、免疫細胞功能、免疫檢查點和腫瘤微環境中的價值,為進一步挖掘相關治療靶點和揭示炎癥基因在ccRCC 及泛癌領域的作用提供了基礎。

