糖尿病與視網膜亞層厚度的相關分析
應黃芳,胡衛萍,倪利洋,屠叔丹,張子龍,陶永鋼,徐永根
糖尿病與視網膜亞層厚度的相關分析
應黃芳,胡衛萍,倪利洋,屠叔丹,張子龍,陶永鋼,徐永根
紹興文理學院附屬醫院眼科,浙江紹興 312000
探討糖尿病對視網膜亞層厚度的影響。本研究為回顧性研究。收集2021年1月至12月在紹興文理學院附屬醫院就診的2 型糖尿病患者54例,分為非增殖期糖尿病性視網膜病變(non-proliferative diabetic retinopathy,NPDR)組(=27)和糖尿病無糖尿病性視網膜病變(no diabetic retinopathy,NDR)組(=27)。選取同期年齡、性別相匹配的無糖尿病者作為空白對照(Control)組(=34)。使用SD-OCT掃描并測量黃斑中心凹、鼻側和顳側三位點視網膜各亞層厚度。分析三組間視網膜亞層厚度差異及各因素相關性。NPDR組和NDR組的黃斑中心凹處外層視網膜厚度均較Control組偏薄(NPDR. Control,=0.001;NDR. Control,=0.038)。NPDR組顳側內核層厚度較NDR組和Control組均偏厚(NPDR. Control,=0.025;NPDR. NDR,=0.009)。內層視網膜和外層視網膜厚度比值方面,NPDR組和NDR組在黃斑中心凹均較Control組偏大(NPDR. Control,=0.022;NDR. Control,=0.040),NPDR組在顳側較NDR組和Control組均偏大(NPDR. NDR,=0.007;NPDR. Control,=0.020)。Logistic回歸分析結果顯示,糖尿病性視網膜病變是顳側內核層厚度變化的影響因素(=0.019)。糖尿病可引起視網膜亞層厚度的改變。糖尿病性視網膜病變與視網膜內層厚度相關,是顳側內核層厚度增加的影響因素。
光學相干斷層掃描;糖尿病;糖尿病性視網膜病變;視網膜亞層
糖尿病性視網膜病變(diabetic retinopathy,DR)是糖尿病最常見的并發癥,也是成年人可預防性盲的主要原因之一,預計到2045年全球將有1.6億成年人患DR[1]。目前,臨床上對于DR的主要診斷依據為是否出現視網膜微血管病變。然而,最近研究發現,在疾病早期,視網膜神經退行性變化可能先于視網膜微血管改變[2-5]。如何對DR進行早發現早治療為最新的研究熱點。光學相干斷層掃描(optical coherence tomography,OCT)具有快速、非接觸、高分辨等優勢,已作為常用的視網膜檢查手段,往往能夠發現視網膜細微結構的異常[6]。國內外對于糖尿病患者早期外層視網膜結構變化的相關研究較少,本研究旨在通過糖尿病患者和空白對照組視網膜各亞層厚度進行比較分析,并對年齡、性別、糖尿病、胰島素用藥等因素進行回歸分析,探討糖尿病性視網膜病變視網膜亞層厚度變化規律及與各影響因素的相關性。
1 資料與方法
1.1 一般資料
收集2021年1月至12月在紹興文理學院附屬醫院就診的2型糖尿病患者54例(54眼),根據歐堡眼底照相及OCT結果分為非增殖期糖尿病性視網膜病變(non-proliferative diabetic retinopathy,NPDR)組27例(27眼)和糖尿病無糖尿病性視網膜病變(no diabetic retinopathy,NDR)組27例(27眼)。選取同期年齡、性別相匹配的左眼單眼白內障住院者34例(34眼)作為無糖尿病空白對照(Control)組。均以右眼為研究對象。診斷標準:糖尿病診斷參考2017年版《中國2型糖尿病防治指南》[7],糖尿病性視網膜病變診斷分期參考2014版《我國糖尿病視網膜病變臨床診療指南》[8]。糖尿病組納入標準:①符合糖尿病診斷標準;②符合糖尿病NDR、NPDR診斷標準。糖尿病組排除標準:①屈光不正<-6.00D;②屈光介質明顯混濁;③有青光眼病史;④有葡萄膜炎、非糖尿病引起的視網膜、視神經疾病及臨床可見的黃斑水腫、增殖性DR、黃斑前膜等;⑤有眼部外傷史及眼底手術史;⑥有高脂血癥、腎病等。對照組納入標準:①正常中老年左眼單眼白內障;②右眼屈光介質無明顯混濁。對照組排除標準:①有糖尿病、高脂血癥、腎病、視網膜及視神經疾病史;②有青光眼史;③屈光不正<-6.00D。NPDR組27例(27眼,男/女=12/15),年齡(62.7±11.0)歲;NDR組27例(27眼,男/女=14/13),年齡(61.3±9.0)歲;Control組34例(34眼,男/女=16/18),年齡(61.2±7.4)歲。本研究經紹興文理學院附屬醫院倫理委員會審查同意[倫理審批號:2023(研)-068-01],所有患者均簽署知情同意書。
1.2 方法
所有患者均通過住院病案系統,收集患者性別、年齡、體質量指數(body mass index,BMI)等。糖尿病患者額外收集患者有無DR、住院期間最高血糖、糖化血紅蛋白、降糖藥種類、是否使用胰島素、糖尿病病程等。并根據以下方案進行分級。根據年齡,<51歲為中年,51~65歲為中老年,>65歲為老年。根據BMI,18.5~<24kg/m2為體質量正常,24~<28kg/m2為超重,≥28kg/m2為肥胖。根據住院期間最高血糖,<10mmol/L為1級,10~<20mmol/L為2級,≥20mmol/L為3級。根據糖化血紅蛋白,<7.0%為控制好,7.0~<9.0%為控制一般,>9.0%為控制差。根據糖尿病病程,≤5年為病程短,6~15年為病程中,>15年為病程長。
采用德國海德堡OCT掃描儀(型號 Spectralis OCT)于黃斑中心凹行水平掃描。選取經過黃斑中心凹正中的水平斷層OCT圖像,用OCT儀器自帶分析程序將視網膜分為內層視網膜6個亞層,分別為視網膜神經纖維層(nerve fiber layer,NFL)、神經節細胞層(ganglion cell layer,GCL)、內叢狀層(inner plexiform layer,IPL)、內核層(inner nuclear layer,INL)、外叢狀層(outer plexiform layer,OPL)、外核層(outer nuclear layer,ONL)和外層視網膜(outer retinal layer,ORL),并測量黃斑中心凹(central,C)、中心凹鼻側1mm(nasal,N)和中心凹顳側1mm(temporal,T)3位點視網膜各亞層厚度。
1.3 統計學方法
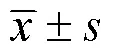
2 結果
2.1 三組患者一般資料比較
三組間的BMI比較差異有統計學意義(=9.50,<0.001)。年齡、性別比較,差異均無統計學意義(>0.05)。NPDR和NDR兩組間住院期間最高血糖、糖化血紅蛋白、降糖藥種類、是否使用胰島素、糖尿病病程等比較,差異均無統計學意義(>0.05),見表1。
2.2 視網膜各亞層厚度比較
三組的黃斑中心凹處ORL層厚度比較,差異有統計學意義(=6.566,=0.002),NPDR組(92.9±10.0μm)和NDR組(95.8±5.5μm)均較Control組(99.9±6.8μm)偏薄(NPDRControl,= 0.001;NDRControl,=0.038)。顳側INL層厚度三組間差異有統計學意義(=4.088,=0.020),NPDR組(39.7±8.7μm)較NDR組(34.1±8.4μm)和Control組(35.2±6.0μm)均偏厚(NPDR. Control,= 0.025;NPDR. NDR,=0.009)。其余位點各視網膜亞層厚度,三組間比較差異均無統計學意義,見圖1。
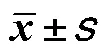
表1 三組患者一般資料比較()
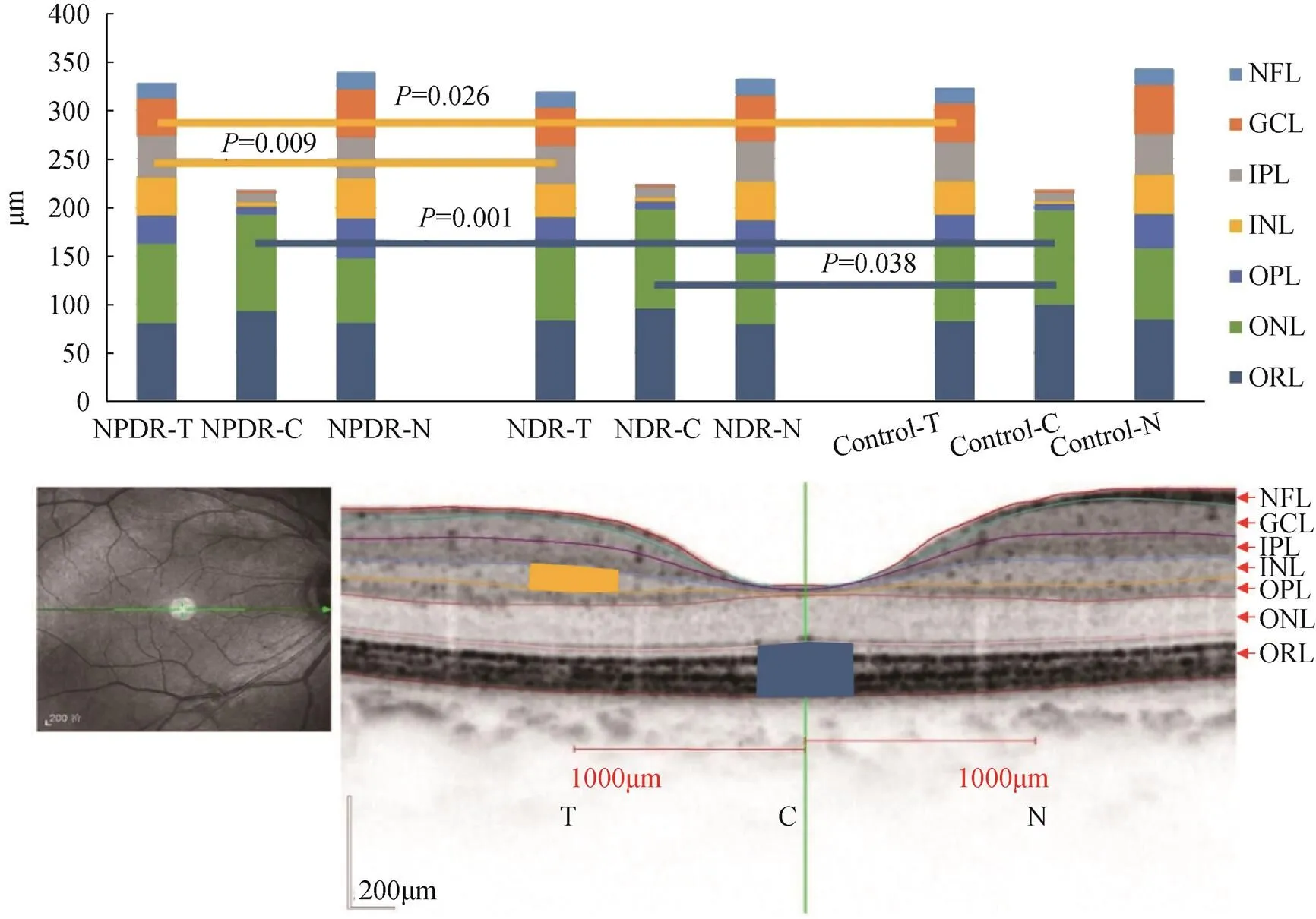
圖1 各位點視網膜各亞層厚度比較
注:T為黃斑顳側,C為黃斑中央,N為黃斑鼻側。黃色線段表示INL層厚度組間的比較,黃色區域表示INL厚度有差異的位點。藍色線段表示ORL層厚度組間的比較,藍色區域表示ORL厚度有差異的位點。
內層視網膜和外層視網膜厚度比值,黃斑中心凹處三組間差異有統計學意義(=3.431,=0.037),NPDR組(1.37±0.26)和NDR組(1.35±0.33)均較Control組(1.20±0.24)偏大(NPDRControl,=0.022;NDR vs Control,=0.040)。顳側三組間差異有統計學意義(=4.428,=0.015),NPDR組(3.08±0.35)較NDR組(2.87±0.26)和Control組(2.91±0.21)均偏大(NPDRNDR,=0.007;NPDRControl,=0.020),見表2。
2.3 各因素對視網膜亞層厚度的影響
多元logistic回歸分析各因素對顳側INL層厚度影響。DR與否對顳側INL層厚度有影響(=0.019)。性別、年齡、BMI、患者住院期間最高血糖、糖化血紅蛋白、降糖藥種類、是否使用胰島素、糖尿病病程等對顳側INL層厚度均沒有影響,見表3。
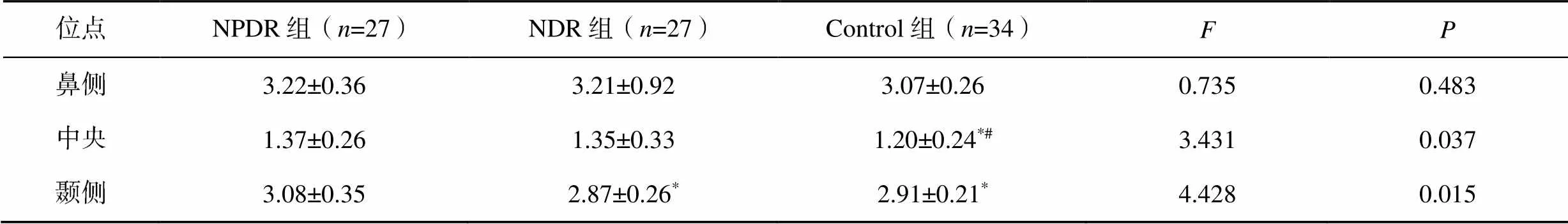
表2 各位點內層視網膜厚度與外層視網膜厚度比值比較
注:與NPDR組比較,*<0.05;與NDR組比較,#<0.05
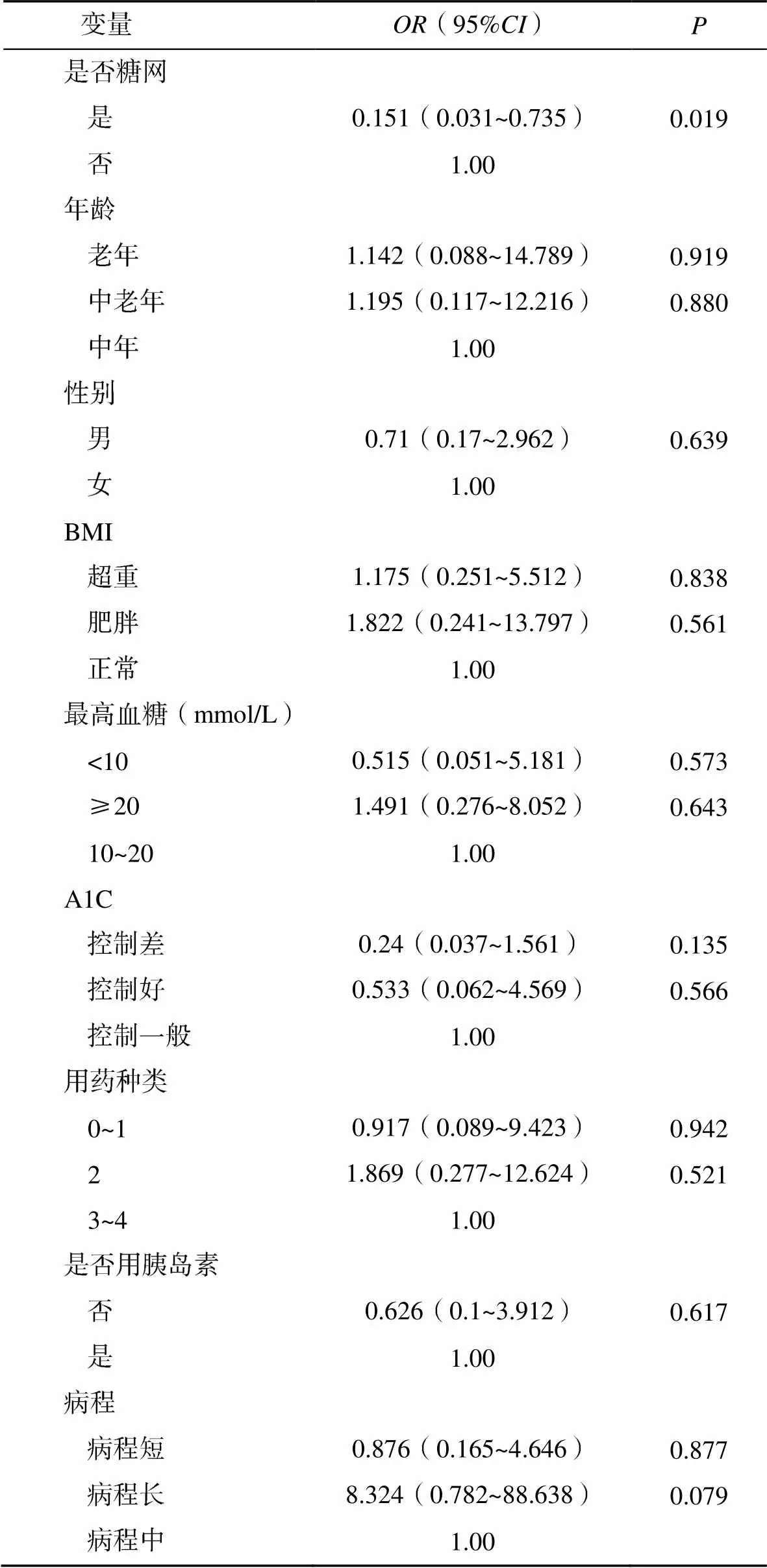
表3 黃斑顳側內核層厚度相關因素的多元Logistic回歸分析
注:上表為黃斑顳側內核層厚度小于平均值組結果,參照組為黃斑顳側內核層厚度≥平均值組;所有患者黃斑顳側內核層平均值為36.9μm
3 討論
糖尿病可引起視網膜微血管的改變,早發現早治療對疾病控制有積極意義。OCT是目前常用的視網膜檢查手段,能在發生視網膜微血管瘤前發現視網膜亞層的厚度異常。
本研究發現糖尿病者(NPDR組及NDR組)較非糖尿病者(Control組)黃斑中心凹處ORL厚度偏薄,導致其黃斑中心凹處內層視網膜厚度與外層視網膜厚度比值偏大。有DR者(NPDR組)較無DR者(Control組及NDR組)顳側INL厚度偏厚,同樣導致黃斑顳側內層視網膜厚度與外層視網膜厚度比值偏大。其余NFL、GCL、IPL、OPL、ONL 5個亞層均未見明顯異常。是否患有DR對顳側INL層厚度有影響。
ORL層為外層視網膜,從外界膜到視網膜色素上皮層外緣,由視錐視桿細胞的內外節和色素細胞構成。黃斑中心凹處主要為視錐細胞的內外節。提示糖尿病患者早期視錐細胞受損可能。McAnany等[9-10]報道糖尿病早期尚未有DR時就有錐細胞功能障礙,與本研究結果一致。INL層為內核層,由無長突細胞、Müller細胞、雙極細胞、水平細胞構成。視網膜中央動脈供應視網膜內層,到達INL層為深層毛細血管即終末毛細血管。推測血糖對視網膜微循環的影響最先累及INL層,INL因缺氧發生水腫,導致厚度增加。Huang等[11]報道認為視網膜顳側功能更容易受損,與本研究結果一致。有學者研究了糖尿病病程、是否有糖尿病性視網膜變性、年齡、性別、糖化血紅蛋白對視網膜厚度影響,發現僅是否有糖尿病性視網膜變性對內層視網膜厚度有影響[12],與本研究結果一致。
有學者通過OCT研究了糖尿病對視網膜厚度影響,結果與本研究不盡相同。吳宇霏等[13]發現糖尿病早期患者相比無糖尿病者黃斑中心區及顳側視網膜NFL變薄,而黃斑上下方區域NFL各組間未見差異。冀向寧等[14]、李海東等[15]發現糖尿病組較非糖尿病組視盤上下方的NFL變薄,鼻顳側未見差異。提示糖尿病患者NFL變薄在重度非增殖期及增殖期較明顯,以視盤上下方的NFL為主,糖尿病早期不明顯。單獨的NFL厚度測量并不能很好的提示由糖尿病引起的視網膜損害,而長期的對照隨訪可能更能說明糖尿病對NFL的損害。本研究測量的是黃斑中心凹及中心凹附近1mm鼻側和顳側視網膜NFL,未在差異較明顯的上下方,且本研究NPDR組均為輕中度患者。尹玉如等[16]研究發現重度非增殖期和增殖期較非糖尿病組GCL變薄,輕中度非增殖期尚無變化。張佳慧等[17]測量了NPDR或病情更重的患者黃斑GCL-IPL復合體的平均厚度及最小厚度,發現隨著糖尿病眼底病情加重最小厚度逐漸變薄。本研究3組間GCL厚度差異無統計學意義,考慮可能是本研究NPDR組均為輕中度患者,且血糖控制同NDR組相近,病情較輕有關。提示在DR早期,血糖控制好的情況下,視網膜GCL變化并不顯著,對早期DR臨床意義不大。Van等[12]發現輕度DR者較無糖尿病者黃斑旁中心及周邊IPL偏薄。差異可能源于測量位置不同。Van等[12]測量的是離黃斑中心0.5~1.5mm及1.5~3mm環形區域內的平均厚度,本研究單純測量水平方向上中心凹鼻側1mm和顳側1mm的視網膜亞層厚度。
本研究仍有不足之處,首先本研究為回顧性研究,未能獲取到上方及下方黃斑區視網膜亞層厚度信息,NFL在黃斑區偏薄,不能很好的顯示差異。其次,本研究發現內層視網膜厚度與外層視網膜厚度比值在糖尿病患者和DR患者均偏大,但觀察病例不多,需要更大樣本的觀察來確定其特異性及正常范圍。
綜上所述,糖尿病患者在未發生DR之前已有OCT可發現的差異。糖尿病對視網膜不同程度的損傷可引起視網膜亞層不一樣的改變。實際應用中,不能忽略黃斑區上下方及視盤區視網膜亞層厚度的測量。NFL連續隨訪較單次測量更有臨床意義。內層視網膜厚度與外層視網膜厚度比值可能是判定糖尿病對視網膜損害的有效指標。
[1] TEO Z L, THAM Y C, YU M, et al. Global prevalence of diabetic retinopathy and projection of burden through 2045: systematic review and meta-analysis[J]. Ophthalmology,2021, 128(11): 1580–1591.
[2] ZHANG B, CHOU Y, ZHAO X, et al. Early detection of microvascular impairments with optical coherence tomography angiography in diabetic patients without clinical retinopathy: a meta-analysis[J]. Am J Ophthalmol,2021, 222: 226–237.
[3] CHAI Q, YAO Y, GUO C, et al. Structural and functional retinal changes in patients with type 2 diabetes without diabetic retinopathy[J]. Ann Med, 2022, 54(1): 1816–1825.
[4] PILOTTO E, TORRESIN T, LEONARDI F, et al. Retinal microvascular and neuronal changes are also present, even if differently, in adolescents with type 1 diabetes without clinical diabetic retinopathy[J]. J Clin Med, 2022, 11(14): 3982.
[5] SOHN E H, VAN DIJK H W, JIAO C, et al. Retinal neurodegeneration may precede microvascular changes characteristic of diabetic retinopathy in diabetes mellitus[J]. Proc Natl Acad Sci USA,2016, 113(19): E2655–2664.
[6] NANEGRUNGSUNK O, PATIKULSILA D, SADDA S R. Ophthalmic imaging in diabetic retinopathy: A review[J]. Clin Exp Ophthalmol, 2022, 50(9): 1082–1096.
[7] 中華醫學會糖尿病學分會視網膜病變學組. 中國2型糖尿病防治指南(2017年版)[J]. 中華糖尿病雜志, 2018, 10(1): 4–67.
[8] 中華醫學會眼科學會眼底病學組. 我國糖尿病視網膜病變臨床診療指南(2014年) [J]. 中華眼科雜志, 2014, 50(11): 851–865.
[9] MCANANY J J, LIU K, PARK J C. Electrophysiologicalmeasures of dysfunction in early-stage diabetic retinopathy: no correlation between cone phototransduction and oscillatory potential abnormalities[J]. Doc Ophthalmol,2020, 140(1): 31–42.
[10] MCANANY J J, PARK J C. Cone Photoreceptor dysfunction in early-stage diabetic retinopathy: association between the activation phase of cone phototransduction and the flicker electroretinogram[J]. Invest Ophthalmol Vis Sci, 2019, 60(1): 64–72.
[11] HUANG J, LI Y, CHEN Y, et al. Multifocal electroretinogram can detect the abnormal retinal change in early stage of type2 dm patients without apparent diabetic retinopathy[J]. J Diabetes Res,2021, 2021: 6644691.
[12] VAN DIJK H W, VERBRAAK F D, KOK P H, et al. Early neurodegeneration in the retina of type 2 diabetic patients[J]. Invest Ophthalmol Vis Sci,2012, 53(6): 2715–2719.
[13] 吳宇霏, 譚凡, 鄭玥, 等. 2型糖尿病患者早期黃斑區視網膜亞層及脈絡膜的光學相干斷層掃描成像特征[J].中華眼視光學與視覺科學雜志, 2018, 20(11): 663–668.
[14] 冀向寧, 張習, 韓風梅, 等. 糖耐量異常及2型糖尿病患者早期視網膜損傷的觀察[J]. 中華眼視光學與視覺科學雜志,2015, 17(3): 176–180.
[15] 李海東, 方偉, 吳素蘭, 等. 糖尿病視網膜病變患眼視盤旁血流和視網膜神經纖維層厚度參數變化特征[J]. 中華眼底病雜志,2020, 36(6): 458–461.
[16] 尹玉如, 焦萬珍, 趙博軍. 糖尿病患者視網膜神經組織變性及微血管損傷研究[J]. 中華眼底病雜志,2022, 38(1): 27–33.
[17] 張佳慧, 陳曉隆. 2型糖尿病患者黃斑區結構改變與視力的相關性分析[J]. 中華眼底病雜志,2020, 36(5): 370–373.
Correlation between diabetes mellitus and retinal layers thickness
Department of Ophthalmology, Affiliated Hospital of Shaoxing University, Shaoxing 312000, Zhejiang, China
To investigate the possible relationship between retinal layers thickness and diabetes.A retrospective study was conducted. A total of 54 patients with type 2 diabetes admitted to the Affiliated Hospital of Shaoxing University from January to December 2021 were collected. Divided into a non-proliferative diabetic retinopathy (NPDR) group (=27), and a diabetic without retinopathy (NDR) group (=27). Non-diabetic patients matching age and gender at the same period were selected as the control group (=34). The thickness of retinal layers at the fovea, the nasal and temporal sides were measured by SD-OCT. The difference of retinal layers thickness and the correlation of each factor were analyzed.The thickness of the outer retinal layer in the macular fovea in both NPDR and NDR groups was thinner than that in the control group (NPDRControl,=0.001; NDRControl,=0.038). The thickness of the temporal inner nuclear layer in NPDR group was thicker than that in NDR group and control group (NPDRControl,=0.025; NPDRNDR,=0.009). The thickness ratio of the inner retinal layer to the outer retinal layer in the macular fovea was larger in NPDR group and NDR group than in control group(NPDRControl,=0.022; NDRControl,=0.040). The thickness ratio of the inner retinal layer to the outer retinal layer in temporal was larger in NPDR group than in NDR group and Control group (NPDRNDR,=0.007; NPDRControl,=0.020). Diabetic retinopathy status affected temporal inner nuclear layer thickness (=0.019).The retinal layers thickness in patients with type 2 diabetes was changed. Diabetic retinopathy status was related to the thickness of the temporal inner nuclear layer, which can increase the thickness of the temporal inner nuclear layer.
Optical coherence tomography; Diabetes; Diabetic retinopathy; Retinal layers
R587.2
A
10.3969/j.issn.1673-9701.2023.26.019
徐永根,電子信箱:xuyonggensx@163.com
(2023–02–23)
(2023–08–29)

