骨髓間充質干細胞來源外泌體對骨折大鼠的成骨作用
李暢 范榮 李東波 周威 黃玉娥
骨折的修復是一個再生過程,包括血管生成、干細胞分化、成骨和軟骨形成[1]。而5%~10%的骨折會導致愈合延遲或不愈合[2],這兩種情況都需要反復治療,并且對生活質量產生重大影響。骨折的治療比骨折更困難。手術是主要的臨床治療方法。間充質干細胞(mesenchymal stem cells,MSCs)是一種具有多向分化潛能、免疫調節作用和能進行自我更新的多能干細胞等[3]。其中,骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMMSCs)能夠分化為成骨細胞、表皮細胞、脂肪細胞等多種細胞譜系[4,5]。外泌體(exosomes)是正常生理和病理條件下細胞間通訊的重要參與者,被證明在組織修復中具有重要作用[6]。這些30~150 nm的小顆粒被大多數細胞通過與質膜融合而分泌到細胞外環境中[7]。當將外泌體施用于異種動物時,它們不會誘導明顯的免疫反應。脂質體膜可以保護外泌體的內容物免受破壞。外泌體上的特定表面配體可以與靶細胞結合,使外泌體將RNA、蛋白質或細胞因子傳遞到靶細胞中以刺激特定的生物學功能[8]。本實驗研究骨髓間充質干細胞來源外泌體對大鼠骨折是否具有促進骨愈合作用,并探究成骨作用的作用機制。
1 材料與方法
1.1 材料
1.1.1 動物:雄性Wistar大鼠(3周齡)和成年雄性Wistar大鼠(12周齡,250~300 g)由海南藥物研究所有限責任公司提供[動物使用合格證:SYXK(瓊)2013-0022]。實驗大鼠按照實驗標準飼養于動物房中,實驗動物設計通過倫理委員會審查。
1.1.2 試劑:Percoll分離液、PBS、茜素紅S和油紅O購自美國Sigma公司。胎牛血清和DMEM/F12培養基購自美國Gibco公司。CD45-PE、CD29-FITC、CD90-FITC、CD45-PE、CD117-APC、CD63和CD81抗體購自美國BD Biosciences公司。BMP2、Smad1、Runx2、IgG和GAPDH抗體購自美國Cell Signaling Technology公司。HE染色試劑盒購自北京凱瑞基生物科技公司。RIPA裂解液和BCA試劑盒購自美國Abcam公司。
1.2 方法
1.2.1 細胞提取與培養:腹腔注射戊巴比妥鈉麻醉處死Wistar大鼠后,將大鼠用75%乙醇浸泡消毒,快速移入超凈工作臺,進行細胞提取相關操作。將大鼠固定,分離出大鼠股骨,將骨頭表面肌肉剔除,PBS清洗2次。將股骨兩端剪斷,用DMEM/F12培養基將骨頭中骨髓沖出并收集在離心管中,反復吹打,1 000 r/min離心5 min,棄上清收集沉淀,并使用培養基重懸細胞,將細胞懸液加入到Percoll分離液中,并反復吹打,2 000 r/min,離心20 min。吸取中間白色渾濁狀骨髓基質細胞層,1 000 r/min離心5 min,收集細胞沉淀。重懸細胞并接種于細胞培養瓶中,37℃、5% CO2培養箱中培養。48 h后將細胞培養基去掉,除去未貼壁細胞,再補充新鮮培養基,每3天換液1次。
1.2.2 BMMSCs的體外分化:①成骨分化:成骨分化的培養基條件:完全培養基補充0.05 mmol/ml抗壞血酸-2-磷酸、100 nmol/ml地塞米松和10 mmol/ml β-甘油磷酸酯。分離的BMMSCs在上述培養基條件培養4周,2%茜素紅S(pH值 4.1~4.3)染色評估成骨分化情況。②成脂分化:成脂分化的培養基條件:完全培養基補充10~6 mol/L地塞米松、0.5 mmol/ml異丁基-甲基黃嘌呤、200 μmol/ml吲哚美辛和10 mg/ml胰島素。分離的BMMSCs在上述培養條件培養2周,0.5%油紅O染色細胞內脂滴來評估脂肪分化情況。
1.2.3 細胞流式術:用胰蛋白酶消化第3代BMMSCs,并重懸于含有10%胎牛血清的DMEM/F12培養基中。 用PBS洗滌細胞2次。隨后,將細胞與抗CD29-FITC抗體、抗CD90-FITC抗體、抗CD45-PE抗體、抗CD117-APC抗體、抗CD81抗體和抗CD63抗體孵育30 min。然后將細胞懸液以1 000 r/min,離心5 mim。最后,將細胞懸浮液轉移到新的檢測管中,然后使用流式細胞儀檢測細胞表面抗原。
1.2.4 外泌體的分離與鑒定:80% 融合的BMMSCs在完全培養基中培養48 h,然后將培養基移至新試管中,在4℃下以300 g離心10 min。然后將上清液在4℃下以16 500 g離心30 min,以消除細胞碎片。通過使用0.22 μm過濾器過濾細胞上清液,以去除整個細胞和多余的細胞碎片。之后,將上清液移至新試管中,在4℃下以100 000 g進行70 min超速離心,以沉淀外泌體。收集沉淀物后,再次進行超速離心,并收集沒有外泌體的上清液用于后續實驗。外泌體通過納米粒子跟蹤分析(NTA),透射電子顯微鏡(TEM)和流式細胞術進行鑒定。
1.2.5 大鼠骨折模型制備:腹腔注射3% 戊巴比妥鈉麻醉大鼠,在右股骨干附近進行手術。10 mm切口暴露右股骨干。首先將中段處股骨橫行切斷,隨后在骨折近端逆行插入髓內固定針,并從股骨大轉子穿出,傷口用0.9%氯化鈉溶液反復沖洗后縫合。手術結束后,大鼠在清潔級環境下單籠飼養,并經腹腔注射青霉素(100 000 U/ml,1 ml/kg)3 d。
1.2.6 分組及給藥:分組:60只Wistar大鼠按照1.2.5制備骨折模型,將大鼠隨機分為對照組(control組)、沒有外泌體的培養基組(CM-Exo)和外泌體組(Exo組),每組20只。大鼠經造模24 h后,尾靜脈注射給藥500 μl。control組:PBS溶液;CM-Exo組:沒有外泌體的上清液500 μl;Exo組:外泌體500 μl(外泌體蛋白濃度為200 μg/ml)。42 d后,麻醉處死大鼠,取材,進行相應指標檢測。
1.2.7 mirco-CT:4%多聚甲醛固定大鼠股骨24 h后,使用micro-CT系統以50 kV和200 μA的9 μm分辨率分析大鼠愈傷組織體積(CV)、骨體積(BV)與總體積(TV)的比值。
1.2.8 HE:固定、包埋的股骨組織切片后進行HE染色。切片經二甲苯脫蠟后,使用不同濃度梯度乙醇(100%,5 min;95%,2 min;85%,2 min;75%,2 min)脫水。依次進行蘇木精染色5 min,伊紅染色3 min,染色后乙醇脫水(75%、85%、95%乙醇脫水,5 min/次),二甲苯透明,中性樹膠封片,切片制備完成。
1.2.9 Western blot:將細胞培養液棄去后,加入RIPA裂解液提取細胞蛋白。蛋白樣本經電泳、轉膜、封閉后,4℃孵育一抗過夜:BMP2抗體(1∶1 000)、Smad1抗體(1∶1 000),Runx2抗體(1∶1 000)和GAPDH抗體(1∶2 000)。TBST洗滌3次,再用IgG-HRP二抗(1∶5 000)孵育1 h,TBST洗滌3次后,顯影曝光,并用Image-Pro Plus圖像分析系統分析。
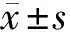
2 結果
2.1 BMMSCs的形態和分化鑒定 從Wistar大鼠股骨中提取的BMMSCs具有梭形形狀并顯示出渦旋分布。將第3代BMMSCs接種到6孔板中誘導成骨和脂質分化:誘導21 d后,茜素紅S染色結果表明存在許多鈣化結節,同樣,油紅O染色結果也顯示出大量的脂質滴。見圖1。

圖1 BMMSCs的形態和分化鑒定;A BMMSCs的細胞形態;B BMMSCs的成骨分化檢測(茜素紅S染色×400);C BMMSCs的成脂分化檢測(油紅O染色×400)
2.2 BMMSCs表面標志物檢測 流式細胞術表明CD29、CD90在BMMSCs中高表達,但CD45和CD117在BMMSCs不表達,并且其表型在傳代中始終保持不變。見圖2。

圖2 BMMSCs表面標志物檢測
2.3 外泌體的表征 TEM圖像表明,大多數顆粒為圓形;NTA結果表明外泌體的直徑范圍均為50~150 nm;流式細胞儀分析檢測到外泌體的特定表面標記,包括CD81和CD63在外泌體中呈陽性。見圖3。

圖3 外泌體的表征;A TEM顯示外泌體的形態;B NTA測定純化的外泌體中粒徑分布;C 流式細胞術檢測外泌體外泌體的特定表面標記:CD81和CD63
2.4 外泌體對骨折愈合的影響 micro-CT檢查結果顯示,在control組和CM-Exo組觀察到明顯的骨折間隙,而Exo組骨折間隙中形成了新的骨形態;Exo組的愈傷組織體積明顯高于control組和CM-Exo組(P<0.01);Exo組的BV/TV明顯高于control組和CM-Exo組(P<0.01)。見表1。
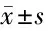
表1 外泌體對骨折愈合的影響
2.5 外泌體對3組大鼠股骨組織病理變化的影響 HE結果表明,control組和CM-Exo組股骨骨折處存在纖維組織;與control組和CM-Exo組比較,Exo組股骨的骨折部位編織骨形成增加。Exo干預可改善大鼠股骨骨折愈合情況。見圖4。

圖4 外泌體對3組大鼠股骨組織病理變化的影響(HE染色×200)
2.6 外泌體對BMP2/Smad1/RUNX2途徑的影響 Western blot結果顯示,與control組和CM-Exo組比較,Exo組中BMP2、Smad1和RUNX2蛋白表達顯著增加(P<0.01)。見圖5,表2。
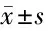
表2 BMP2/Smad1/RUNX2途徑蛋白表達統計表

圖5 外泌體對BMP2/Smand1/RUNX2途徑蛋白表達的影響
3 討論
隨著老齡化社會的到來,與年齡有關的疾病盛行,其中老年人的骨折發生率明顯增加。骨折的愈合能力根據生物體的年齡而有很大不同。例如,在某些特定類型的骨折中,許多老年人因骨折愈合延遲或骨不連而感到痛苦[9]。骨折后延長康復過程可能導致嚴重并發癥,甚至可能導致死亡[10]。
研究發現,干細胞已成為治療骨折的另一種選擇[11]。MSCs由于具有骨再生潛力,被認為是最適合自體治療的干細胞類型之一[12]。BMMSCs已被證明可有效增強成骨和血管生成[13]。Baker等[14]揭示MSCs的成骨作用是通過PI3K/Akt信號傳導途徑發生的。干細胞的應用仍然受到免疫排斥、惡性轉化、染色體變異等的限制[15],而且大多數用于臨床試驗的MSCs缺乏足夠的臨床前研究和制造質量控制。
外泌體是重要的旁分泌因子,可以用作組織修復的治療手段,特別是在骨再生領域[16]。外泌體能誘發非免疫相容性動物也不會誘發明顯的免疫反應[17]。Narayanan等[18]研究發現外泌體可在體外和體內誘導MSCs的特異性分化,并在骨折愈合過程中促進血管生成。本實驗中發現,Exos組骨折間隙中形成了新的骨形態,愈傷組織體積和BV/TV明顯增加。
BMP2/Smad1/Runx2信號軸在BMMS增殖和成骨分化中發揮重要作用[19]。Smad蛋白與RUNX2蛋白共同參與調節成骨細胞中膠原蛋白和其他表型蛋白表達和分化[20]。我們的研究表明,用BMMSC-Exos刺激愈傷組織,BMP2、Smad1和RUNX2的表達水平顯著增加,表明BMP2/Smad1/RUNX2途徑在BMMSC-Exos增強成骨作用的有效性中起重要作用。
綜上所述,BMMSC-Exos通過促進成骨作用對骨折的治療起關鍵作用,其可能與BMP2/Smad1/RUNX2信號通路的激活有關。因此,BMMSC-Exos在骨折的治療過程中起著至關重要的作用,為臨床上治療骨折提供新的治療方法。

