基于TLR4/NF-κB信號通路沉默miR-21對糖尿病腎病大鼠的干預效果
張琳萍 姚筱 朱燕亭 金剛
糖尿病腎病的發(fā)生與遺傳、糖代謝異常、免疫炎癥、腎小球高灌注等因素存在聯(lián)系,其臨床病理變化為足突融合、腎小球肥大、基底膜增厚、腎小管肥大等,隨病情的發(fā)展可出現(xiàn)腎功能喪失,對患者生命安全構(gòu)成嚴重威脅[1-3]。miR-21是一種與肺癌、腎癌、心血管疾病存在密切聯(lián)系的微小RNA家族成員,對血管內(nèi)皮細胞功能具有調(diào)控作用,且可參與臟器纖維化[4]。TLR4/NF-κB是在高血壓、心肌缺血再灌注損傷、動脈粥樣硬化等多種心血管疾病中均呈異常激活的信號通路,可參與免疫炎癥、細胞增殖分化、氧化應激等過程[5]。基于此,本文研究中基于TLR4/NF-κB信號通路探究沉默miR-21對糖尿病腎病的干預效果,以期為糖尿病腎病臨床診治提供借鑒。
1 材料與方法
1.1 動物 選取45只SPF級Wistar大鼠,體重220-260g,由濟南金豐實驗動物有限公司提供,動物許可證號:SYXK(魯) 2019 0019,所有大鼠在無病原菌、相對濕度、室溫分別為50%、23℃的籠子中進行喂養(yǎng),所使用的水、食物均經(jīng)高溫高壓殺毒,適應性喂養(yǎng)7 d,本試驗操作均參照動物試驗倫理要求的相關規(guī)定,且經(jīng)我院倫理委員會批準同意。
1.2 方法
1.2.1 miR-21慢病毒載體構(gòu)建:通過GenBanK查找序列獲得LPL基因序列,構(gòu)建miR-21過表達轉(zhuǎn)染質(zhì)粒、miR-21沉默轉(zhuǎn)染質(zhì)粒,由上海吉瑪公司設計并合成,并做慢病毒滴度測定(病毒滴度為1×109TU/ml)。
1.2.2 分組與建模:在適應性喂養(yǎng)7d后選取45只大鼠,10只作為空白組,其余35只參照孫李永眷等[6]建立糖尿病腎病模型,于麻醉后將建模大鼠右側(cè)腎臟切除,術前需禁食10 h,手術完成后給予青霉素預防感染,繼續(xù)喂養(yǎng)14 d,給予腹腔注射鏈脲佐菌素(30 mg/kg),連續(xù)注射3d,以血糖水平、蛋白含量分別為2 g/L、30 mg/24 h為建模成功,最終有30只建模成功,將建模成功的30只大鼠分為模型組、上調(diào)組、下調(diào)組各10只。
1.2.3 miR-21轉(zhuǎn)染:將10 μl miR-21過表達慢病毒懸液、miR-21沉默慢病毒懸液分別注射于上調(diào)組、下調(diào)組大鼠胃組織中,空白組、模型組注射同劑量的蒸餾水灌胃,注射24 h后觀察大鼠變化。
1.3 觀察指標
1.3.1 樣本采集:于miR-21轉(zhuǎn)染后,將所有大鼠麻醉后處死,獲取大鼠腎組織,制成標本,-80℃保存。
1.3.2 病理學觀察:于miR-21轉(zhuǎn)染后,取大鼠腎組織,經(jīng)脫水、石蠟包埋處理后,做HE染色,光鏡下觀察病理形態(tài)改變。
1.3.3 miR-21轉(zhuǎn)染效率鑒定:于miR-21轉(zhuǎn)染后,取大鼠腎組織,miR-21轉(zhuǎn)染效率經(jīng)通過實時熒光定量法進行鑒定,提取腎組織總RNA,使用Takara逆轉(zhuǎn)錄試劑盒將組織中的RNA逆轉(zhuǎn)錄為cDNA,采用Primer5.0軟件設計引物序列,啟動PCR儀,反應體系:0.4 μl上下游引物、1μlcDNA模板、10μlSYBGreen,加蒸餾水至20 μl。反應條件:97℃預熱8 min、95℃變性5 s、60℃退火31 s,共進行40個循環(huán),采用2-△△Ct方法計算出miR-21的表達量。miR-21上游引物序列:5’-ACACTCCAGCTGGGTAGCTTATCAGACTGA-3’,下游引物序列:5’-TGGTGTCGTGGAGTCG-3’;內(nèi)參GAPDH上游引物序列:5’-GCTTVGGCACATATACTAAAAT-3’,下游引物序列:5’-CGCTTCACGAATTTGAGTGTCAT-3’。
1.3.4 炎性因子、腎纖維化指標水平檢測:于miR-21轉(zhuǎn)染后,取大鼠腎組織,加入適量(1∶10)組織蛋白抽離液,充分碾碎,以離心半徑3 cm,轉(zhuǎn)速3 000 r/min,離心10 min,提取上清液,70℃保存待測,通過酶聯(lián)免疫吸附(ELISA)法對各組大鼠IL-6、IL-1、CCL2、CTGF、TGF-β1水平進行檢測。
1.3.5 內(nèi)皮功能指標水平檢測:于miR-21轉(zhuǎn)染后,取大鼠腎組織,加入適量(1∶10)組織蛋白抽離液,充分碾碎,以離心半徑3 cm,轉(zhuǎn)速3 000 r/min,離心10 min,提取上清液,70℃保存待測,通過放射免疫法對各組大鼠NO、ET-1水平進行檢測。
1.3.6 TLR4/NF-κB信號通路蛋白相對表達量檢測:通過Western Blot對腎組織中的TLR4/NF-κB信號通路中的TLR4、NF-κB蛋白相對表達量進行檢測,將各組大鼠腎組織剪碎后加入裂解液,進行30 min裂解,以離心半徑3 cm,轉(zhuǎn)速3 000 r/min離心處理10 min,取上清液,做BCA蛋白定性檢測,將樣品上樣至8%SDS-PAGE凝膠上,經(jīng)電泳后轉(zhuǎn)移至PVDF膜上,用PBS封閉2 h后,加入TBST稀釋的羊抗鼠TLR4、NF-κB(1∶2 500)一抗,后4℃孵育過夜,洗膜3次,加入1∶10 000的稀釋羊抗鼠二抗,溫室孵育1 h,做TBST洗膜3次,以GAPDH為內(nèi)參照,定量分析蛋白表達情況,重復試驗3次。鼠源性一抗由上海嶸崴達實業(yè)有限公司提供。
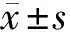
2 結(jié)果
2.1 病理學特征比較 空白組大鼠基質(zhì)分布、系膜細胞數(shù)量無明顯變化,間質(zhì)結(jié)構(gòu)、腎小球結(jié)構(gòu)正常;模型組大鼠間質(zhì)增加,腎小球增大,系膜細胞明顯增殖,腎小球上皮細胞發(fā)生萎縮、壞死;上調(diào)組間質(zhì)增加,腎小球明顯增大,系膜細胞明顯增殖,腎小球上皮細胞發(fā)生萎縮、壞死嚴重;下調(diào)組間質(zhì)、腎小球、系膜細胞、腎小球上皮細胞異常變化明顯改善。見圖1。

圖1 病理特征比較(HE染色×200)
2.2 miR-21轉(zhuǎn)染效率鑒定 與空白組相比,模型組、下調(diào)組、上調(diào)組miR-21表達量上升,差異有統(tǒng)計學意義(P<0.05);與模型組相比,上調(diào)組miR-21表達量上升,下調(diào)組miR-21表達量下降,具有統(tǒng)計學差異(P<0.05);與上調(diào)組相比,下調(diào)組miR-21表達量下降(P<0.05),說明轉(zhuǎn)染成功。見表1。
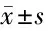
表1 miR-21轉(zhuǎn)染效率鑒定 n=10,
2.3 4組大鼠炎性因子水平比較 與空白相比,模型組、上調(diào)組、下調(diào)組IL-6、IL-1、CCL2水平上升(P<0.05);與模型組相比,上調(diào)組IL-6、IL-1、CCL2水平上升,下調(diào)組IL-6、IL-1、CCL2水平下降,差異有統(tǒng)計學意義(P<0.05);與上調(diào)組相比,下調(diào)組IL-6、IL-1、CCL2水平下降,差異有統(tǒng)計學意義(P<0.05)。見表2。
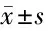
表2 4組大鼠炎癥因子水平比較 n=10,
2.4 4組大鼠內(nèi)皮功能比較 與空白相比,模型組、上調(diào)組、下調(diào)組NO水平下降,ET-1水平上升(P<0.05);與模型組相比,上調(diào)組NO水平下降,ET-1水平上升,下調(diào)組NO水平上升,ET-1水平下降,差異均有統(tǒng)計學意義(P<0.05);與上調(diào)組相比,下調(diào)組NO水平上升,ET-1水平下降,差異均有統(tǒng)計學意義(P<0.05)。見表3。
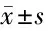
表3 4組大鼠內(nèi)皮功能比較 n=10,
2.5 4組大鼠腎纖維化指標比較 與空白相比,模型組、上調(diào)組、下調(diào)組CTGF、TGF-β1水平上升(P<0.05);與模型組相比,上調(diào)組CTGF、TGF-β1水平上升,下調(diào)組CTGF、TGF-β1水平下降,差異均有統(tǒng)計學意義(P<0.05);與上調(diào)組相比,下調(diào)組CTGF、TGF-β1水平下降,差異均有統(tǒng)計學意義(P<0.05)。見表4。
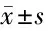
表4 4組大鼠腎纖維化指標比較 n=10,
2.6 4組大鼠腎組織TLR4/NF-κB信號通路蛋白相對表達量 與空白相比,模型組、上調(diào)組、下調(diào)組TLR4、NF-κB表達量上升(P<0.05);與模型組相比,上調(diào)組TLR4、NF-κB表達量上升,下調(diào)組TLR4、NF-κB表達量下降,差異均有統(tǒng)計學意義(P<0.05);與上調(diào)組相比,下調(diào)組TLR4、NF-κB表達量下降,差異均有統(tǒng)計學意義(P<0.05)。見表5,圖2。
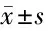
表5 4組大鼠腎組織TLR4/NF-κB信號通路蛋白相對表達量 n=10,

圖2 TLR4/NF-κB信號通路蛋白WB圖
3 討論
糖尿病患者因體重增加、血糖不穩(wěn)等因素易引發(fā)糖尿病腎病、糖尿病足等并發(fā)癥,對患者生命安全威脅較大[7,8]。糖尿病腎病早期患者腎小球細胞、基底膜因腎臟血流動力學變化而增多、增厚,后期可引發(fā)腎功能衰竭,對患者預后造成了不利影響[9]。
miR-21在多種疾病的均發(fā)揮著重要調(diào)控作用,在肺癌、腎癌中miR-21可發(fā)揮促癌作用,可加重患者病情,在心血管疾病中,miR-21對血管內(nèi)皮細胞具有調(diào)控作用,且可推動腎臟、肺臟、肝臟纖維化過程,進而參與了疾病的發(fā)生、發(fā)展[10,11]。本文研究發(fā)現(xiàn),經(jīng)沉默miR-21干預后大鼠炎性反應、腎臟纖維化減輕,血管內(nèi)皮功能改善。相關學者研究發(fā)現(xiàn),miR-21對細胞外基質(zhì)降解具有抑制作用,對系膜基質(zhì)沉積、腎臟間質(zhì)肥大具有促進作用,使得腎臟纖維化加重,同時miR-21可激活NF-κB,促進TNF-α、IL-1β等炎性因子的釋放,進而加重炎性反應,推動了糖尿病腎病患者病情發(fā)展[12,13],與本文研究結(jié)果保持一致。表明沉默miR-21可抑制糖尿病腎病大鼠病情的發(fā)展,糖尿病腎病發(fā)生、發(fā)展過程中腎纖維化、炎性反應、血管內(nèi)皮功能異常發(fā)揮著重要作用。IL-6、IL-1、CCL2作為炎性因子,可使炎癥細胞因子在炎癥部位所聚集[14]。NO、ET-1可對血管舒張功能進行反映,其水平表達異常表明機體存在血管內(nèi)皮損傷[15]。CTGF、TGF-β1可參與腎纖維化過程,其水平越高表明腎纖維化越嚴重[16]。本文研究發(fā)現(xiàn),糖尿病腎病大鼠經(jīng)沉默miR-21干預后IL-6、IL-1、CCL2、ET-1、CTGF、TGF-β1水平下降,NO水平上升。相關學者研究發(fā)現(xiàn),IL-6對炎癥部位中性粒細胞的聚集具有促進作用,進而導致氧自由基釋放增加,使得腎臟內(nèi)皮細胞、組織損傷加重,IL-1是對前列腺素E2表達具有促進作用的致炎因子,CCL2可使單核細胞向炎癥部位聚集,進而加重了炎性反應,且在高血糖的刺激下CCL2表達增加,NO、ET-1可對血管內(nèi)皮功能進行反映,其表達失衡可導致腎臟血管收縮力增加,腎臟血流量增加,最終可引發(fā)尿蛋白,加重了糖尿病腎病患者病情,CTGF對膠原蛋白、纖維連接蛋白結(jié)合具有促進作用,進而促進了細胞外基質(zhì)纖維化,TGF-β1對細胞生長、分化具有調(diào)節(jié)作用,可推動細胞外基質(zhì)代謝,使得腎臟細胞發(fā)生損傷,加重了腎纖維化[17-19],與本文研究結(jié)果保持一致。表明沉默miR-21可抑制炎性反應、腎纖維化,調(diào)節(jié)血管內(nèi)皮功能。
TLR4/NF-κB是在多種心血管疾病中均呈異常激活的信號通路,可參與炎性反應、免疫反應等過程[20,21]。本文研究發(fā)現(xiàn),經(jīng)沉默miR-21干預后糖尿病腎病大鼠TLR4/NF-κB信號通路得到抑制,病情緩解。相關學者研究發(fā)現(xiàn),TLR4/NF-κB在糖尿病腎病中處于異常激活狀態(tài),TLR4可促進腎臟實質(zhì)細胞的表達,而NF-κB可使成纖維細胞分化、增殖,推動了了腎小球?qū)嵒?且激活的TLR4/NF-κB信號通路可促進免疫活性因子、炎癥細胞因子、組胺因子的釋放,進而加重機體炎癥反應,推動了糖尿病腎病的發(fā)展[22-25],與本文研究結(jié)果保持一致。表明沉默miR-21可抑制TLR4/NF-κB信號通路,作用于炎癥反應過程,進而改善大鼠血管內(nèi)皮功能,抑制腎纖維化,最終抑制了糖尿病腎病大鼠病情的發(fā)展。
綜上所述,本文研究顯示,糖尿病腎病發(fā)生后伴隨IL-6、IL-1、CCL2、ET-1、CTGF、TGF-β1水平上升,NO水平下降等表現(xiàn),經(jīng)沉默miR-21干預后可改善上述情況,其機制可能與TLR4/NF-κB信號通路被激活有關。但僅為本文研究,未有研究分析其具體作用機制,因此上述研究需后續(xù)研究進一步分析驗證。

