羊肚菌蛋白抗氧化肽的制備及抗運動疲勞活性研究
馬建偉
(河南科技大學 體育學院,河南 洛陽 471000)
羊肚菌(Morchella esculentaL.),又稱羊肚菜、羊肚蘑,屬羊肚菌科(Morchellaceae)羊肚菌屬(Morchella),是珍貴的食藥兼用菌,因形似蜂巢狀,又似羊肚狀,故而得此名[1]。羊肚菌營養豐富,含有多糖、蛋白質(氨基酸)、甾醇、有機酸和微量元素等活性物質[2],并具有抗氧化、抗衰老、抗腫瘤、增強免疫力、降血糖、降血脂、抗疲勞等功效[2-7]。羊肚菌種類較多,不同產地的羊肚菌,其蛋白質含量有所差異。據報道,羊肚菌子實體中蛋白含量約為7.87%~38.11%[8],蛋白含量因品種而異。此外,羊肚菌還含有7種人體必需氨基酸,是一種優質的蛋白質源。
生物活性肽是由2個以上氨基酸通過肽鍵連接而成的介于氨基酸和蛋白質之間的多肽(相對分子質量<6 000 Da)[9-11],這類肽通常具有抗氧化、抗病毒、降血壓、降低膽固醇、抑制細菌、提高免疫力、抗癌等活性[12]。常見生物活性肽的制備方法有微生物發酵法、分離提取法和酶解法等[12],其中,酶法制備的優點在于酶解條件易控制,制備的生物活性肽性能比較穩定,在酸性條件和較高溫度條件下結構保持完整。酶解法利用特定的蛋白酶類,可以有目的地對特定肽段進行剪切,以期獲得所需功能活性的肽[13]。食用菌水解酶是一種針對食用菌水解的專用復合酶制劑,具有純天然、安全無毒、水解能力強等特點,目前已應用于蘑菇[14]、香菇[15]、草菇[16]、百靈菇[17]、金針菇和杏鮑菇[18]等食用菌酶解提取多糖及風味物質的研究。當前,對羊肚菌的研究主要集中在羊肚菌多糖提取及抗氧化活性方面[19-21],利用酶解法酶解羊肚菌制備多肽也有學者進行了研究[22-23],但利用食用菌水解酶來水解羊肚菌制備抗氧化肽和進行抗運動疲勞研究較少報道。
為進一步提高羊肚菌蛋白的附加經濟價值,拓寬羊肚菌產品的深加工產業鏈,本研究以羊肚菌蛋白為原料,采用酶解法制備羊肚菌蛋白抗氧化肽,篩選最佳蛋白酶,以水解度及1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力為評價指標,通過單因素試驗及響應面法優化羊肚菌蛋白抗氧化肽的制備工藝條件,并進行抗氧化和抗運動疲勞研究,以期為羊肚菌蛋白進行保健食品深加工開發提供理論依據。
1 材料與方法
1.1 材料與試劑
羊肚菌子實體:河南金海食用菌研究院有限公司;無特定病原體(specificpathogenfree,SPF)級雄性KM小鼠:40只,體質量(18±2)g,批號為[SCXK(豫)2020-0002]:洛陽普萬泰生物技術有限公司。
堿性蛋白酶(酶活2萬U/g):北京索萊寶科技有限公司;胰蛋白酶(酶活4萬U/g)、食用菌水解酶A1(酶活2萬U/g)、食用菌水解酶A2(酶活10萬U/g):廣西南寧龐博生物工程有限公司;1,1-二苯基-2-三硝基苯肼(DPPH):成都麥卡希化工有限公司;血清尿素氮、血乳酸、肝糖原、肌糖原和超氧陰離子試劑盒:南京建成生物工程研究所;其他試劑均為分析純。
1.2 儀器與設備
HH-2數顯恒溫水浴鍋:常州澳華儀器有限公司;DL-5高速離心機:上海安亭科學儀器廠;LGJ-1F冷凍干燥機:北京四環儀器有限公司;PHS-3C數顯pH計:上海精科儀器廠;紫外可見光分光光度計:上海菁華科技儀器有限公司;RE-5203旋轉蒸發儀:上海蟻霖科學儀器有限公司。
1.3 方法
1.3.1 羊肚菌蛋白提取
參考文獻[24]方法提取羊肚菌蛋白:利用堿提酸沉法提取羊肚菌蛋白,將羊肚菌干制品用粉碎機粉碎,過60目篩,按照料液比1∶50(g∶mL)加入蒸餾水,調節pH值至12,在超聲溫度60 ℃下浸提60 min。然后以8 000 r/min的轉速離心10 min,取上清液,用雙縮脲法[25]測定羊肚菌的蛋白質含量。提取的羊肚菌蛋白經冷凍干燥后,得羊肚菌蛋白粉末,備用。
1.3.2 羊肚菌蛋白抗氧化肽的制備
羊肚菌蛋白粉按試驗設計加水復溶配制成5%的蛋白溶液,取50 mL溶液在超聲功率300 W條件下超聲30 min,調節溶液至酶最適pH和溫度,恒溫酶解(50 ℃、1.5 h),再滅酶處理(100 ℃、10 min),自然冷卻至常溫后,在轉速為4 000 r/min條件下離心10 min,取上清液,調節pH至中性后旋轉蒸發,冷凍干燥即得羊肚菌蛋白抗氧化肽粉。
1.3.3 蛋白酶篩選試驗
以水解度和DPPH自由基清除率為評價指標,進行蛋白酶篩選試驗,分別采用堿性蛋白酶、胰蛋白酶、食用菌水解酶A1、食用菌水解酶A2水解羊肚菌蛋白粉制備抗氧化肽,加酶量均為0.1%,酶解時間均為1.5 h,其酶解溫度及pH值見表1。

表1 各種蛋白酶酶解條件Table 1 Enzymatic hydrolysis conditions of various proteases
水解度的測定:羊肚菌酶解液中氨基酸態氮含量的測定參考GB 5009.235—2016《食品安全國家標準食品中氨基酸態氮的測定》,總氮含量的測定參考GB 5009.5—2016《食品安全國家標準食品中蛋白質的測定》,水解度計算公式如下:
1.3.4 酶解條件優化單因素試驗
以DPPH自由基清除率和水解度為評價指標,考察食用菌水解酶A1添加量(0.05%、0.10%、0.15%、0.20%、0.25%)、酶解時間(30 min、60 min、90 min、120 min、150 min、180 min)、底物質量分數(3%、4%、5%、6%、7%)、酶解溫度(40 ℃、45 ℃、50 ℃、55 ℃、60 ℃)、酶解pH值(4.0、4.5、5.0、5.5、6.0)對酶解羊肚菌蛋白制備抗氧化肽DPPH自由基清除率和水解度的影響。
1.3.5 酶解條件優化響應面試驗
固定水解酶添加量為0.15%,選取底物質量分數(A)、酶解溫度(B)、酶解時間(C)、酶解pH值(D)為自變量,以DPPH·清除率(Y)為響應值,運用響應面法進行4因素3水平響應面試驗優化其酶解條件,響應面試驗設計因素與水平見表2。

表2 酶解條件優化響應面試驗設計因素及水平Table 2 Factors and levels of response surface test for enzymatic hydrolysis conditions optimization
1.3.6 體外抗氧化活性分析
DPPH·和·OH清除率的測定參考文獻[26-27]方法;超氧陰離子自由基清除活性的測定參考超氧陰離子測定試劑盒說明書。
1.3.7 羊肚菌蛋白抗氧化肽的抗運動疲勞活性
(1)試驗動物分組與給藥
試驗前,分4個組別進行試驗,每組小鼠10只。各小組需要保持在正常飼養的情況下,對照組小鼠給予純凈水(20 mg/kg)灌胃,低劑量、中劑量、高劑量組分別灌胃羊肚菌蛋白抗氧化肽50 mg/kg、100 mg/kg、200 mg/kg,連續灌胃30 d。所有試驗均在小鼠灌胃羊肚菌蛋白抗氧化肽30 min后進行相關操作[28-29]。
(2)負重游泳時間測定試驗
小鼠負重游泳測試放置在水溫28 ℃的水中,并讓各個小組分別進行負重游泳試驗,游泳箱內的水深控制在35 cm左右。在試驗過程當中,對小鼠進行鉛絲捆綁負重,詳細記錄小鼠負重游泳的時間。
(3)爬桿時間測定試驗
將小鼠放置在長30 cm的玻璃棒上,玻璃棒的直徑控制在10 mm左右,從而使小鼠身體各部位肌肉保持緊張感覺。在整個試驗過程中,注意記錄小鼠攀爬玻璃棒的疲勞時間,詳細記錄爬桿時間。
(4)常壓耐缺氧時間測定試驗
將小鼠放置在放有15 g石灰的大瓶中,在小鼠進入大瓶后及時進行瓶口的密封,根據實際情況詳細記錄小鼠耐缺氧時間。
(5)疲勞相關生化指標的測定
參考文獻[30]方法對小鼠進行采血制備血清,并用頸椎脫臼法使小鼠死亡,解剖后,取出小鼠的肝組織制備成10%的組織勻漿,并取小鼠股四頭肌,對羊肚菌蛋白抗氧化多肽液進行血清尿素氮、血乳酸測定;再取一定量的肝組織勻漿,試用于測定肝糖原含量、肌糖原含量和超氧化物歧化酶(superoxide dismutase,SOD)活力。血清指標和組織指標均按劑盒說明書進行測定,血清指標包括血乳酸和血清尿素氮;組織指標包括肝糖原(肝臟組織)、肌糖原(股四頭肌)、超氧化物歧化酶(SOD)活力。
1.3.8 數據分析
利用Excel2019、Origin 9.5軟件進行作圖和數據分析,采用Design-Expert 13.0軟件進行響應面試驗設計及方差分析,利用SPSS26.0軟件進行統計學顯著性分析。
2 結果與分析
2.1 羊肚菌蛋白抗氧化肽蛋白酶的篩選
由圖1可知,以水解度為考察指標對蛋白酶排序從高到低為食用菌水解酶A1>堿性蛋白酶>食用菌水解酶A2>胰蛋白酶。以DPPH自由基清除率為考察指標對蛋白酶排序從高到低為食用菌水解酶A1>食用菌水解酶A2>堿性蛋白酶>胰蛋白酶。綜合考慮,食用菌水解酶A1酶解效果最好,其水解度及對DPPH自由基清除率均最高,分別為24.66%、52.53%。食用菌水解酶是以纖維素酶和蛋白酶為主的復合酶[14],而食用菌水解酶A1以纖維素酶為主,纖維素酶有破壞菇體細胞壁的作用,并將纖維素部分降解為葡萄糖,可促進細胞內物質(蛋白質、多糖類、脂肪等)的溶出[16]。綜合考慮,選擇食用菌水解酶A1作為酶解羊肚菌制備抗氧化肽水解用酶。

圖1 不同蛋白酶酶解對水解度及DPPH自由基清除率的影響Fig.1 Effects of different proteases on hydrolysis degree and DPPH free radical scavenging rates
2.2 酶解條件優化單因素試驗結果
2.2.1 食用菌水解酶A1添加量的確定
由圖2可知,隨著食用菌水解酶A1添加量在0.05%~0.15%范圍內的增加,水解度和DPPH自由基清除率均呈先升高的趨勢;當食用菌水解酶A1添加量為0.15%時,水解度和DPPH自由基清除能力均最高,分別為30.22%、76.68%;當食用菌水解酶A1添加量在0.15%~0.25%范圍內的增加,水解度和DPPH自由基清除能力均下降。綜合考慮,最適食用菌水解酶A1添加量為0.15%。

圖2 食用菌水解酶A1添加量對水解度及DPPH自由基清除率的影響Fig.2 Effects of edible fungi hydrolase A1 addition on hydrolysis degree and DPPH free radical scavenging rate
2.2.2 底物質量分數的確定
由圖3可知,隨著底物質量分數在3%~5%范圍內的增加,水解度及DPPH自由基清除率呈上升趨勢;當底物質量分數為5%時,水解度及DPPH自由基清除率均達到最大值,分別為26.17%、80.56%;當底物質量分數>5%時,水解度逐漸下降,DPPH自由基清除率有所下降。其原因可能是,適宜的底物質量分數使蛋白質與酶分子更好地接觸,提高酶解效率;但當底物質量分數過大時,水解液黏度增大,酶不能與底物充分反應,底物與蛋白酶擴散速率降低,反應受到抑制,酶解效率下降,具有抗氧化活性的肽生成量相應降低[31-32]。綜合考慮,最適底物質量分數為5%。

圖3 底物質量分數對水解度及DPPH自由基清除率的影響Fig.3 Effects of substrate mass fraction on hydrolysis degree and DPPH free radical scavenging rate
2.2.3 酶解時間的確定
由圖4可知,隨著酶解時間在30~120 min的延長,水解度及DPPH自由基清除率均逐漸上升;酶解時間為120 min時,水解度和DPPH自由基清除率達到最大值,分別為28.88%、71.98%;當酶解時間>120 min,水解度有所下降,DPPH自由基清除率明顯下降。其原因可能是,酶解初期,酶與底物充分反應,水解和生成具有抗氧化活性的多肽較多;隨著酶解時間的延長,底物不斷被消耗,酶與底物特異性位點被完全反應,繼續酶解導致底物的過度水解,具有抗氧化活性的肽進一步被降解為低活性的氨基酸[33]。綜合考慮,最適酶解時間為120 min。
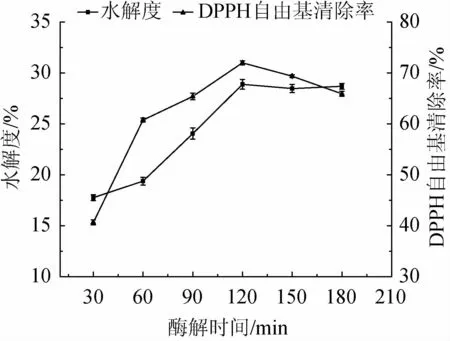
圖4 酶解時間對水解度及DPPH自由基清除率的影響Fig.4 Effects of enzymolysis time on hydrolysis degree and DPPH free radical scavenging rate
2.2.4 酶解溫度的確定
由圖5可知,隨著酶解溫度在40~50 ℃的升高,水解度及DPPH自由基清除率均逐漸上升;當酶解溫度為50 ℃時,水解度及DPPH自由基清除率均達到最大值,分別為29.09%、78.67%;當酶解溫度>50 ℃時,水解度和DPPH自由基清除率下降。綜合考慮,最適酶解溫度為50 ℃。

圖5 酶解溫度對水解度及DPPH自由基清除率的影響Fig.5 Effects of enzymolysis temperature on hydrolysis degree and DPPH free radical scavenging rate
2.2.5 酶解pH值的確定
由圖6可知,當酶解pH值為4.0~4.5時,水解度逐漸上升;當酶解pH值為4.5時,水解度達最大值,為30.26%;當酶解pH值>4.5時,水解度下降。當酶解pH值為4.0~5.0時,DPPH自由基清除率逐漸上升;當酶解pH值為5.0時,DPPH自由基清除率達最大值,為82.22%;當酶解pH值>5.0時,DPPH自由基清除率下降。綜合考慮,最適酶解pH值為4.5。
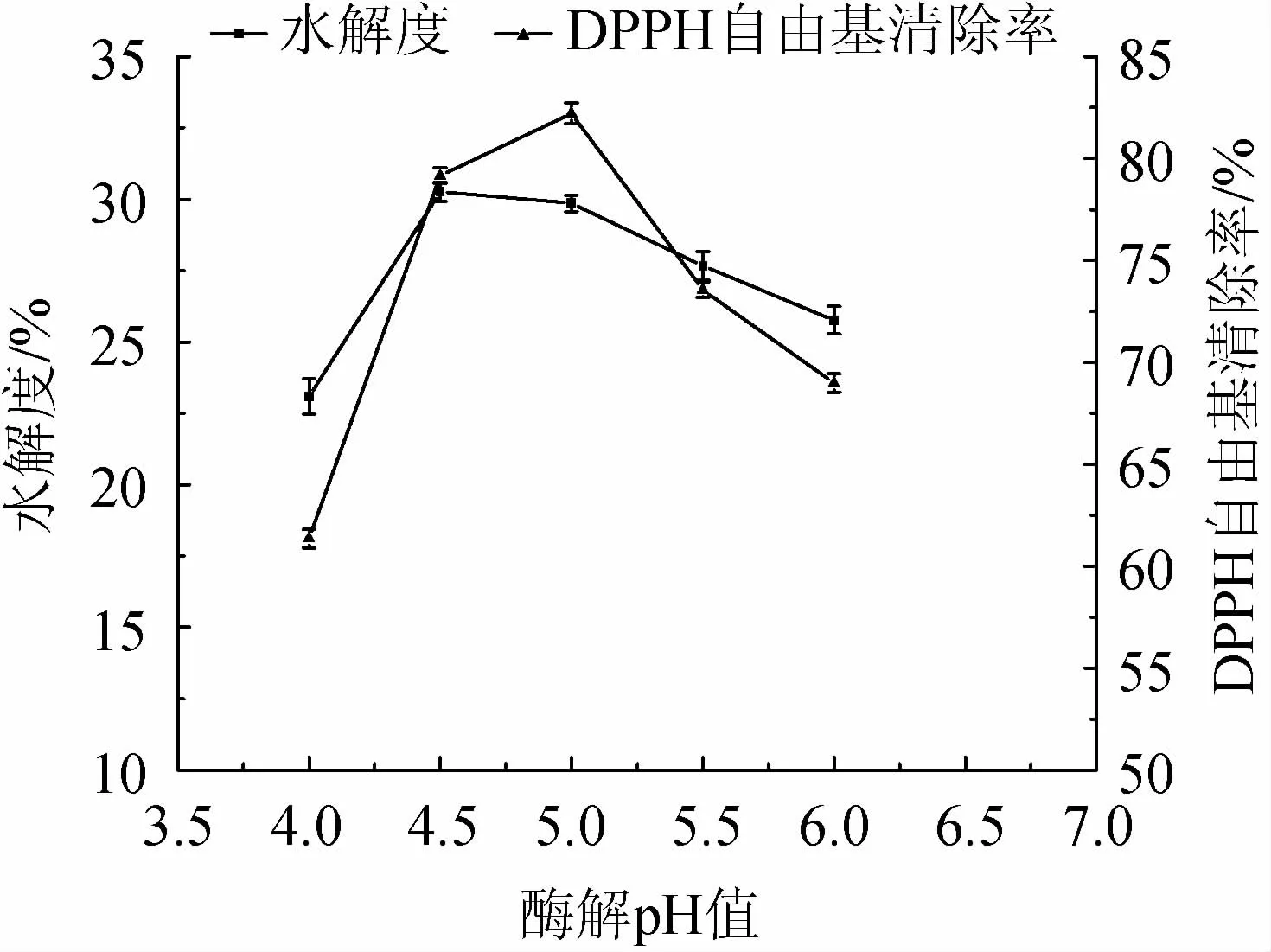
圖6 酶解pH值對水解度及DPPH自由基清除率的影響Fig.6 Effects of enzymolysis pH on hydrolysis degree and DPPH free radical scavenging rate
2.3 酶解條件優化響應面試驗
2.3.1 響應面試驗設計結果與方差分析
在單因素試驗結果的基礎上,固定食用菌水解酶A1添加量為0.15%,以底物質量分數(A)、酶解溫度(B)、酶解時間(C)、酶解pH值(D)為自變量,以DPPH自由基清除率(Y)為響應值,進行4因素3水平的響應面試驗設計,酶解條件優化響應面試驗設計及結果見表5,回歸模型的方差分析見表6。

表5 酶解條件優化響應面試驗設計及結果Table 5 Design and results of response surface tests for enzymatic hydrolysis conditions optimization
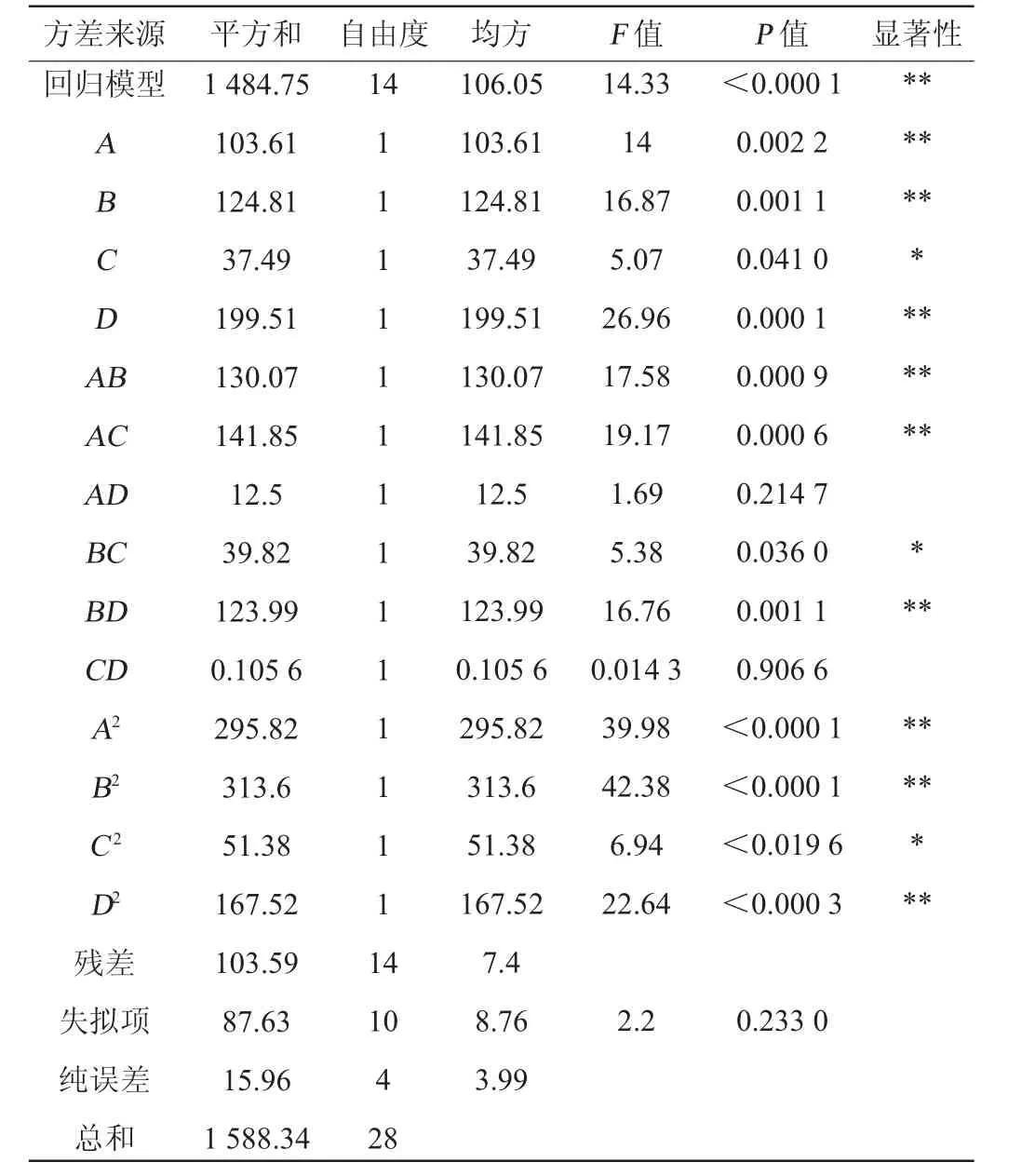
表6 回歸模型方差分析Table 6 Analysis of variance of regression model
利用Design-Expert 13.0響應面軟件對表5數據進行模型的方差和顯著性分析,得到以DPPH·清除率為響應值,食用菌水解酶酶解羊肚菌蛋白制備抗氧化肽的二次多項式回歸方程為:
由表6可知,響應面模型P值<0.000 1,說明該回歸方程模型達極顯著水平,失擬項不顯著(P值=0.233>0.05),說明回歸模型的實測值與擬合值擬合程度較好。模型的決定系數R2=0.942 1,調整決定系數R2Adj=0.884 3,表明該模型可以解釋88.43%食用菌水解酶A1酶解羊肚菌蛋白制備抗氧化肽DPPH自由基清除率的變化。由P值可知,一次項A、B、D,交互項AB、AC、BD,二次項A2、B2、D2對結果影響極顯著(P<0.01);一次項C、交互項BC、二次項C2對結果影響顯著(P<0.05);其他項對結果影響不顯著(P>0.05)。由F值可知,對水解羊肚菌蛋白制備抗氧化肽的影響強弱順序為酶解pH值>酶解溫度>底物質量分數>酶解時間。
2.3.2 響應面分析
食用菌水解酶A1水解羊肚菌蛋白制備抗氧化肽的響應面見圖7。
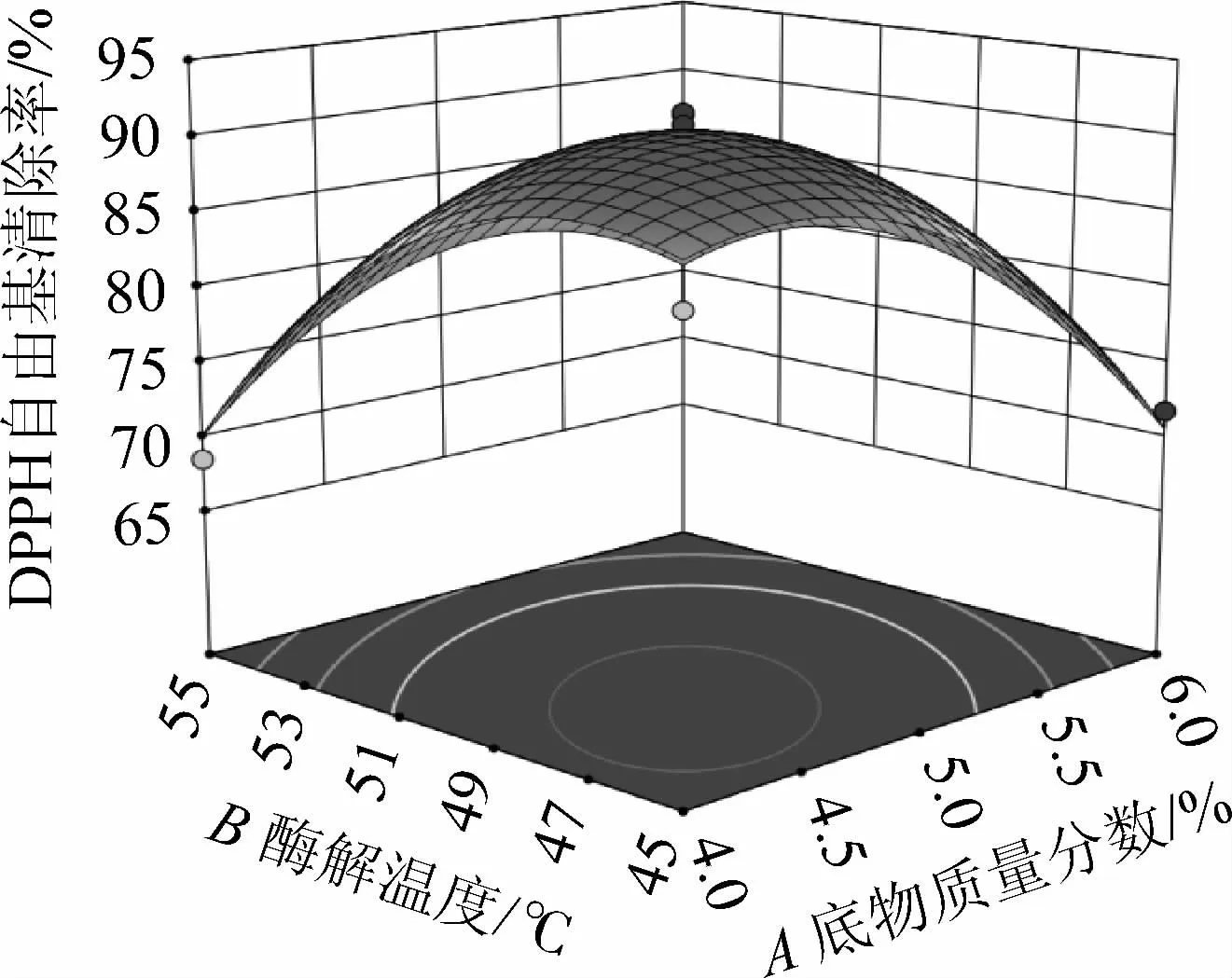
圖7 各因素間交互作用對DPPH自由基清除率影響的響應曲面及等高線Fig.7 Response surface plots and contour lines of effect of interaction between various factors on DPPH free radical scavenging rate
由圖7可知,各因素的交互作用中,AB、AC、BC、BD的等高線為橢圓形,表明兩兩之間的交互作用顯著(P<0.05),這與方差分析結果一致。
2.3.3 最佳酶解條件的確定與驗證
固定食用菌水解酶A1添加量為0.15%,利用Design-Expert V13.0軟件對食用菌水解酶A1酶解羊肚菌蛋白制備抗氧化肽的工藝進行優化預測,得到最佳酶解工藝條件為底物質量分數4.793%、酶解溫度49.021 ℃、酶解時間115.703 min、酶解pH值4.36。在上述酶解工藝條件下,食用菌水解酶復合酶酶解羊肚菌蛋白抗氧化肽的DPPH·清除率預測值為91.91%。
為驗證預測工藝條件,結合實際操作,將上述預測優化工藝條件修正為底物質量分數4.80%、酶解溫度49.00 ℃、酶解時間116 min、酶解pH 4.4,并進行3次驗證試驗,得到酶解羊肚菌蛋白抗氧化肽的DPPH·平均清除率實際值為91.94%,接近預測值,表明該模型可用于食用菌水解酶酶解羊肚菌蛋白制備抗氧化肽工藝的預測。
2.4 體外抗氧化分析
抗氧化活性研究發現,羊肚菌蛋白抗氧化肽對DPPH·、·OH及·O2-清除率分別為(91.34±0.49)%、(85.04±0.59)%及(63.90±0.63)%,表明羊肚菌蛋白抗氧化肽具有一定的抗氧化作用。
2.5 抗運動疲勞活性分析
2.5.1 羊肚菌蛋白抗氧化肽對小鼠力竭游泳時間、爬桿時間、耐缺氧時間的影響
由表7可知,與空白對照組相比,經過對小鼠灌胃羊肚菌蛋白抗氧化肽后的低、中、高劑量組,各項運動指標均發生明顯變化,力竭游泳時間、爬桿時間、耐缺氧時間均顯著提升(P<0.05)。隨著劑量濃度的增加,力竭游泳時間由對照組的(16.62±0.40)min提高到高劑量組的(32.29±0.39)min,游泳時間提高將近1倍。小鼠在高劑量組的灌胃下,其爬桿時間、耐缺氧時間較空白組也延長了1.56倍和0.87倍,并表現出劑量-量效關系。結果表明,羊肚菌蛋白抗氧化肽在增強小鼠運動能力方面,具有提高小鼠運動耐力和抗疲勞的效果。
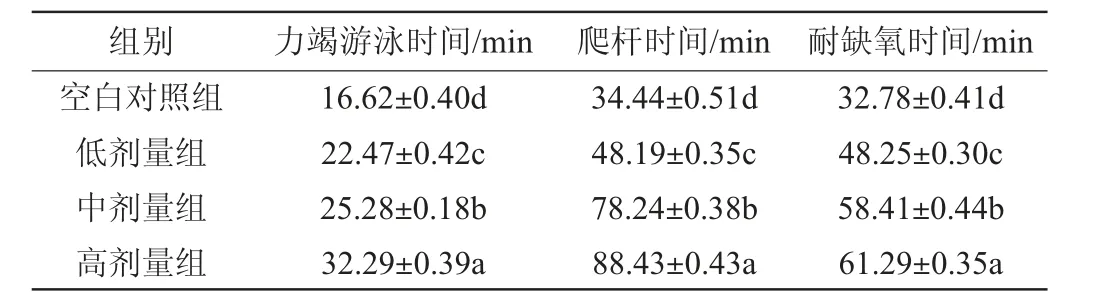
表7 羊肚菌蛋白抗氧化肽對小鼠力竭游泳、爬桿、耐缺氧時間的影響Table 7 Effect of Morchella esculenta protein antioxidant peptides on exhausted swimming, pole climbing and hypoxia tolerance time of mice
2.5.2 羊肚菌蛋白抗氧化肽對小鼠生化指標的影響
由表8可知,與空白組相比,對灌胃羊肚菌蛋白抗氧化肽的小鼠,其各項生化指標得到顯著提高(P<0.05)。隨著灌胃劑量濃度的增加,小鼠體內的血清尿素氮、血乳酸、肌糖原、肝糖原等含量也有明顯變化。其中,灌胃高劑量組羊肚菌蛋白抗氧化肽液的小鼠體內血清尿素氮含量由空白對照組(12.56±0.45)mmol/L降低到(10.26±0.08)mmol/L;血乳酸含量由對照組(8.32±0.12)mmol/L降低到(5.39±0.23)mmol/L,降低了35.21%。糖原是體內儲存能量的主要形式之一,能夠與糖在機體內進行轉化作用,肌糖原通過無氧酵解的途徑直接將能量供給肌肉組織,進而為機體提高能量,緩解機體的疲乏[34],肝糖原分解是血糖維持穩定的重要保障[35]。灌胃低、中、高劑量組的羊肚菌蛋白抗氧化肽液后,小鼠體內的肝糖原和肌糖原含量明顯提高。說明灌胃羊肚菌蛋白抗氧化肽液后,能提高小鼠體內的肝糖原和肌糖原含量,并降低小鼠體內的血清中尿素氮、血乳酸含量,進而呈現較好的抗運動疲勞活性。

表8 羊肚菌蛋白抗氧化肽對小鼠生化指標的影響Table 8 Effect of Morchella esculenta protein antioxidant peptides on biochemical indexes of mice
2.6 羊肚菌抗氧化多肽的抗氧化與抗疲勞作用的關系
以小鼠力竭游泳時間(X)為橫坐標,SOD活力(Y)為縱坐標,進行羊肚菌抗氧化與抗疲勞活性的線性相關分析,得到線性方程為Y=0.050 7X+12.674,相關系數R2=0.948 7。表明在一定范圍內,羊肚菌蛋白抗氧化肽的小鼠力竭游泳時間與肝臟SOD活力有一定的相關性,說明羊肚菌蛋白抗氧化肽的抗氧化與抗疲勞作用具有相關性。
3 結論
本研究利用單酶對羊肚菌蛋白進行最優酶的篩選,得到較優水解酶為食用菌水解酶A1,制備羊肚菌蛋白抗氧化肽最佳工藝條件為食用菌水解酶A1添加量0.15%、底物質量分數4.80%、酶解溫度49.00 ℃、酶解時間116 min、酶解pH 4.4,對DPPH·的清除率為91.94%。體外抗氧化實驗結果表明,羊肚菌多肽具有一定的抗氧化作用對DPPH·、·OH和·O2-的清除率分別為91.34%、85.04%、63.90%。抗運動疲勞活性實驗結果表明,羊肚菌蛋白抗氧化肽可降低血清尿素氮、血乳酸含量,提高肝糖原和肌糖原的儲備,進而提高小鼠的運動耐力,表明羊肚菌蛋白抗氧化肽具有一定的抗運動疲勞的作用和功效,這為羊肚菌蛋白進行深加工開發提供了研究方向和理論依據。

