巴彥淖爾酸粥細菌菌群多樣性分析及其與風味的相關性
熊子康,張 青,鄒 銓,孔祥聰,馬佳佳,王玉榮*
(1.湖北文理學院 食品科學技術學院 湖北省食品配料工程技術研究中心,湖北 襄陽 441053;2.湖北文理學院 食品科學技術學院 乳酸菌生物技術與工程襄陽市重點實驗室,湖北 襄陽 441053;3.河套學院 農學系,內蒙古 巴彥淖爾 015000)
酸粥一般以小米、大米或糜米等谷物為原料經自然發酵制成的極具地方特色的谷物發酵制品,口感酸爽細膩,具有開胃助消化的功效,在內蒙古、廣西、山西和陜西等地較為常見[1-3]。谷物在發酵過程中會改變自身原有的形態、風味以及營養結構,并產生氨基酸、維生素和有機酸等豐富的營養物質,從而使其更易于消化[4-6]。為保證其品質及食用方便性,多地嘗試將其開發成商業化產品,然而,目前酸粥的生產仍主要依賴于家庭作坊式制作[7]。該模式一般采用自然發酵,由于受到地域、氣候等的影響,不同地區生產的產品所包含的微生物多樣性不同[8];此外,發酵過程使用的容器多不密封且不能人為控制溫度,發酵料液內部微生物群亦需較長時間才能達到平衡,增大了有害微生物侵襲的可能性[9]。巴彥淖爾或稱“巴盟”,屬內蒙古自治區,該地區發酵酸粥所用原料一般為糜米,制作工藝主要為糜米加水蒸煮,在米粒完全煮透前取適量米湯放涼,置于桶內或玻璃罐中,自然發酵24~30 h即可。每次將發酵好的酸粥預留一部分作為下一次發酵的“引子”,因而明確該地區傳統發酵食品酸粥樣品中微生物資源構成極其重要。
越來越多的學者認識到微生物的多樣性與食品中各種風味之間存在著重要聯系。自21世紀以來,以Illumina MiSeq為代表的第二代高通量測序技術因其準確率高、通量高和速度快等優點使其在食品微生物多樣性研究領域得以廣泛應用[10-11]。電子鼻技術是一種用來檢測揮發性風味物質的技術手段,具有實時、無損和快速等特點[12]。電子舌技術是一種用來檢測滋味的技術手段,具有客觀性強、檢測響應快和標準化控制等特點[13]。向凡舒等[14]基于該技術解析了利川腌菜細菌群落結構,并采用電子鼻技術研究腌菜的風味品質,結果表明,腌菜特征風味物質的形成可能由變形桿菌屬(Proteus)、嗜冷桿菌屬(Psychrobacter)和腸球菌屬(Enterococcus)等多種微生物共同作用產生;CAI W C等[15]利用高通量測序技術和電子感官技術綜合評估了3種低溫大曲的微生物結構、微生物功能和風味特征,結果表明,低溫大曲中高溫放線菌屬(Thermoactinomyces)、芽孢桿菌屬(Bacillus)、糖多孢菌屬(Saccharopolyspora)、鏈霉菌屬(Streptomyces)和乳桿菌屬(Lactobacillus)主要影響低溫大曲的滋味,而嗜熱子囊菌屬(Thermoascus)和復膜孢酵母屬(Saccharomycopsis)主要影響其風味。張青等[16]利用高通量測序技術研究了巴彥淖爾酸粥細菌構成,發現乳桿菌屬(Lactobacillus)和醋桿菌屬(Acetobacter)為其優勢細菌屬,表明該方法應用于酸粥類谷物發酵食品可行且地域因素對同類型發酵食品微生物組成存在一定影響,因此有必要對巴彥淖爾酸粥品質或微生物與產品品質之間的關聯性開展深入研究。
本研究使用高通量測序技術對巴彥淖爾酸粥進行細菌群落結構解析,同時結合電子鼻和電子舌仿生學技術對其氣味和滋味品質進行分析,并對優勢細菌屬與風味品質之間的相關性進行研究,為酸粥菌株發掘和品質提升提供理論依據。
1 材料與方法
1.1 材料與試劑
酸粥:于2021年6月中旬采集自內蒙古自治區中西部巴彥淖爾市(E105°12′~109°53′,N40°13′~42°28′),共7份樣品,編號為BM1~BM7。
DNeasy mericon Food Kit 脫氧核糖核酸(deoxyribonucleic acid,DNA)基因組提取試劑盒:德國QIAGEN公司;引物338F/806R:由武漢天一輝遠生物科技有限公司合成;5×TransStartTMFastPfu Buffer、脫氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTPs)Mix和FastPfu Fly DNA聚合酶:北京全式金生物技術有限公司;參比溶液、陰離子溶液、陽離子溶液和內部溶液:日本Insent公司。
1.2 儀器與設備
MiSeq PE300高通量測序平臺:美國Illumina公司;Nanodrop2000紫外可見分光光度計:美國Nano Drop公司;Veriti FAST梯度聚合酶鏈式反應(polymerase chain reaction,PCR)儀:美國ABI公司;UVPCDS8000凝膠成像分析系統:美國ProteinSimple公司;PEN3電子鼻(配置10個金屬氧化傳感器):德國Airsense公司;SA 402B電子舌:日本Insent公司。
1.3 實驗方法
1.3.1 MiSeq高通量測序
將酸粥樣品振蕩均勻,使用DNeasy mericon Food Kit DNA基因組提取試劑盒從酸粥樣品中提取細菌基因組DNA,并采用Nanodrop 2000紫外可見分光光度法測量其濃度和質量,將條帶清晰且OD260nm/OD280nm值介于1.8~2.0之間的DNA進行細菌16S rRNA V3-V4區的PCR擴增,其中正向引物為338F(5'-ACTCCTACGGGAGCAGCAG-3'),反向引物為806R(5'-GGACTACHVGGGTWTCTAAT-3'),參照WANG Y R等[17]的PCR擴增體系及PCR擴增程序進行擴增,擴增后使用1%的瓊脂糖凝膠電泳(120 V,30 min)進行檢測,將檢測合格的擴增產物寄送至上海美吉生物有限公司使用Illumina MiSeq測序儀完成雙末端測序。
1.3.2 生物信息學分析
根據GUO Z等[18]的序列質控條件進行質控以獲得高質量序列:根據雙端序列的重疊關系首先對下機序列進行合并、去除嵌合體以及采用兩步UCLUST法構建操作分類單元(operational taxonomic units,OTU),通過Greengenes v13.5、核糖體數據庫項目(ribosomal database project,RDP)v11.5和SILVA v132數據庫對每個OTU進行同源性比對注釋和微生物多樣性解析[19]。
1.3.3 基于電子鼻技術對酸粥樣品氣味的測定
采用電子鼻對酸粥樣品的氣味進行測定。將酸粥樣品搖勻,吸取15 mL樣品于電子鼻樣品瓶中,45 ℃水浴保溫30 min,于室溫靜置15 min后進行測試,并重復3次。按照RUSINEK R等[20]的方法,選取49 s、50 s和51 s時的響應值為數據點,并求其平均值為最終結果。其中,電子鼻配置的10個傳感器分別為W1C(芳香型化合物)、W5S(氮氧化合物)、W3C(芳香型化合物)、W6S(對氫氣有選擇性)、W5C(烷烴芳香成分)、W1S(甲烷)、W1W(有機硫化物和萜烯類)、W2S(乙醇)、W2W(有機硫化物)和W3S(烷烴類)。
1.3.4 基于電子舌技術對酸粥樣品滋味的測定
采用電子舌對酸粥樣品的滋味進行測定。將酸粥樣品8 000 r/min 離心15 min后,取上清液于樣品瓶中,4 ℃備用。按照GAO B H等[21]的方法對樣品中5個基本味(酸、苦、澀、咸、鮮)和3個回味(苦味、澀味和鮮味的回味)進行測定,重復測定4次,選取后3次有效數據并求取平均值作為最終結果。
1.3.5 數據處理
使用Origin 2017軟件對酸粥樣品中優勢細菌門、屬以及核心OTU的相對含量和電子鼻、電子舌雷達圖進行分析,并對各樣品中OTU的出現次數進行水平階梯圖的繪制;使用R軟件的“vioplot”安裝包對樣品中各滋味品質的響應值進行小提琴圖繪制;使用Cytoscape軟件對酸粥中優勢細菌屬與各氣味、滋味指標之間相關系數絕對值>0.5的相關性進行網絡圖的繪制。
2 結果與分析
2.1 酸粥樣品的細菌菌群結構分析
以細菌16S rRNA V3-V4區為測序靶點,通過Illumina MiSeq高通量測序后7份酸粥樣品共產生了265 424條高質量序列,經兩步UCLUST分析,共得到1 633個OTU,序列分別隸屬于3個門、5個綱、10個目、16個科和24個屬。將平均相對含量≥1.00%的細菌門或屬歸為優勢細菌門或屬,相對含量<1.00%的細菌門或屬歸為其他。基于門水平的酸粥樣品中細菌菌群組成相對含量見圖1。
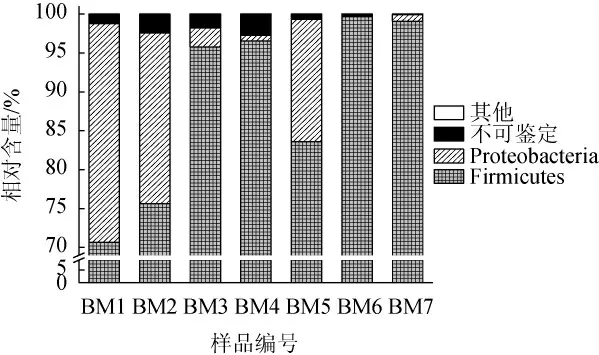
圖1 基于門水平的酸粥樣品中細菌菌群組成Fig.1 Bacterial community composition in sour porridge samples based on phylum level
由圖1可知,厚壁菌門(Firmicutes)和變形菌門(Proteobacteria)為酸粥樣品中的優勢細菌門,其平均相對含量分別為88.71%和9.97%,且各樣品中Firmicutes的相對含量均>70.00%,其中,樣品BM3、BM4、BM6和BM7中Firmicutes的相對含量較高,分別為95.79%、96.55%、99.65%和99.07%;不同樣品中Proteobacteria的相對含量有一定差異,其在樣品BM4、BM6和BM7中其相對含量均<1.00%,由此可見,不同樣品間細菌門組成存在一定的差異。本研究進一步在屬水平上對其細菌菌群組成進行解析,基于屬水平的酸粥樣品中細菌菌群的相對含量見圖2。
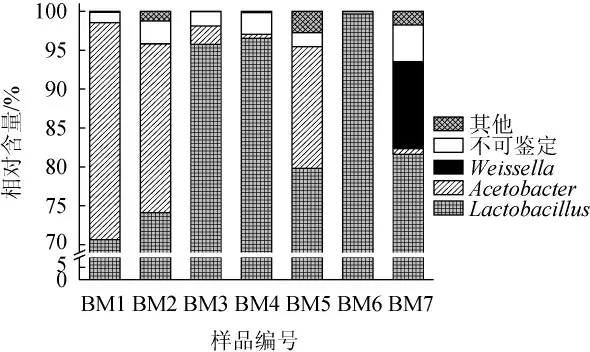
圖2 基于屬水平的酸粥樣品中細菌菌群組成Fig.2 Bacterial community composition in sour porridge samples based on genus level
由圖2可知,乳桿菌屬(Lactobacillus)、醋酸桿菌屬(Acetobacter)和魏斯氏菌屬(Weissella)為酸粥樣品中的優勢細菌屬,其平均相對含量分別為85.45%、9.81%和1.60%,且所有樣品中Acetobacter和Weissella的相對含量均存在明顯差異。在樣品BM1、BM2和BM5中Acetobacter的相對含量均>15.0%,而在樣品BM4、BM6和BM7中相對含量均<1.0%;Weissella僅存在于樣品BM7中,其相對含量為11.19%。由此可見,同一地區不同酸粥樣品間其細菌屬組成亦存在一定的差異。Lactobacillus和Weissella均為乳酸菌屬,隸屬于厚壁菌門,可在密閉條件下快速生長繁殖,生成大量乳酸,在形成酸性無氧環境后,隨著好氧菌的死亡,進一步將碳水化合物轉化成乳酸、乙酸和丙酸等,以改善食品的風味并延長其保質期[22];此外,Weissella是兼性厭氧化學螯合菌,在食品發酵過程中,其可以合成酯類、有機酸和短鏈脂肪酸等風味物質,從而提高發酵食品的產品質量[23]。Acetobacter隸屬于Proteobacteria,可將乙醇和乳酸氧化為乙酸和乙酰丁酸[24]。說明酸粥樣品中存在絕對優勢的產酸菌,該研究結果與張青等[16]所分析基于門、屬水平的酸粥樣品中細菌菌群的群落組成基本一致。
2.2 基于OTU水平的細菌群落結構分析
本研究在細菌門、屬水平解析酸粥樣品細菌菌群組成的基礎上,進一步分析7份酸粥樣品中OTU的出現次數及核心OTU(在所有樣品中均存在的OTU)的相對含量,結果見圖3。
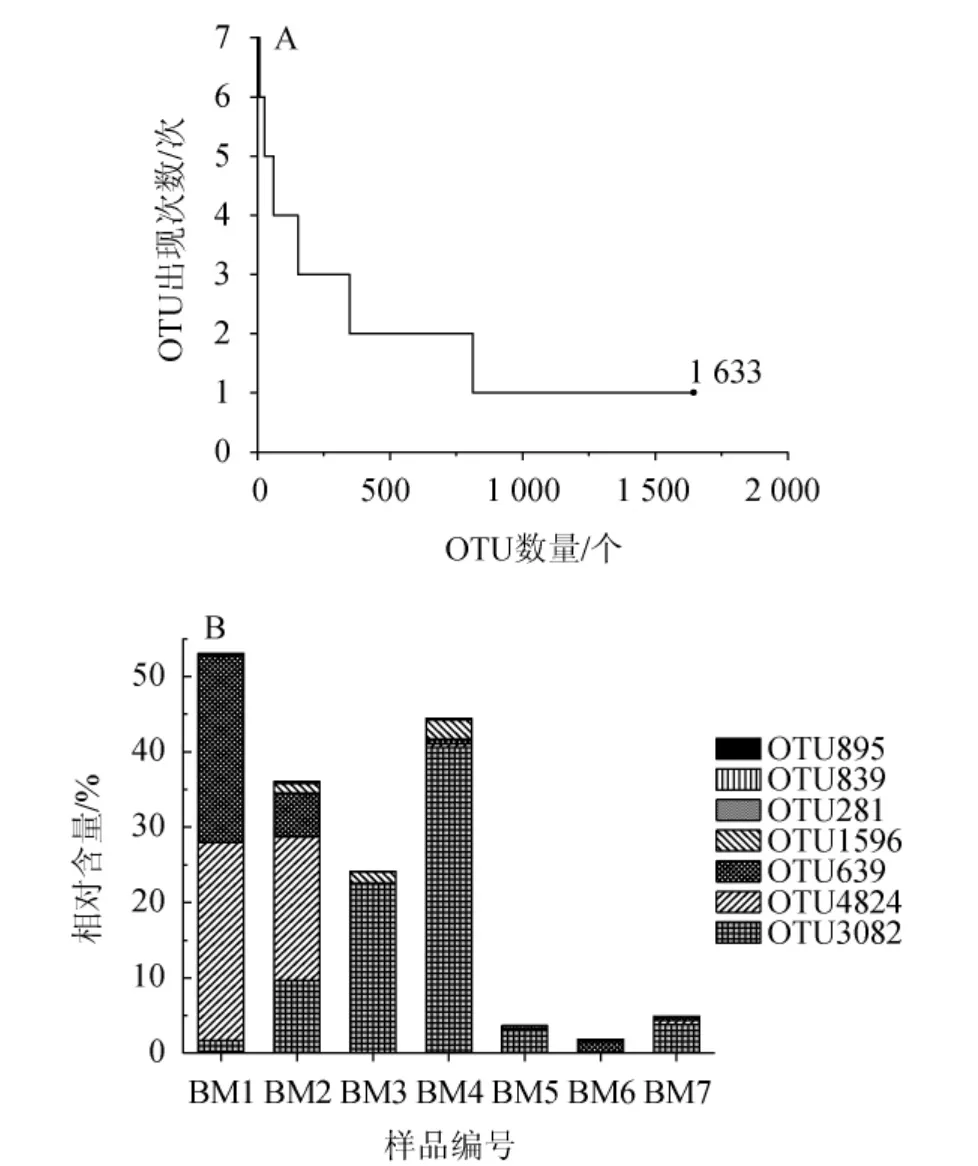
圖3 酸粥樣品中操作分類單元的出現次數(A)及核心操作分類單元相對含量(B)Fig.3 Occurrence times of operational taxonomic unit (A) and relative content of core operational taxonomic unit (B) in sour porridge samples
由圖3A可知,7份樣品中共產生了1 633個OTU,然而核心OTU(OTU3082、OTU4824、OTU639、OTU1596、OTU281、OTU839和OTU895)僅有7個,占OTU總數的0.43%,但其中包含了63 755條高質量序列,占質控后合格序列總數的24.02%;在樣品中出現1次的OTU有822個,占OTU總數的50.34%,其中包含13 297 條高質量序列,僅占質控合格序列總數的5.01%。由圖3B可知,OTU3082、OTU4824、OTU639、OTU1596、OTU281、OTU839和OTU895平均相對含量分別為11.63%、6.63%、4.78%、0.83%、0.09%、0.04%和0.03%。而平均相對含量>1.0%的核心OTU僅有3個,其中2個核心OTU隸屬于Lactobacillus,分別為OTU3082和OTU639;1個核心OTU隸屬于Acetobacter,為OTU4824。該結果進一步說明,在巴彥淖爾酸粥樣品中,Lactobacillus和Acetobacter為核心細菌屬。
2.3 酸粥樣品感官特性測定結果
2.3.1 基于電子鼻技術酸粥樣品的氣味檢測結果
本研究進一步采用電子鼻測定酸粥樣品氣味,電子鼻響應雷達圖見圖4。
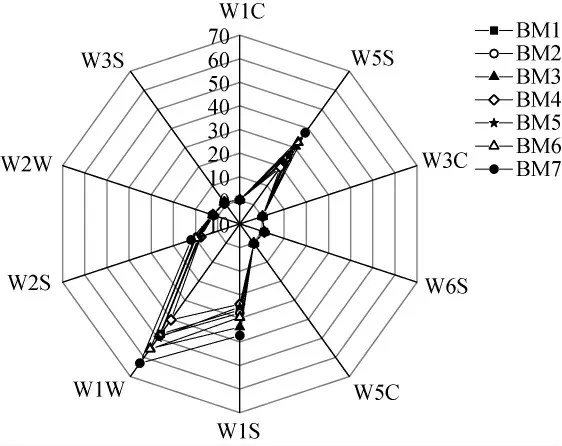
圖4 酸粥樣品氣味電子鼻傳感器響應雷達圖Fig.4 Response radar diagram of sour porridge samples ordor by electronic nose sensor
由圖4可知,納入本研究的酸粥樣品在不同傳感器上的響應強度不同,僅有W1W(有機硫化物和萜烯類)、W5S(氮氧化合物)和W1S(甲烷)這3個傳感器對酸粥響應強度較大,均>19,而其他7個傳感器對酸粥響應強度較小。其中W1W、W5S和W1S這3個傳感器對樣品BM7的響應強度均為最大,分別為63.02、37.75和37.31;對樣品BM4的相應強度均為最小,分別為40.27、19.63和24.03。為進一步探究各樣本間的氣味的異同,本研究對各傳感器所測數值進行處理,結果見表1。
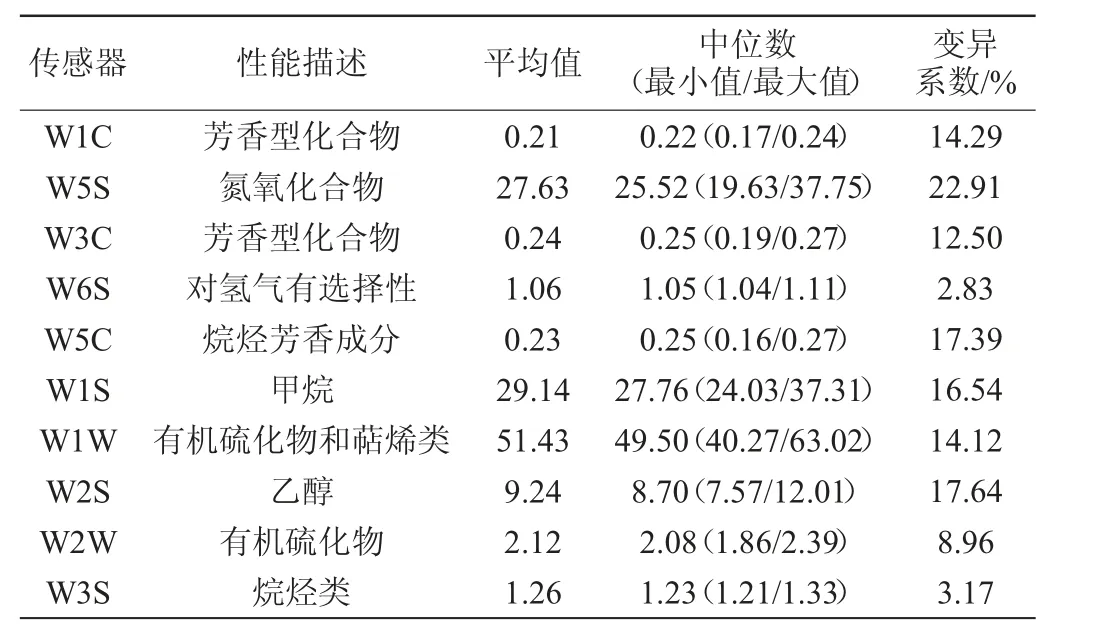
表1 電子鼻各傳感器對酸粥樣品氣味的響應強度Table 1 Response intensity of electronic nose sensors to the odor of sour porridge samples
由表1可知,巴彥淖爾酸粥在W1W、W5S和W1S這3個傳感器上的平均響應值分別為51.43、27.63和29.14。由此可見,酸粥揮發性風味物質中有機硫化物和萜烯類物質、氮氧化合物和甲烷的含量較為豐富。除W6S和W3S外,其他8個傳感器對酸粥樣品的響應值差異均較大,變異系數均>8.0%,由此可見,7份酸粥樣品在氣味方面存在較大差異。
2.3.2 基于電子舌技術對酸粥樣品滋味的檢測結果
酸粥樣品的電子舌檢測結果見圖5。由圖5A可知,酸粥樣品在酸味、咸味、鮮味的回味和鮮味指標上的差異較大。其中,樣品BM7在酸味指標上的響應值最大,為7.45;樣品BM3在酸味指標上的響應值最小,為-22.64,但其在鮮味指標上的響應值最大,為7.38;樣品BM4在咸味指標上的響應值最大,為12.21,其在鮮味的回味指標上的響應值亦最大,為9.05。由圖5B可知,酸粥在各滋味指標中差異最大的是酸味,極差值為28.37;其次是咸味、鮮味的回味、澀味和鮮味,極差值分別為14.01、10.96、9.18和8.43;而在澀味回味和苦的回味上的差異較小。Lactobacillus和Acetobacter作為酸粥中的優勢細菌屬,可以產生大量的有機酸來降低pH,從而增加酸度[21,25]。由此可知,酸粥樣品中滋味品質的差異主要是由酸味引起的。
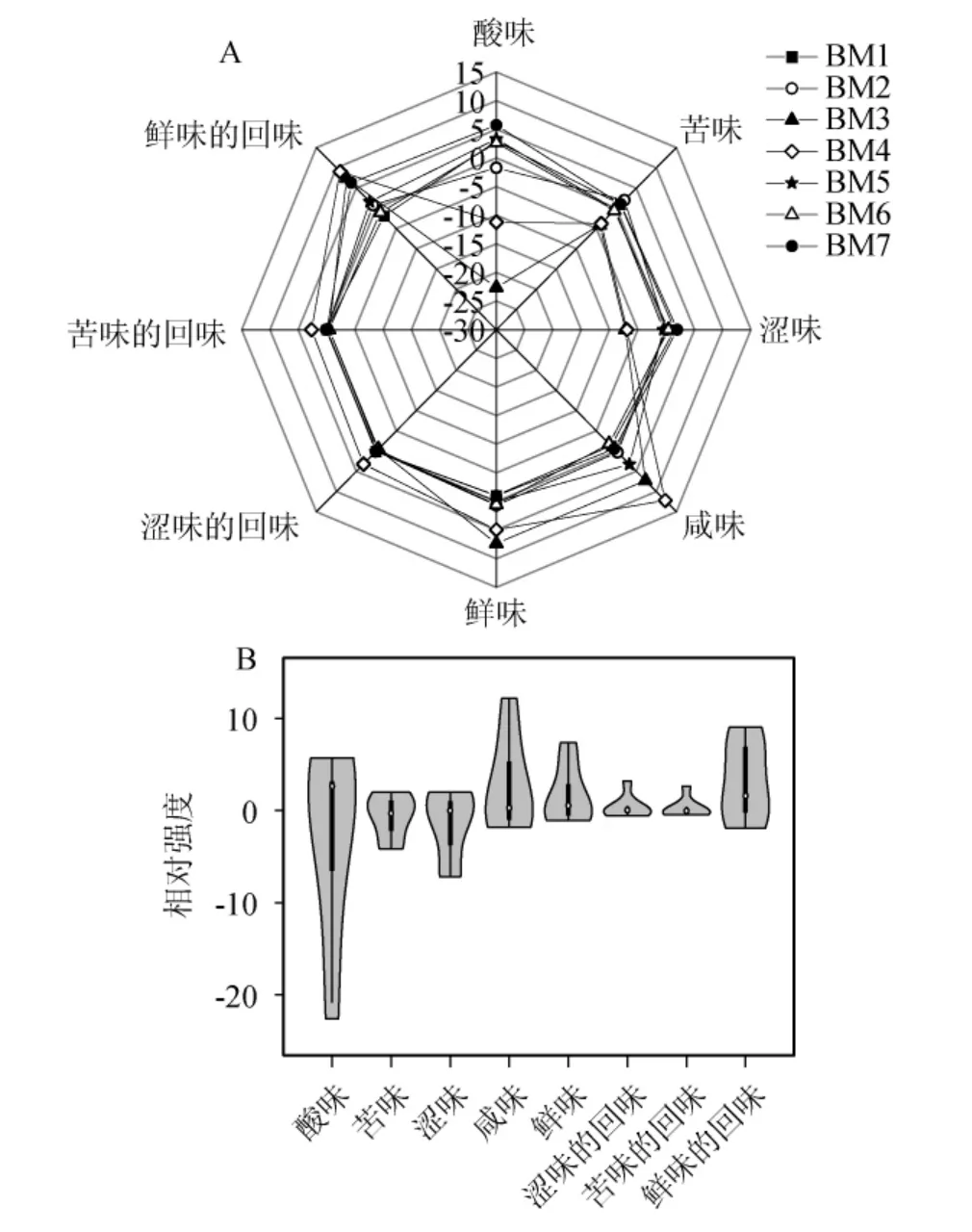
圖5 酸粥樣品滋味電子舌響應雷達圖(A)及小提琴圖(B)Fig.5 Response radar diagram (A) and violin diagram (B) of sour porridge samples taste by electronic tongue
2.4 優勢細菌屬與風味的相關性分析
酸粥樣品風味特征與其發酵菌群息息相關,為探究不同菌群對自然發酵酸粥滋味和氣味的影響,本研究對樣品中優勢細菌屬與氣味物質、滋味進行相關性分析,其相關性網絡圖見圖6。

圖6 酸粥樣品優勢細菌屬與氣味及滋味的相關性Fig.6 Correlation between dominant bacterial genera and odor and taste of sour porridge samples
由圖6可知,Weissella與酸粥的澀味呈現顯著負相關(P<0.05),相關系數R2=0.998;Acetobacter與芳香型化合物的生成呈極顯著正相關(P<0.01),相關系數R2=0.999,與苦的回味呈極顯著正相關(P<0.01),相關系數R2=0.999;Lactobacillus與氮氧化合物的生成呈現顯著正相關(P<0.05),相關系數R2=0.999,與乙醇類物質的生成呈極顯著負相關(P<0.01),相關系數R2=0.999。由此可見,Acetobacter和Lactobacillus對于酸粥中芳香類風味物質和氮氧化合物的形成有著積極的作用,Weissella對于酸粥中酸味的形成亦發揮著積極影響。
3 結論
巴彥淖爾自然發酵酸粥樣品的細菌菌群組成存在一定差異,優勢細菌門為Firmicutes和Proteobacteria,優勢細菌屬為Lactobacillus、Acetobacter和Weissella,所有樣品包含7個核心OTU。就氣味和滋味品質而言,其揮發性物質的差異主要集中在氮氧化合物、甲烷和萜類化合物上,而其滋味差異主要體現在酸味方面。經相關性分析得知,Acetobacter和Lactobacillus對酸粥芳香類風味物質和氮氧化合物的產生具有積極作用,Weissella對酸粥酸味的形成亦具有積極影響,在后續發酵酸粥工藝中,可進一步為其滋味品質的提升進行研究,完善酸粥風味和滋味品質的雙向促進,優化酸粥的生產工藝條件,提升工業化生產。

