足量潑尼松聯合環磷酰胺治療IgA腎病的療效及影響因素*
王夢平,孫健超,金暢,董建華,唐詩韻
(1.成都中醫藥大學附屬醫院腎病一科,成都 610072;2.成都市第八人民醫院心血管內科二病區,成都 610083;3.樂山市人民醫院腎病內科,樂山 614099;4.成都中醫藥大學附屬醫院GCP中心,成都 610072)
IgA腎病(IgA nephropathy,IgAN)是終末期腎病(end stage renal disease,ESRD)的重要病因之一[1]。2020年KDIGO指南推薦,IgAN患者經過優化支持治療后平均蛋白尿持續>1 g·d-1,可考慮糖皮質激素治療,而環磷酰胺只被推薦用于快速進展的IgAN。然而,近年研究發現IgAN患者時間平均蛋白尿水平高于0.5 g·d-1時,腎臟存活率顯著降低、疾病進展風險增加[2-3]。但免疫抑制治療往往伴隨著更多的藥物不良反應。因此,在IgAN中使用糖皮質激素和環磷酰胺的時機仍存在很大爭議,需要更多研究深入探討。
本研究回顧搜集成都中醫藥大學附屬醫院腎穿刺活檢證實的并使用足量潑尼松聯合環磷酰胺治療的IgAN患者,對其臨床數據進行分析,探討足量潑尼松聯合環磷酰胺治療IgAN的療效及其影響因素,為IgAN免疫抑制治療提供一定的臨床思路和證據。
1 資料與方法
1.1臨床資料 2018年1月—2020年1月在成都中醫藥大學附屬醫院腎內科經腎穿刺活檢和臨床確診蛋白尿的IgAN患者。納入標準:①依據臨床表現及病理結果確診為IgAN;②治療前尿蛋白定量>500 mg· d-1,eGFR>30 mL· min-1· (1.73 m2)-1,泌尿系彩超提示:雙腎無萎縮、腎皮質未變薄;③經鈉鹽限制(氯化鈉攝入量<3 g· d-1)、戒煙、適當鍛煉[每周至少150 min(如每周運動5 d、每次 30 min)中等強度(50%~70%最大心率,運動時有點費力,心跳和呼吸加快但不急促)的有氧運動]、強化降壓(<130/80 mmHg)、足量血管緊張素轉換酶抑制劑(angiotensin converting enzyme inhibitors,ACEI)或血管緊張素2受體拮抗劑(angiotensin receptor antagonist,ARB)類藥物治療3個月蛋白尿無緩解。排除標準:①合并心、腦、肺、肝等器官的嚴重疾病、精神疾病、腫瘤以及各種感染性疾病;②狼瘡性腎炎、過敏性紫癜、乙型肝炎病毒相關性腎炎等繼發性IgAN;③腎穿刺活檢標本光鏡下腎小球數<8個;④合并其他腎臟疾病:膜性腎病、微小病變型腎病、糖尿病腎病等;⑤曾經使用或正在使用糖皮質激素或免疫抑制劑,或本研究開始后使用了其他免疫抑制劑,如:硫唑嘌呤、嗎替麥考酚酯、環孢素 A等;⑥用藥不規范、資料不全或隨訪時間不足6個月;⑦合并病毒性肝炎(甲型、乙型、丙型、丁型、戊型),梅毒,人類免疫缺陷病毒感染,結核桿菌感染;⑧不能配合治療和隨訪;⑨藥物及(或)酒精濫用;⑩孕婦或哺乳期婦女。
1.2治療方法 所有入選患者治療方案:足量潑尼松+環磷酰胺(cyclophosphamide,CTX)。具體用法如下:潑尼松(浙江仙琚制藥股份有限公司,批準文號:國藥準字H33021207)用法:1 mg· kg-1· d-1,6:00—8:00早餐后0.5 h頓服,8周后每4周減量5 mg,直至5 mg· d-1維持半年后停藥。CTX(江蘇恒瑞醫藥股份有限公司廠家,批準文號:國藥準字H32020856)用法:靜脈輸液,每月1次,每次0.5~1.0 g· (m2)-1體表面積,6個月后若患者達到緩解標準可改為每3個月1次,累計劑量8 g,療程12個月。
1.3觀察指標 所有入組患者隨訪6個月。搜集患者的年齡、性別、病理資料特點,患者治療前和治療后6個月的血肌酐(serum creatinine,Scr)、血尿酸(uric acid,UA)、血清白蛋白(albumin,ALB)、收縮壓(systolic blood pressure,SBP)、舒張壓(diastolic blood pressure,DBP)、平均動脈壓(mean arterial pressure,MAP)、24 h尿蛋白定量、血鉀(K)、空腹血糖(fasting blood glucose,FBG)、總膽固醇(total cholesterd,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白膽固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白膽固醇(low-density lipoprotein cholesterol,LDL-C)、白細胞(white blood cells,WBC)、紅細胞(red blood cells,RBC)、血紅蛋白(hemoglobin,HB)、血小板(platelet,PLT),同時采用CKD-EPI公式估算腎小球濾過率(estimated glomerular filtration rate,eGFR),并記錄治療期間發生的不良反應。
1.4腎臟病理評定標準 由1名腎臟病理醫師及2名經過腎臟病理培訓的腎內科醫師分別進行盲法閱片,依據IgAN Lee氏分級系統對IgAN進行病理分級(表1)[4],并依據IgAN牛津分型方法詳細描述腎小球、腎小管、腎間質和新月體病變情況(表2)[5]。

表1 IgAN的病理組織學Lee氏分級

表2 IgAN牛津分型(MEST-C評分)
1.5療效判定標準 參照中國成人腎病綜合征免疫抑制治療專家共識[6]制定的療效標準:①完全緩解(complete remission,CR):24 h尿蛋白定量<0.3 g或尿蛋白/肌酐(uPCR)<300 mg· g-1,腎功能正常,人血白蛋白>35 g· L-1,尿蛋白定性陰性;②部分緩解(partial remission,PR):24 h尿蛋白定量>0.3 g,但<3.5 g;或uPCR在300~3 500 mg· g-1;且24 h尿蛋白定量比基線水平下降50%且腎功能穩定(血肌酐較基線水平上升<20%);③未緩解(no remission,NR):未達到完全緩解或部分緩解標準。緩解為完全緩解和部分緩解之和,總有效率(%)=(完全緩解+部分緩解)/總例數×100%。

2 結果
2.1治療前資料
2.1.1一般資料 共搜集患者33例,其中男13例,女20例,年齡(46.70±11.35)歲,SBP(140.45±22.77)mmHg、DBP(84.42±16.51)mmHg,MAP(103.10±17.62)mmHg,24 h尿蛋白定量1 667.70(6 601.60)mg· d-1,Scr:101.00(87.00)μmol· L-1,eGFR:68.37±19.70[mL· min-1· (1.73 m2)-1],UA(390.45±97.98)μmol· L-1,血鉀(4.32±0.60)mmol·L-1,FBG(5.07±0.81)mmol·L-1,TC(5.21±1.38)mmol·L-1,TG(2.36±1.40)mmol·L-1,HDL-C(1.50±0.32)mmol·L-1,LDL-C(2.50±0.90)mmol·L-1,WBC(7.36±2.14)×109· L-1,RBC(4.27±0.50)×1012· L-1,HB(127.27±18.40)g· L-1,PLT(221.76±57.90)×109· L-1,游離甲狀腺素(fT4)(15.45±3.46)pmol· L-1,游離三碘甲狀腺原氨酸(fT3)(4.49±1.21)pmol· L-1,促甲狀腺激素(thyroid stimulating hormone,TSH)(3.67±2.33) uIU·mL-1。
2.1.2病理資料 33例患者中,病理表現為局灶增生型21例(63.64%),增生硬化型10例(30.30%),系膜增生伴新月體形成型及系膜增生型各1例(3.03%);其中Lee氏分級3級的患者22例(66.67%),Lee氏分級4級的患者11例(33.33%);M1患者33例(100.00%);E0患者19例(57.58%),E1患者14例(42.42%);S0患者20例(60.61%),S1患者13例(39.39%);T0患者19例(57.58%),T1患者11例(33.33%),T2患者3例(9.10%);C0患者14例(42.42%),C1患者15例(45.45%),C2患者4例(12.12%)。
2.2聯合治療的療效 完全緩解10例(30.30%),部分緩解11例(33.33%),未緩解12例(32.36%),總緩解21例(63.64%)。血肌酐升高超過基礎值30%的患者7例(21.21%),血肌酐倍增3例(9.09%),eGFR下降超過基礎值30%的患者6例(18.18%),進入終末期腎病患者1例(3.03%),死亡0例。
2.3緩解組和未緩解組治療前資料比較 根據病情緩解情況將患者分為緩解組(21例,63.64%)和未緩解組(12例,32.36%),比較兩組患者性別、年齡、病理資料,以及治療前收縮壓、舒張壓、平均動脈壓、24 h尿蛋白定量、血肌酐、eGFR、病理特點、血尿酸、血鉀、空腹血糖、血脂、白細胞、血紅蛋白、血小板等情況。結果顯示,緩解組與未緩解組比較,兩組的年齡、治療前24 h尿蛋白定量、Lee氏分級、E、T、C差異有統計學意義(P<0.05),見表3。
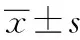
表3 緩解組和未緩解組各指標比較結果
依據牛津分型將所有患者分為T0組、T1組、T2組,比較各組緩解率,結果提示,T0組、T1組、T2組的緩解率不全相同(P<0.05);組間比較結果顯示,T1組緩解率低于T0組(P<0.05),T2組緩解率低于T0組和T1組(P<0.05),見表4。

表4 不同T評分患者的緩解率比較結果
對不同C評分患者的緩解率進行比較,結果提示,C0、C1、C2的緩解率不全相同(P<0.05);組間比較結果顯示,C1組緩解率與C0組比較差異無統計學意義,C2組緩解率低于C0組和C1組(P<0.05),見表5。

表5 不同C評分緩解率比較結果
2.4不良反應 隨訪6個月,治療過程中血糖升高、肝功能不全各1例(3.03%),尿路感染、惡心嘔吐各2例(6.06%);未見其他不良反應。
3 討論
IgAN是導致ESRD的重要病因之一。指南建議,對于蛋白尿超過1 g· d-1且eGFR高于50 mL· min-1· (1.73 m2)-1的患者,在支持治療的基礎上應使用全身糖皮質激素[7]。因此許多傳統的免疫抑制劑已在IgAN中試用,包括皮質類固醇、環磷酰胺、硫唑嘌呤和霉酚酸酯等。但IgAN的免疫抑制治療仍存在極大爭議[8-9]。TESTING試驗結果提示,相對較高的皮質類固醇劑量有潛在的腎臟獲益,然而這可能導致不良事件發生率顯著增加[10]。STOP-IgAN試驗結果表明,與單純支持治療相比,激素聯合環磷酰胺治療有更高的臨床緩解率,但明顯增加了糖代謝紊亂、體質量增加和感染的風險[11]。RAUEN等[12]的研究亦證明免疫抑制治療相對于單純支持治療無明顯優勢。本研究結果顯示,腎穿刺活檢確診且尿蛋白持續>500 mg· d-1的IgAN患者中,足量潑尼松聯合環磷酰胺治療具有較好療效,但對腎功能的保護有限,且治療過程中出現血糖升高、肝功能不全、尿路感染、惡心嘔吐。由此推斷,足量激素聯合環磷酰胺沖擊治療IgAN有較好療效,但應根據個體情況謹慎評估使用的獲益和風險,并嚴密觀察不良反應。
本研究結果顯示,未緩解組平均年齡明顯高于緩解組,由此推測年齡越大可能是激素聯合環磷酰胺沖擊治療效果欠佳和腎臟不良預后的危險因素,但這種結果亦有可能是年齡大的患者對激素和環磷酰胺的耐受力更差、副作用更多有關。近期有研究發現,年齡是IgAN進展至ESRD的預測因素[13-14]。BARBOUR等[15]最近研發出一種IgAN的風險預測模型,該預測模型納入了年齡作為IgAN的風險預測因子,這種經過驗證的模型在臨床試驗募集和個體患者指導上具有很廣的適用性。然而,WEN等[16]將981例原發性IgAN患者根據年齡分為青年組(14~29歲)、中年組(30~49歲)、老年組(≥50歲),發現3組的累積腎臟存活率差異無統計學意義,年齡不是不良預后的獨立預測因子。這與本研究結果不一致,分析其原因可能為該研究中老年組的定義比較年輕有關。綜上所述,免疫抑制治療IgAN時仍需考慮年齡對療效的影響。
越來越多的研究發現,蛋白尿與IgAN預后密切相關[14,17]。CHEN等[18]對506例24 h尿蛋白定量<1 g· d-1、eGFR≥60 mL· min-1· (1.73 m2)-1、未使用免疫抑制治療的原發性IgAN患者進行數據分析后發現,蛋白尿>0.5 g· d-1是腎臟不良結局的獨立危險因素。BARBOUR等[19]對OXFORD DERIVATION(n=265)、NORTH AMERICAN VALIDATION(n=187)和VALIGA(n=1 147)研究行事后分析發現,蛋白尿≥1 g· d-1、M1和T1/T2的患者進展至ESRD或血肌酐下降50%的風險最大,反之則患者進展至ESRD或腎功能下降50%風險最小。本研究結果顯示,緩解組的24 h尿蛋白定量明顯低于未緩解組,這與既往研究結果一致,提示尿蛋白定量是腎臟不良預后的預測因素。但既往評估尿蛋白與腎臟預后關系的研究對象多為未使用糖皮質激素及免疫抑制劑患者,本研究結果進一步證實,即使是在使用糖皮質激素聯合免疫抑制劑的情況下,尿蛋白仍然是腎臟不良預后的預測因子。
Lee氏分級簡單實用,是目前廣泛應用的IgAN分級系統,大量研究證實Lee氏分級可預測腎臟存活率,Lee分級越高,腎臟存活率越低。任慧敏等[20]隨訪185例原發性IgAN患者12個月后發現Lee氏Ⅳ、Ⅴ級的腎臟累積生存率較Ⅰ、Ⅱ、Ⅲ級低。趙春梅等[21]隨訪68例IgAN患者72個月發現Lee氏分級Ⅳ或Ⅴ級是腎功能惡化進展的獨立危險因素。本研究結果顯示,Lee氏Ⅲ級患者的緩解率明顯高于Ⅳ級的患者,這與既往研究結果一致,由此推測在足量潑尼松聯合環磷酰胺治療的患者中Lee氏分級仍可很好的預測療效,臨床應用免疫抑制治療IgAN前應考慮Lee氏分級程度。
最初牛津隊列研究提示,在未使用糖皮質激素或免疫抑制劑治療的IgAN患者中,腎小球內皮細胞增生是IgAN預后不良的預測因子;但在后來使用糖皮質激素或免疫抑制劑的大多數研究中結果顯示內皮細胞增生不能預測不良預后[22]。本研究結果提示E1患者緩解率明顯高于E0患者,提示內皮細胞增生對足量潑尼松聯合環磷酰胺治療具有良好應答,這與既往研究結果一致。然而,有利于內皮增生病變進行免疫抑制治療的證據是間接的,應僅作為產生該推理的證據。理想情況下,應將腎小球內皮細胞增生的患者隨機分配至免疫抑制治療組與支持治療組,對比兩種治療方法的療效;但這具有極高的挑戰性,因為盡管現有證據有限,但現在強調需要通過免疫抑制治療E病變的觀點越來越多。
HAAS等[23]研究發現腎小管萎縮或腎間質纖維化可獨立預測eGFR下降和低腎存活率,在eGFR<30 mL· min-1· (1.73 m2)-1的患者中,T1-T2與低腎臟存活率相關。COPPO等[24]研究結果顯示,T1/T2評分是腎臟聯合終點(ESRD或eGFR下降50%)的獨立預測因子,而這種預測價值在接受免疫抑制劑的患者中仍存在。本研究結果顯示,在足量潑尼松聯合環磷酰胺治療的患者中,T1組緩解率顯著低于T0組(P<0.05),T2組緩解率顯著低于T1組和T0組(P<0.05),提示腎小管萎縮或腎間質纖維化對免疫抑制治療的應答差,當患者T指數較高時應慎重選擇免疫抑制劑治療。
牛津分類的最新修訂版建議在 MEST-C評分中加入C(新月體)參數[25]。一項納入3 096例受試者的研究提示,新月體可以預測IgAN進展風險,C1在未進行免疫抑制治療時不良預后的風險顯著增加,但對免疫抑制治療有良好應答,C2患者無論是否使用免疫抑制治療都會導致不良預后風險增加[23]。本研究結果顯示C0組與C1組緩解率差異無統計學意義,C2組緩解率明顯低于C0和C1組,提示足量潑尼松聯合環磷酰胺治療對C1具有良好效果;但對C2患者療效不佳;這與HAAS等[23]的研究結果不謀而合。由此推測,IgAN中,表現為C1的患者或許應積極使用足量激素聯合環磷酰胺治療,而表現為C2的患者往往腎功能損害較重、預后不佳,選擇免疫抑制治療前應仔細權衡利弊。
綜上所述,足量潑尼松聯合環磷酰胺治療IgAN療效顯著;年齡越大、24 h尿蛋白定量水平越高、毛細血管內細胞增生越明顯、腎小管萎縮或腎間質纖維化程度越嚴重、新月體越多,緩解率越低;E1、C1對糖皮質激素聯合環磷酰胺靜脈沖擊治療具有良好應答。本研究的不足之處:①樣本量較小,導致未能進行回歸分析、病理表現不齊全、不良反應較少;②隨訪時間較短,不能預測遠期腎臟預后;③未行腎臟ECT檢查,僅根據CKD-EPI公式估算eGFR可能導致腎小球濾過率欠精準;④雖然所有納入本研究的患者均反復進行了飲食宣教,告知患者嚴格低鹽低脂優質低蛋白飲食,但未檢測尿鈉以評估患者真實低鹽飲食情況。

