2016—2020年寧波市某醫院血培養病原菌分布與耐藥性研究
詹琳,郭飛,谷海瀛,3
·論 著·
2016—2020年寧波市某醫院血培養病原菌分布與耐藥性研究
詹琳1,郭飛2,谷海瀛1,3
1.寧波大學醫學部,浙江寧波 315211;2.寧波市第一醫院檢驗科,浙江寧波 315010;3.寧波大學醫學院附屬醫院消化病實驗室,浙江寧波 315020
分析2016—2020年寧波市某醫院血培養中的病原菌分布和耐藥情況,為臨床合理使用抗菌藥物提供參考。采用WHONET 5.6軟件對2016—2020年血培養分離的主要病原菌及其耐藥性進行統計分析。共檢出細菌3400株,其中G–桿菌1545株(45.4%),G+球菌1510株(44.4%),真菌111株(3.3%)。G-桿菌以大腸埃希菌、肺炎克雷伯菌、銅綠假單胞菌、鮑曼不動桿菌和洋蔥伯克霍爾德菌為主,分別占總株數的21.0%、9.6%、2.7%、2.2%、1.3%。肺炎克雷伯菌分離率呈上升趨勢。G+球菌中以凝固酶陰性葡萄球菌為主,共867株,占25.5%。耐甲氧西林金黃色葡萄球菌檢出率為37.3%,未出現對萬古霉素、替考拉寧和利奈唑胺耐藥的菌株。寧波市某醫院血流感染病原菌中G-桿菌和G+球菌比例相當。臨床醫生應重視并規范早期血培養,嚴格控制抗生素的使用,減少耐藥細菌的感染與播散。
血流感染;血培養;病原菌;耐藥性
菌血癥、敗血癥等全身性血流感染給患者生命造成極大的威脅,也給臨床治療帶來很大的挑戰[1]。近年來,由于抗菌藥物的濫用和有創操作的開展,血流感染的問題日益嚴峻[2]。血液培養出病原菌是診斷的金標準,但由于周期長,不能及時為臨床初期治療提供最有效的證據。隨著血流感染病原菌的不斷變化,其耐藥性亦逐漸增加[3]。不同地區引起血流感染的病原菌菌種和耐藥性具有一定差異,定期對血培養陽性的病原菌及耐藥性進行統計分析,有助于臨床血流感染患者的診斷、治療[4-6]。本研究通過對寧波市某醫院2016—2020年血培養分離出的病原菌種類和耐藥性進行回顧性分析,探討病原菌的分布特點及其耐藥性,為臨床早期治療提供幫助,從而提高治療效果,現報道如下。
1 資料與方法
1.1 標本及菌株來源
2016—2020年寧波市某醫院住院及門/急診患者血培養分離所得的3400株細菌,排除同一患者的重復菌株及芽孢桿菌等的潛在的皮膚污染菌。本研究屬于回顧性研究,所用資料是從臨床既往病例中獲得,免除知情同意,已通過寧波市第一醫院倫理委員會審批通過(倫理審批號:2023R013RS)。
1.2 菌株培養與鑒定
血培養采用美國BD BACTEC9240和FX全自動養儀,菌株的鑒定和常規藥敏試驗采用法國生物梅里埃公司VITEK2 Compact全自動細菌鑒定儀。補充藥敏試驗采用KB法,按照美國臨床實驗室標準化協會指南進行判讀。質控菌株為大腸埃希菌ATCC25922、金黃色葡萄球菌AECC25923及銅綠假單胞菌ATCC27853。
1.3 統計學方法
采用WHONET 5.6軟件和Excel 2013對數據進行描述性分析。
2 結果
2.1 病原菌分布及構成
2016—2020年血培養共分離到3400株不同細菌,見表1。其中G–桿菌1545株(45.4%),G+球菌1510株(44.4%),真菌111株(3.3%)。G–桿菌以大腸埃希菌、肺炎克雷伯菌、銅綠假單胞菌、鮑曼不動桿菌和洋蔥伯克霍爾德菌為主,分別占總株數的21.0%、9.6%、2.7%、2.2%、1.3%。其中,G–桿菌占比相對稍多,主要G–桿菌分離率的年度變化趨勢,見圖1。
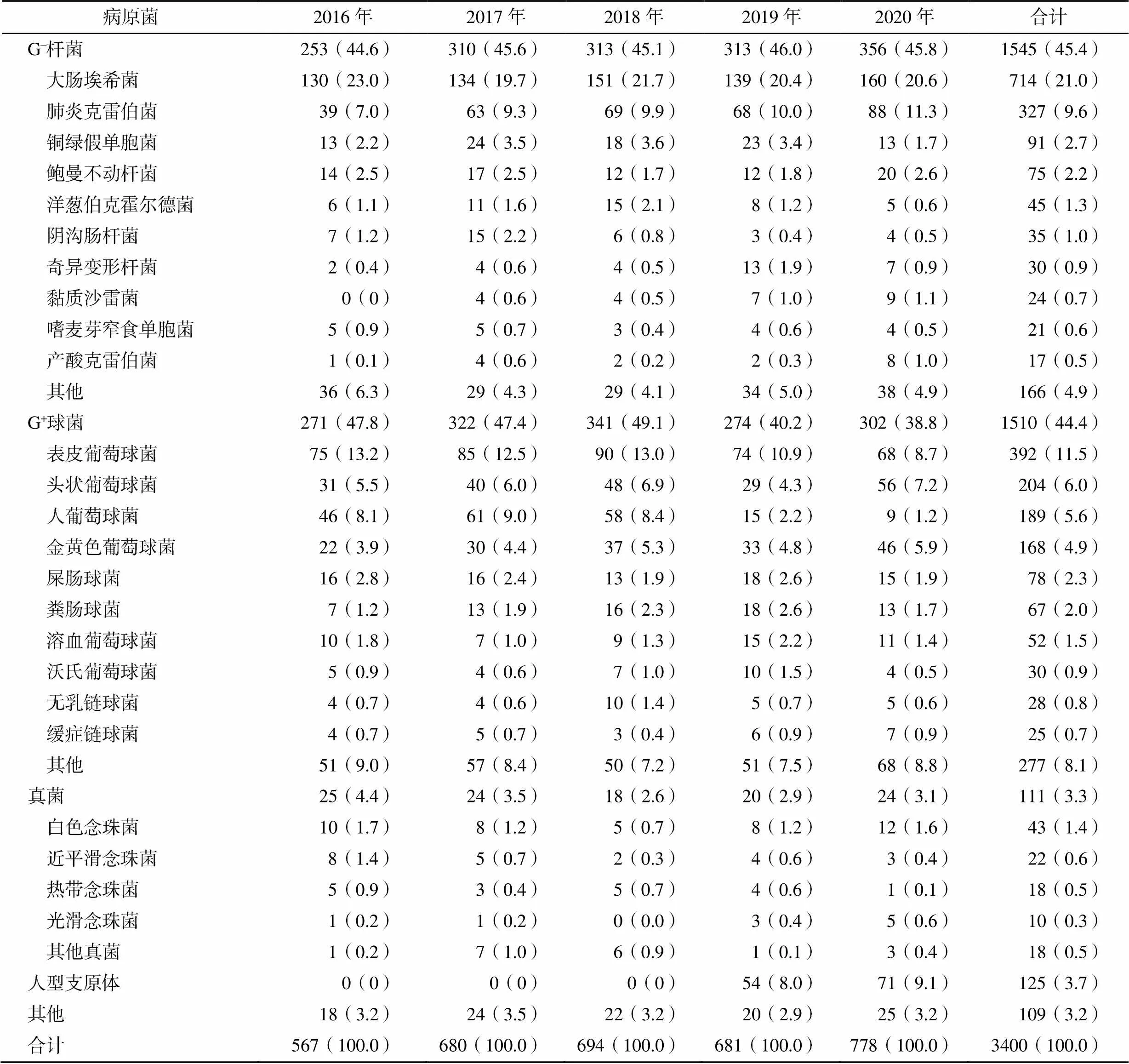
表1 2016—2020年血培養病原菌分布[株(%)]
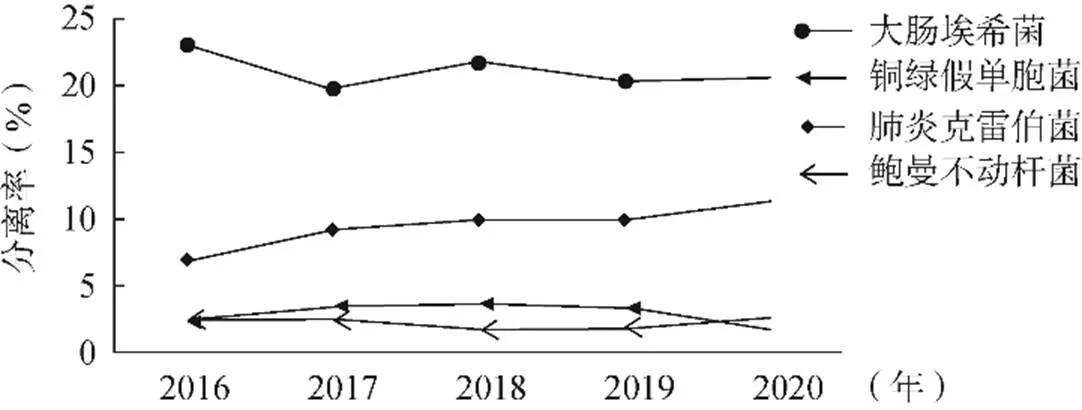
圖1 2016—2020年主要G-桿菌分離率的變化趨勢
2.2 主要G-桿菌的耐藥性
大腸埃希菌對環丙沙星、頭孢曲松、復方新諾明的耐藥率超過50%,對碳青霉烯類、阿米卡星、哌拉西林/他唑巴坦和頭孢哌酮/舒巴坦較敏感,耐藥率<6%。肺炎克雷伯菌對氨芐西林的耐藥率高達89.3%;對其他常用抗生素敏感性幾乎>65%;耐碳青霉烯類肺炎克雷伯菌占23.4%。肺炎克雷伯菌對頭孢類、碳青霉烯類藥物的耐藥率高于大腸埃希菌。銅綠假單胞菌對頭孢曲松、頭孢西丁、阿莫西林/克拉維酸、氨芐西林的耐藥率分別為97.2%、99.0%、96.5%和98.9%;對慶大霉素、妥布霉素、阿米卡星的耐藥率<10%。鮑曼不動桿菌對常用抗生素(復方新諾明除外)的耐藥率>40%,見表2。
2.3 主要G+球菌的耐藥性
金黃色葡萄球菌對青霉素G耐藥率較高,對利福平、喹諾酮類藥物敏感性尚好,對其他抗生素的耐藥率<53.6%。耐甲氧西林金黃色葡萄球菌檢出率為37.3%。腸球菌總體耐藥率較高,屎腸球菌對常用抗生素耐藥率>79.8%(除四環素和奎奴普丁/達福普汀外),而糞腸球菌對常用抗生素的耐藥率<60.6%。未檢出耐萬古霉素和利奈唑胺的腸球菌,見表3。
3 討論
正常人體的血液是無菌環境,病原菌或其毒素進入血液后可引起血流感染,如菌血癥、敗血癥、膿毒血癥,臨床上表現為急性起病,突發寒戰、高熱、神志改變等,重者可出現急性呼吸窘迫綜合征、肝腎功能衰竭、休克、彌散性血管內凝血,甚至死亡[7]。血培養是血流感染診斷的金標準,及時準確地分析血培養結果及藥敏試驗報告,對臨床診斷和治療至關重要[8]。
本研究結果顯示,2016—2020年寧波市某醫院住院及門/急診患者共收集3400株病原菌,其中G-桿菌占45.4%,G+球菌占44.4%,以大腸埃希菌、表皮葡萄球菌、肺炎克雷伯菌、頭狀葡萄球菌為主,與國內報道基本一致[9]。凝固酶陰性葡萄球菌檢出率為27%,高于徐慧等[10]、白書媛等[11]報道的21%和23%,可能與樣本送檢量、培養條件和地區差異有關。
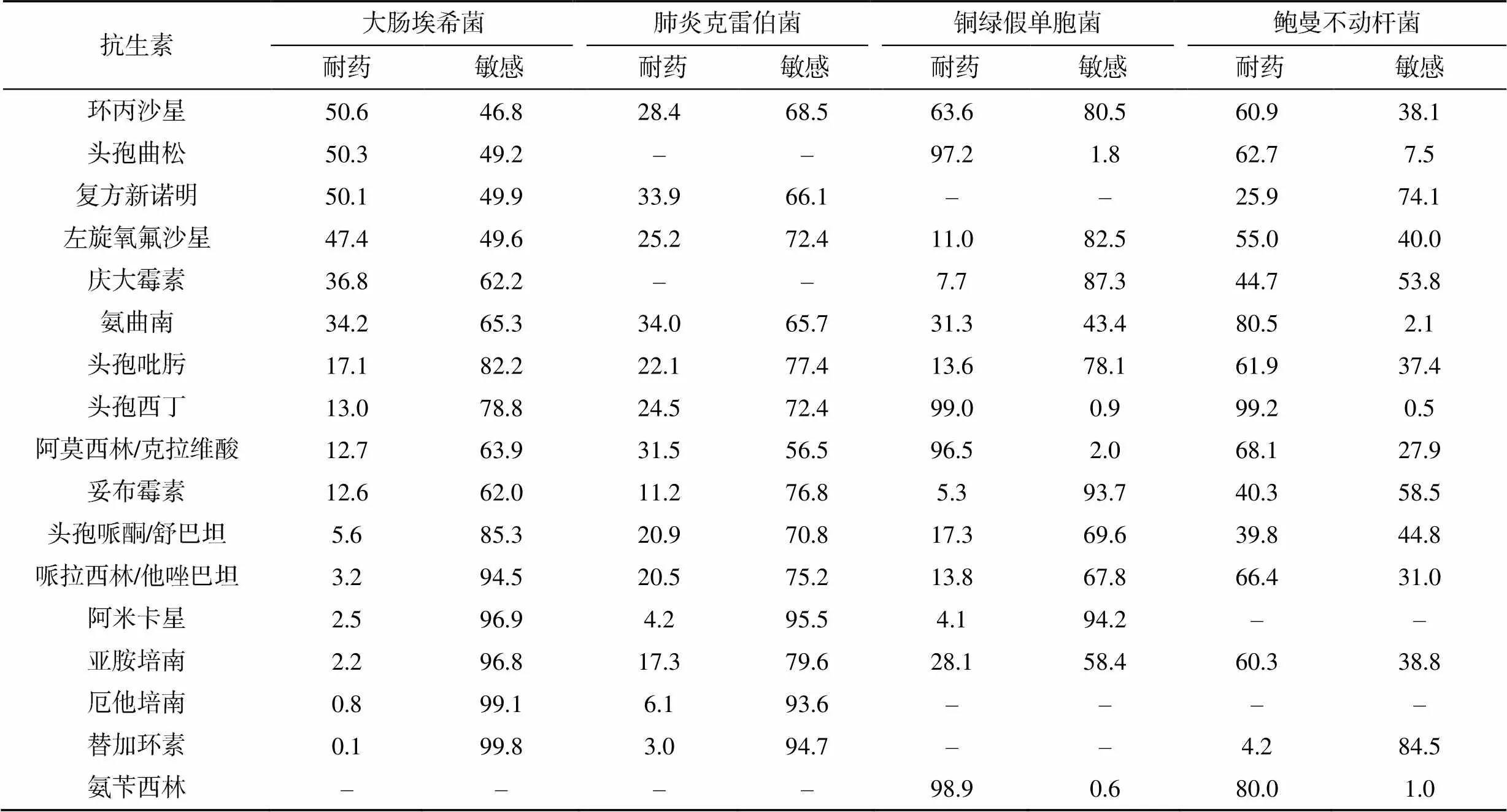
表2 主要G–桿菌對抗菌藥物的耐藥率(%)
注:–表示未做藥敏或天然耐藥
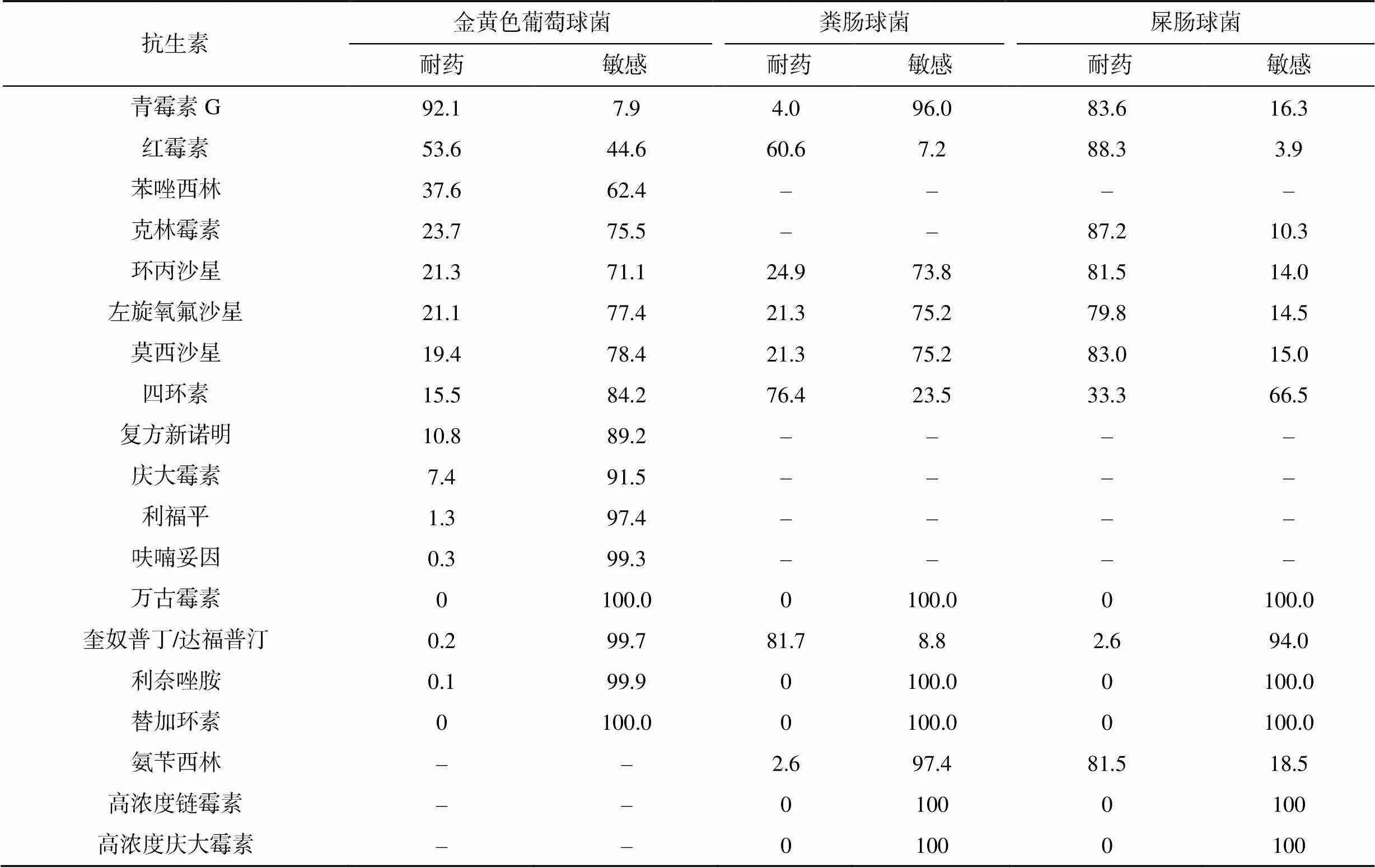
表3 主要G+球菌對抗菌藥物的耐藥率(%)
注:–未做藥敏試驗或天然耐藥
排除可能污染外,G–桿菌引起的血流感染的比重較大且逐年升高,因此,歸納分析以上數據對臨床治療具有重大意義。肺炎克雷伯菌的菌株數及構成比均有增長的趨勢。大腸埃希菌對碳青霉烯類、阿米卡星、替加環素和β內酰胺類酶抑制劑有較高的敏感性,這些藥物可優先使用,肺炎克雷伯菌對頭孢類抗生素及β內酰胺類酶抑制劑的耐藥性高于大腸埃希菌,耐碳青霉烯類肺炎克雷伯菌占23.4%,較國內報道稍低,可能與醫院嚴格執行抗生素階梯治療有關[12]。對氨基糖苷類抗生素的耐藥率相對較低,這些均可優先使用。這兩種菌的耐藥機制之一是產超廣譜β-內酰胺酶以水解頭孢類和單環β-內酰胺類抗生素,碳青霉烯類藥物對產超廣譜β內酰胺酶高度穩定,是針對產ESBLs菌引起嚴重感染的主要治療藥物。但是,醫生應合理選擇抗生素,不應直接升級使用碳青霉烯類,以減少耐碳青霉烯類桿菌的出現[13-14]。
非發酵菌是指不能以發酵形式利用糖類的需氧或兼性厭氧的G–桿菌。G–菌血癥有1/4是由非發酵菌引起,且該菌易出現耐藥現象,應引起臨床重視[15]。其中,銅綠假單胞菌和鮑曼不動桿菌引起血流感染的比例最高,對常用抗生素的耐藥性相對較高,有嚴重的多重耐藥和泛耐藥現象。銅綠假單胞菌對頭孢西丁、頭孢曲松、阿莫西林/克拉維酸的耐藥率為95%,而對其他常用抗生素的敏感性高。其耐藥機制包括產生活性酶、抗菌藥物作用靶位的改變、細胞膜通透性的下降、形成生物被膜、外排泵的表達[13]。鮑曼不動桿菌對多數抗菌藥物的耐藥性普遍較高,僅對替加環素有較高的敏感性,而替加環素由于其血藥濃度分布低和嚴重的不良反應而限制其應用。其耐藥主要基于以下3種:①抗菌酶的失活;②抗菌靶位的改變或細胞功能的誘變;③保護細菌靶位免受抗菌因子的影響[16]。碳青霉烯類耐藥的鮑曼不動桿菌已被世界衛生組織列為具有最大威脅性的耐藥菌株之一[17]。本研究中鮑曼不動桿菌對亞胺培南的耐藥率>60%,可以進行聯合用藥,亞胺培南或米諾環素+多黏菌素兩種藥物組合對鮑曼不動桿菌具有較好的抑菌效果[18]。
G+球菌以凝固酶陰性葡萄球菌(coagulase negative staphylococci,CNS)為主,其次為金黃色葡萄球菌、屎腸球菌和糞腸球菌。耐甲氧西林金黃色葡萄球菌檢出率為37.3%,稍高于2020年中國細菌耐藥監測網報道的31.0%[19]。CNS既是常見病原菌,也是常見的血培養污染菌[20]。它存在于人體表面,若采血操作不規范,極易造成假陽性。所以,應加強消毒措施和規范操作。CNS占比較高,可能是由于操作不規范造成污染。研究顯示,血培養陽性報警時間聯合未成熟粒細胞百分比和C反應蛋白對鑒別CNS血流感染和污染有一定價值[21]。因此,該類細菌引起的感染應結合患者臨床表現和其他指標綜合判斷,避免抗菌藥物的濫用。
真菌是引起血流感染的第三大因子,占血流感染的3.3%,其中白色念珠菌比例最高,為38.7%(43/111)。研究顯示,真菌性血流感染導致休克的概率達70%,深部真菌感染引起的病死率達50%[22]。對于有真菌感染高危因素的患者,在其出現發熱等癥狀且經抗菌藥物治療無效時,應考慮真菌感染[2]。
綜上所述,寧波市某醫院血流感染病原菌中G–桿菌和G+球菌比例相當,其中大腸埃希菌和肺炎克雷伯菌占比較高,但其耐藥率稍低于國內的報道,可能與醫院嚴格控制抗生素的使用有關。CNS在所有病原菌中所占比例最高,可能與醫院抽血取樣操作不規范,造成較高的污染率有關。微生物人員除及時報告結果外,也應該在臨床科室加強宣傳,規范操作。動態監測本地區血培養病原菌構成及耐藥,可為臨床合理應用抗菌藥物提供依據。
[1] KERN W V, RIEG S. Burden of bacterial bloodstream infection-a brief update on epidemiology and significance of multidrug-resistant pathogens[J]. Clin Microbiol Infect, 2020, 26(2): 151–157.
[2] CHAMBLEE T B, PATTON L J, YOUNG V B, et al. Reducing central line-associated bloodstream infection in contaminated central venous catheters: Case studies of a pediatric contamination guideline[J]. Br J Nurs, 2021, 30(19): S24–S29.
[3] DE ANGELIS G, FIORI B, MENCHINELLI G, et al. Incidence and antimicrobial resistance trends in bloodstream infections caused by ESKAPE and Escherichia coli at a large teaching hospital in Rome, a 9-year analysis (2007-2015)[J]. Eur J Clin Microbiol Infect Dis, 2018, 37(9): 1627–1636.
[4] 張鴻娟, 許云敏, 董小雪, 等. 云南省多中心2017—2021年血流感染病原菌分布及耐藥性分析[J]. 中國熱帶醫學, 2022, 22(12): 1135–1141.
[5] 李可可, 鄒鳳梅, 楊永清, 等. 2009—2019年甘肅省人民醫院血流感染病原菌分布及耐藥性分析[J]. 中國抗生素雜志, 2022, 47(8): 834–838.
[6] DECOUSSER J W, PINA P, PICOT F, et al. Frequency of isolation and antimicrobial susceptibility of bacterial pathogens isolated from patients with bloodstream infections: A French prospective national survey[J]. J Antimicrob Chemother, 2003, 51(5): 1213–1222.
[7] CARABALLO C, JAIMES F. Organ dysfunction in sepsis: An ominous trajectory from infection to death[J]. Yale J Biol Med, 2019, 92(4): 629–640.
[8] CENDEJAS-BUENO E, ROMERO-GóMEZ M P, MINGORANCE J. The challenge of molecular diagnosis of bloodstream infections[J]. World J Microbiol Biotechnol, 2019, 35(4): 65.
[9] 陳興英, 樓永良. 血培養標本中病原菌的分布特征、耐藥性變遷和耐藥基因分型[J]. 中國微生態學雜志, 2018, 30(7): 810–817.
[10] 徐慧, 徐岷, 劉彩林, 等. 2014~2019年鄭州大學第一附屬醫院血培養分離病原菌臨床分布及耐藥性分析[J]. 現代檢驗醫學雜志, 2021, 36(1): 136–140.
[11] 白書媛, 閔嶸, 張麗麗, 等. 某三級醫院連續4年血培養分離菌構成及耐藥性[J]. 中國感染控制雜志, 2014, 13(2): 85–88.
[12] 陳明慧, 孫蘭菊, 房杰, 等. 2015—2017年臨床常見血培養病原菌的分布特征及耐藥性變遷[J]. 中國中西醫結合外科雜志, 2019, 25(3): 248–256.
[13] 張淑麗, 許俊紅, 馬冰. 肺炎患者下呼吸道感染病原菌分布與非發酵菌的耐藥性分析[J]. 臨床研究, 2022, 30(1): 24–28.
[14] BIENTINESI R, MURRI R, SACCO E. Efficacy and safety of levofloxacin as a treatment for complicated urinary tract infections and pyelonephritis[J]. Expert Opin Pharmacother, 2020, 21(6): 637–644.
[15] GULTEKIN E, UYANIK M H, HANCI H, et al. Antimicrobial susceptibility of nonfermentative gram negative bacteria isolated from blood cultures[J]. ANKEM Dergisi, 2014, 28(3): 79–85.
[16] BAGI?SKA N, PICHLAK A, GóRSKI A, et al. Specific and selective bacteriophages in the fight against multidrug-resistant acinetobacter baumannii[J]. Virol Sin, 2019, 34(4): 347–357.
[17] BARALDI E, LINDAHL O, SAVIC M, et al. Antibiotic pipeline coordinators[J]. J Law Med Ethics, 2018, 46(1_suppl): 25–31.
[18] 吳忠偉. 耐碳青霉烯鮑曼不動桿菌的耐藥機制、流行病學及聯合用藥方案分析[D]. 呼和浩特: 內蒙古醫科大學, 2020.
[19] 胡付品, 郭燕, 朱德妹, 等. 2020年CHINET中國細菌耐藥監測[J]. 中國感染與化療雜志, 2021, 21(4): 377–387.
[20] 夏雨, 張兵. 7781例疑似血流感染患者的血培養標本病原菌分布及藥敏結果分析[J]. 山東醫藥, 2020, 60(3): 82–85.
[21] 王淑慧, 劉海英, 林敏純, 等. 血培養陽性報警時間聯合未成熟粒細胞及C反應蛋白鑒別兒童凝固酶陰性葡萄球菌血流感染與污染[J/CD]. 中華實驗和臨床感染病雜志(電子版), 2021, 15(1): 60–66.
[22] 呂志華, 馮麗娜, 李艷. 2016至2018年某醫院真菌血流感染者流行病學特征及耐藥性分析[J/CD]. 中華實驗和臨床感染病雜志(電子版), 2020, 14(5): 429–432.
Study on the distribution and drug resistance of blood culture pathogenic bacteria in certain hospital of Ningbo City from 2016 to 2020
ZHAN Lin, GUO Fei, GU Haiying
1.NUB Health Science Center, Ningbo 315211, Zhejiang, China; 2.Department of Laboratory, Ningbo First Hospital, Ningbo 315010, Zhejiang, China; 3.Laboratory of Gastroenterology, Affiliated Hospital of Ningbo University, Ningbo 315020, Zhejiang, China
To analyze the distribution and antibiotic resistance of pathogenic bacteria in blood culture of Ningbo Certain Hospital from 2016 to 2020, to provide reference and basis for clinical diagnosis and treatment.The isolation data and drug susceptibility results of major pathogens from blood culture-positive isolates from patients with blood infections were analyzed by WHONET5.6 software.A total of 3400 pathogens were isolated from blood culture specimens, included 1545 strains of Gram-negative bacilli strains (45.4%), 1510 Gram-positive cocci (44.4%), and 111 Fungi strains (3.3%). The gram-negative bacilli were mainly Escherichia coli, Klebsiella pneumoniaePseudomonas aeruginosa, Acinetobacter baumanniiand Burkholderia onion, accounted for 21.0%, 9.6%, 2.7%, 2.2% and 1.3% of the total strains, respectively. The isolation rate of Klebsiella pneumoniae was on the rise. The Gram-positive cocci were mainly coagulase-negative staphylococci, with 867 strains accouned for 25.5%. The detection rate of methicillin-resistant Staphylococcus aureus was 37.3%, and no strains were resistant to vancomycin, teicoplanin and linezolid.In Ningbo Certain Hospital, the proportion of Gram-negative bacilli and Gram-positive cocci among the pathogens of bloodstream infections is comparable. Clinicians should attach importance to and standardize early blood culture and strictly control the use of antibiotics to reduce the infection and spread of drug-resistant bacteria.
Bloodstream infection; Blood culture; Pathogenic bacteria; Drug resistance
R378
A
10.3969/j.issn.1673-9701.2023.18.010
(2022–12–25)
(2023–03–08)
谷海瀛,電子信箱:guhaiying@nbu.edu.cn

