藥用植物細胞外囊泡作為新型藥效物質的研究進展
蘇勇匯,徐珊珊,王 歡,李太平,王松松,田青平,韓利文*
藥用植物細胞外囊泡作為新型藥效物質的研究進展
蘇勇匯1, 2,徐珊珊1, 2,王 歡1,李太平1,王松松1,田青平2*,韓利文1*
1. 山東第一醫科大學(山東省醫學科學院)藥學與制藥科學學院,山東 濟南 250000 2. 山西醫科大學藥學院,山西 太原 030001
藥用植物細胞外囊泡(medicinal plant-derived extracellular vesicles,MPEVs)是由其藥用植物特定部位細胞分泌的,裝載有小分子化合物、核酸、蛋白質和脂質等功能物質的納米級膜囊泡。由于具有其同源植物中的活性物質,MPEVs具有特殊的生物活性。通過對近年來MPEVs的分離純化、鑒定、成分分析、生物活性等方面進行總結分析,為作為新型藥效物質的深入研究提供借鑒和啟示。
細胞外囊泡;藥用植物細胞外囊泡;生物活性;抗腫瘤;抗衰老
細胞外囊泡(extracellular vesicles,EVs)是由不同種類的細胞主動釋放的多種納米級膜囊泡[1],在細胞間和種間交流中起著信息和物質傳遞的作用[2]。根據其生物起源、大小和生物物理性質,分為外泌體、微囊泡和凋亡體[3]。20世紀60年代,Halperiun等[4]在胡蘿卜中首次觀察到植物EVs的存在。隨后,在動物和微生物中也相繼發現存在有EVs[5-6]。近年來,隨著對EVs研究的深入,藥用植物EVs(medicinal plant-derived EVs,MPEVs)已被發現具有較普通植物來源EVs更為突出的生物活性,在作為治療劑和藥物載體方面展現出獨特優勢[7-9],具有十分廣闊的應用前景。
本文整理了《中國藥典》2020年版所收錄的生姜、人參et、姜黃、紅景天et、槲寄生、黃芪和天冬等常用藥材或其基原植物來源的EVs的相關文獻,對其分離純化、鑒定、成分分析及在疾病治療中的應用進行總結與分析,為新型藥效物質的深入研究提供借鑒和啟示。
1 EVs的形成
EVs的形成及分泌是一個復雜的過程,圖1為EVs經不同途徑生成的示意圖。根據國際EVs學會2018年版指導手冊[10],當前研究中的囊泡類型主要是小于200 nm的小EVs(small EVs,sEVs),包括外泌體和部分微囊泡。微囊泡的直徑在50~1000 nm,主要由細胞膜向外出芽而形成[11],此過程伴隨著生物活性脂質、mRNA和蛋白等成分的轉運[12]。而外泌體是細胞內體途徑起源,直徑在30~150 nm的囊泡。首先,細胞膜向內出芽將蛋白、核酸和次級代謝產物等物質包裹到膜囊泡中形成早期內體,隨后,早期內體進一步成熟并轉化為晚期內體,也稱為多囊泡體(multivesicular bodies,MVBs)。MVBs包裹有腔內小泡(intraluminal vesicles,ILVs),當其與細胞膜融合時,ILVs被釋放到細胞外環境中,稱為外泌體[13]。此外,植物外泌體的分泌還涉及液泡、胞外陽性細胞器(exocyst positive organelles,EXPO)等途徑。Hatsugai等[14]研究表明植物可以通過液泡與細胞膜融合從而將防御蛋白釋放到細胞外啟動防御策略。另有研究表明液泡可以與MVBs融合進而含有ILVs[15]。Cui等[16]提出一定數量的植物EVs來源于液泡與細胞膜的融合,并可能含有防御相關的蛋白及小RNA(small RNAs,sRNAs)的觀點。EXPO與MVBs不同,不屬于內吞途徑,被認為與自噬體的形成方式類似,可通過與細胞膜融合從而釋放其內部囊泡[17]。當前,新鮮植物組織來源的MPEVs的發生途徑主要包括MVBs、EXPO、液泡3種,不同MPEVs的成分差異主要是由來源植物的基原或生長代謝特性決定,而以上的不同形成機制造成了同一植物由不同途徑產生的囊泡在成分類型或含量存在一定差異,進而影響其生物學活性。對于已經加工成的中藥飲片而言,其囊泡的形成還存有爭議。趙夢等[18]通過文獻總結發現中藥飲片來源的MPEVs可以耐受煎煮、干燥等過程。另有學者認為中藥復雜多樣的化學成分在炮制或煎煮過程中可以通過分子識別與自組裝形成納米囊泡[19-21],該囊泡的成分主要由中藥中的各種物質(如脂質、蛋白、小分子化合物等)的性質決定。同種或不同成分間通過氫鍵、靜電力和范德華力等相互作用自發形成囊泡,從而被賦予不同的生物活性。
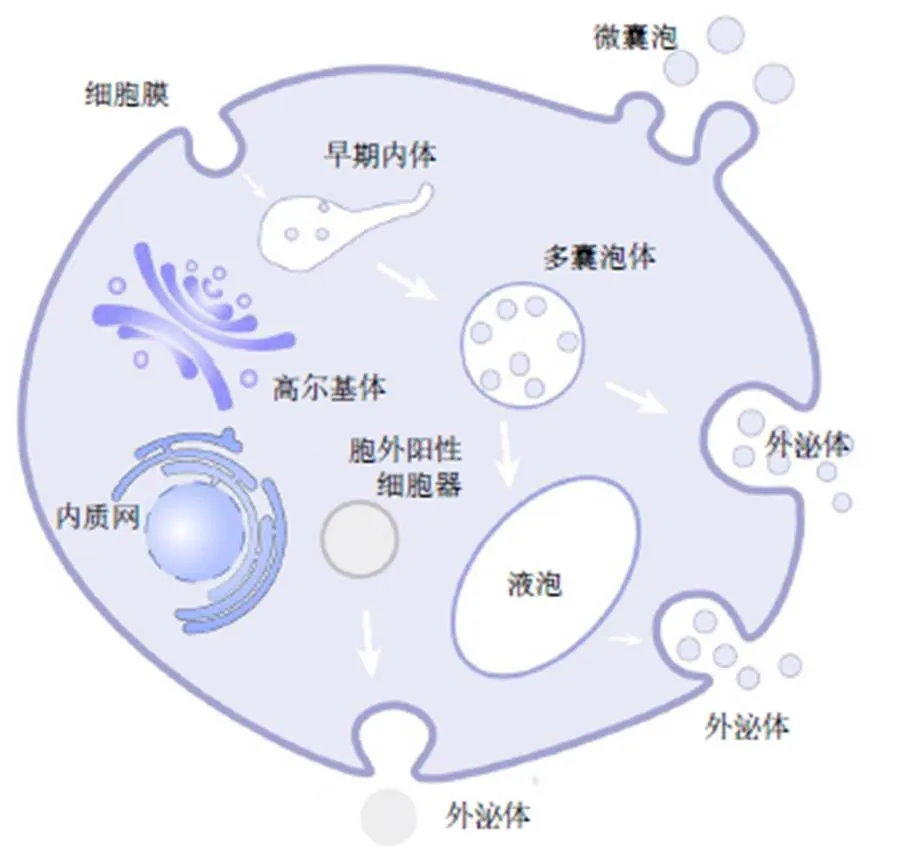
圖1 EVs的形成及釋放過程
2 MPEVs的分離純化與結構表征
針對EVs獨特的物理和生物化學性質,已開發出多種分離方法,如基于密度進行分離的超速離心法和密度梯度離心法,基于尺寸篩分的超濾法、尺寸排阻色譜法、切向流過濾法和非對稱流場流分離法,基于溶解度進行分離的聚合物沉淀法,基于親和力分選的免疫磁珠法、洗脫色譜聯合分子排阻色譜法和親和色譜法,基于電荷分離的離子交換色譜法[22-32]及一些新興的技術,如微流控技術、納米流式細胞術和納米級側向位移陣列技術[33-35]等。超速離心法也稱差速離心法,是利用不同的物質在受到強大的離心力時,在溶液中的沉降系數不同從而達到分離的目的,是最為常用的EVs分離方法,但其存在耗時、產量低等缺點。密度梯度離心法是將樣品加在惰性梯度介質中進行離心沉降或沉降平衡,在一定的離心力下把顆粒分配到梯度中某些特定位置上,從而形成不同區帶的分離方法,該方法可以得到更高純度的EVs,故多用作純化[36]。尺寸排阻色譜法是利用尺寸不同的分子在固定相孔隙中保留的作用不同以實現分離,該方法可保證EVs的生物活性和結構的完整性[25]。與動物來源EVs不同,由于植物樣品成分復雜,常常需要額外的純化步驟。在MPEVs分離方法的選擇上,多使用超速離心法初步得到囊泡樣品,隨后根據實驗需求或樣品特性選擇不同的純化方法。如注重高產量時宜選擇沉淀法[28],注重高純度時宜選擇密度梯度離心法[36],糖分較高樣品不宜使用尺寸排阻色譜法[37]等。而對于動物細胞來源的EVs,通常選擇一種分離方法即可達到純度要求[38]。如超速離心聯合密度梯度離心法已被用于生姜、天冬、姜黃和人參等[39-49]藥用植物中MPEVs的分離與純化。超速離心法單獨使用或聯合其他純化方法在蒲公英、黃精、蘆薈和地黃等[37,50-57]藥用植物中也有應用。相關信息見表1。

表1 不同MPEVs的分離純化方法
根據國際EVs學會規定[10],需要從形態、粒徑分布及表面蛋白標志物3個方面對EVs進行鑒定。與動物來源EVs不同,由于MPEVs缺乏分化簇9(cluster of differentiation 9,CD9)、CD63和CD81等蛋白標志物[58],所以關于其表面蛋白標志物及檢測尚未形成統一標準,表征時主要采用形態、粒徑分布方式。形態表征方面,可選用的儀器有透射電子顯微鏡(transmission electron microscope,TEM)、冷凍電子顯微鏡(cryo-transmission electron microscopy,Cryo-EM)、原子力顯微鏡和掃描電子顯微鏡。其中使用Cryo-EM觀察EVs時不需要染色、干燥等處理,所得的結果更接近真實狀態。但由于Cryo-EM設備昂貴、實驗步驟繁瑣,故使用較少。使用TEM對MPEVs形態進行表征時,多結合負染色技術,可觀察到具有明顯膜結構的茶托樣或杯狀囊泡[45,53]。對于粒徑表征,納米顆粒跟蹤分析(nanoparticle tracking analysis,NTA)和動態光散射(dynamic light scattering,DLS)2種技術是最常用的。二者都是基于光散射原理,追蹤懸浮液中顆粒的布朗運動,并通過計算,從而對EVs的粒徑分布進行統計[59]。NTA和DLS的主要區別在于濃度范圍,當濃度較低時,NTA可以很好的完成檢測任務,而DLS只能檢測濃度較高的樣品。此外,部分研究者還測定了電位,以評價其物理穩定性。
3 MPEVs的體內分布特征
藥物到達作用部位是其藥效發揮的關鍵。不同的給藥方式,可能會導致MPEVs的分布不同。有研究表明動物來源EVs經靜脈給藥后,主要分布在血管豐富和與網狀內皮系統相關的器官中,如肝、肺、脾和腎;腹腔給藥后,主要位于肝、肺、脾、胃腸道和胰腺;鼻腔給藥后,在肺和腦中可檢測到其存在[60]。同樣MPEVs也大多采用口服、靜脈或腹腔注射給藥。人參和天冬來源囊泡經腹腔和靜脈注射給藥后,主要在肝臟和脾臟中積累[44,47];生姜來源囊泡顆粒口服給藥后,可在肝臟和腸系膜淋巴結中檢出[43]。此外,還有部分MPEVs展示出一定的靶向能力,如生姜囊泡經口服后可以優先被腸道微生物鼠李糖乳桿菌GG吸收[40];姜黃來源納米囊泡選擇性地積聚在炎癥性結腸中[45]。結構中藥學理論認為EVs發揮效應還需保證其結構的完整性[61],即囊泡中的每一種組分都有各自的功能。現有研究顯示磷脂酸是決定生姜EVs轉運分布的關鍵成分,與生姜EVs被選擇性吸收密切相關[40],同時活性小分子及微RNA(microRNA,miRNA)成分在MPEVs體內分布及藥效發揮中也具有重要作用[43,51]。
4 MPEVs的組成成分特征
4.1 脂質
脂質是MPEVs雙分子層的主要組成部分。不同MPEVs中各種脂質的種類和含量存在一定的差異,如生姜來源納米顆粒富含磷脂酸、二半乳糖基二酰基甘油、單半乳糖基二酰甘油和單半乳糖基單酰基甘油等結構性成分,其中磷脂酸含量最為豐富[41,43]。Teng等[40]發現磷脂酸在鼠李糖乳桿菌GG優先吸收生姜納米囊泡的過程中起著信號傳遞作用,而蘆薈來源納米囊泡中葡萄糖神經酰胺是其主要脂質類型,在外泌體形成和分泌中具有促進或誘導膜曲率的特性[53]。此外,部分研究發現MPEVs的脂質成分還具有一定的生物活性[62]。
4.2 蛋白質
已有研究表明,MPEVs中主要包括參與細胞骨架形成、代謝信號傳導、細胞轉運和分泌途徑等相關蛋白。如生姜來源納米顆粒中蛋白含量較低,主要含肌動蛋白和蛋白水解酶等胞質蛋白及水通道蛋白和氯離子通道蛋白等膜蛋白[41]。Argonaute蛋白可能與調節蘆薈囊泡中sRNAs的包封有關,而其他蛋白,如熱休克蛋白70、谷胱甘肽-轉移酶、膜聯蛋白家族、腺苷高半胱氨酸酶和甘油醛-3-磷酸脫氫酶等已在多種植物囊泡中被報道[53]。基因本體功能富集數據庫顯示人參和姜黃來源EVs中的蛋白質與參與生物過程、分子功能和細胞組分的蛋白質相對應[45,50]。
4.3 核酸
核酸作為新一代的藥物,在疾病的治療方面擁有巨大的潛力。當前核酸療法面臨的關鍵問題就是體內遞送[63]。已有研究者從MPEVs中分析出其所特有的功能性核酸成分,為提高核酸的遞送效果提供了可能。Li等[51]通過模仿囊泡結構人工合成攜帶sRNAs的脂質復合物證明蒲公英囊泡中存在的sRNA-6和紅景天囊泡中存在的sRNA-m7可以被有效地遞送到細胞中。Zhang等[41]通過對生姜納米囊泡總RNA進行提取并測序,發現其中存在125種不同的miRNA,且每種miRNA含有15~27個核苷酸。
4.4 小分子活性成分
小分子活性成分是藥用植物中主要的藥效成分。在MPEVs分泌形成的過程中,植物源的小分子活性成分也會選擇性進入囊泡結構中。蘆薈來源的囊泡可檢測到蘆薈大黃素、蘆薈素和β-谷甾醇[53]。Gao等[45]通過高效液相色譜-質譜聯用技術,對姜黃囊泡中的姜黃素、脫甲氧基姜黃素和雙去甲氧基姜黃素進行含量測定。Zhang等[41]發現生姜囊泡中存在6-姜辣素和6-姜烯酚[41]。此外,Zhuang等[43]通過薄層色譜進一步分析,證明了6-姜烯酚大部分存在于生姜囊泡中而不是以游離的形式存在。
5 MPEVs的生物活性
多項研究表明MPEVs具有抗炎、抗腫瘤和抗衰老等多種生物活性。
5.1 抗炎活性
炎癥反應是機體對于刺激做出的一種防御反應,一般而言對機體是有利的。但在某些情況下,過度和持續的炎癥會引起一系列的疾病[64],包括肺炎、腦炎和心肌炎等。一些藥用植物來源的EVs,如生姜、蒲公英、姜黃等在相關研究中顯示出優越的抗炎作用。Li等[51]從蒲公英湯劑中分離出EVs,并證明其可以降低人非小細胞肺癌A549細胞中聚肌胞苷酸誘導的促炎因子的產生。與蒲公英湯劑相比,其蒲公英EVs顯示出更強大的抗炎作用。炎癥性腸病(inflammatory bowel disease,IBD)是一種病因不明確的特發性腸道炎癥性病變[65],累及回腸、結腸和直腸,包括潰瘍性結腸炎和克羅恩病2種,目前仍無有效的治療方法。最近研究表明,MPEVs對動物模型急性和慢性結腸炎的療效顯著。Gao等[45]發現從新鮮姜黃根莖中分離得到的姜黃納米囊泡(turmeric-derived nanovesicles,TNVs)可以降低脂多糖誘導的RAW264.7細胞中腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素-6(interleukin-6,IL-6)和單核細胞趨化蛋白-1等炎癥因子表達,促進巨噬細胞分化為M2表型緩解炎癥。進一步研究發現,TNVs通過恢復腸上皮屏障,調節腸道微生物群的組成和相對豐度及重塑免疫微環境緩解由葡聚糖硫酸鈉(dextran sulfate sodium,DSS)誘導的小鼠急性和慢性結腸炎相關癥狀。此外,從生姜中分離出的納米顆粒也被報道可以通過減少TNF-α、IL-6和IL-1β等促炎因子,增加IL-10和IL-22等抗炎因子的表達;或由鼠李糖乳桿菌GG攝取后將色氨酸代謝為吲哚-3-甲醛(indole-3-carboxaldehyde,I3A)進而激活芳烴受體(aryl hydrocarbon receptor,AHR)信號通路促進IL-22的表達,預防或改善DSS誘導的小鼠結腸炎[40-41]。除上述臨床前研究,部分MPEVs已進入臨床試驗階段。2018年,關于生姜和蘆薈囊泡減輕多囊卵巢綜合征患者慢性炎癥能力的初步臨床試驗方案成功發布(NCT03493984)。之后一項生姜囊泡抗炎作用研究的臨床試驗完成試點,該試驗評估了生姜囊泡單獨使用或與姜黃素聯合使用對難治性IBD患者癥狀的影響及其對IBD患者的安全性和耐受性(NCT04879810)。
5.2 抗腫瘤活性
癌癥是一種嚴重威脅人類健康的慢性公共衛生性疾病,其發病率和死亡率較高[66]。中藥作為多靶點輔助療法,已被證明具有切實的抗腫瘤作用[67]。由于不良反應小,藥用植物在癌癥治療領域的研究逐年增加[68]。Chun等[69]研究發現天冬醇提物的醋酸乙酯部位具有抗腫瘤活性且無肝腎毒性。Zhang等[44]發現天冬納米囊泡在HepG2腫瘤異種移植裸鼠中可通過抑制肝細胞增殖,誘導細胞凋亡和上調肝細胞凋亡相關因子,發揮抗腫瘤效應。與傳統的天冬提取物相比,天冬囊泡在抗腫瘤方面展現出更突出的活性和更好的類藥性。鑒于各種人造納米顆粒(如聚合納米偶聯物、脂質體和金屬納米顆粒等)展現出卓越的抗癌作用[70],Cao等[47]從新鮮人參根中分離出天然來源的人參納米囊泡并對其抗癌作用進行了深入研究。體內外研究表明,人參囊泡可通過Toll樣受體4(Toll-like receptor 4,TLR4)/髓樣分化抗原88(myeloid differentiation antigen 88,MyD88)信號通路促進巨噬細胞M2至M1表型的極化并產生總活性氧,顯著降低接種有黑色素瘤細胞小鼠的腫瘤生長。除具有抗炎活性外,Zhang等[41]發現生姜來源納米顆粒通過抑制炎癥誘導的腸上皮細胞增殖,降低結腸癌細胞的生長和癌癥發病率。表明MPEVs有望成為癌癥治療中潛力較大的一類納米藥物。
5.3 抗衰老活性
衰老指隨著時間的推移,機體表現出組織結構、生理功能和心理行為上的退行性變化。雖然衰老不可避免,但通過延緩衰老進程、改善健康狀態的抗衰老研究卻備受人們關注[71]。中藥憑借其抗氧化、增強人體免疫、促進機體新陳代謝等一系列藥理活性,現已成為抗衰老研究熱點[72]。此外,有研究表明EVs具有治療衰老相關疾病的巨大潛能[73]。Cho等[46]通過研究EVs對皮膚衰老的影響,發現來自人參的EVs在復制性衰老成纖維細胞和紫外線B(ultraviolet radiation B,UVB)誘導的衰老黑色素細胞中發揮作用。人參EVs通過降低細胞周期蛋白依賴性激酶抑制劑1A(cyclin dependent kinase inhibitor 1A,)基質金屬蛋白酶1(matrix metalloproteinase 1,)等基因表達及酪氨酸酶(tyrosinase,TYR)、酪氨酸相關蛋白酶2(tyrosinase-related protein 2,TYRP2)、Ras相關蛋白27(Ras-related peotein 27,RAB27)表達,增加高遷移率族蛋白B1(high mobility group box 1,HMGB1)表達,改善人真皮成纖維細胞的復制性衰老和UVB輻射處理的人黑素細胞衰老相關色素表型,證明MPEVs的抗衰老潛力。
5.4 其他活性
除上述生物活性外,MPEVs還具有護肝、抗纖維化、降血糖等作用。Zhuang等[43]通過研究生姜EVs對肝損傷的影響,發現其可將姜烯酚靶向遞送到肝組織,并以TLR4/β-干擾素tir結構域銜接蛋白(tir-domain-containing adaptor-inducing β-interferon,TRIF)相關性方式誘導核因子E2相關因子2(nuclear factor erythroid-2-related factor 2,Nrf2)活化,上調肝臟解毒和抗氧化基因的表達,并抑制活性氧的產生,從而阻止小鼠酒精性肝損傷的發展。Li等[51]通過研究紅景天EVs對肺纖維化的影響,發現其可以降低人胚肺MRC-5細胞模型中纖維化基因纖連蛋白的表達并改善博來霉素誘導的小鼠肺纖維化。高文靜[37]研究發現黃芪水煎液中的EVs可通過調節腸道菌群降低db/db糖尿病小鼠血糖。此外,部分研究者將MPEVs作為載體用以核酸或單體藥物的遞送[39,42],均顯示出較好的生物活性。
MPEVs來源廣泛,在基礎研究中表現出豐富的生物活性。本文對生姜、人參、天冬和姜黃等藥用植物不同部位來源囊泡的生物活性及其作用機制進行總結,見表2。
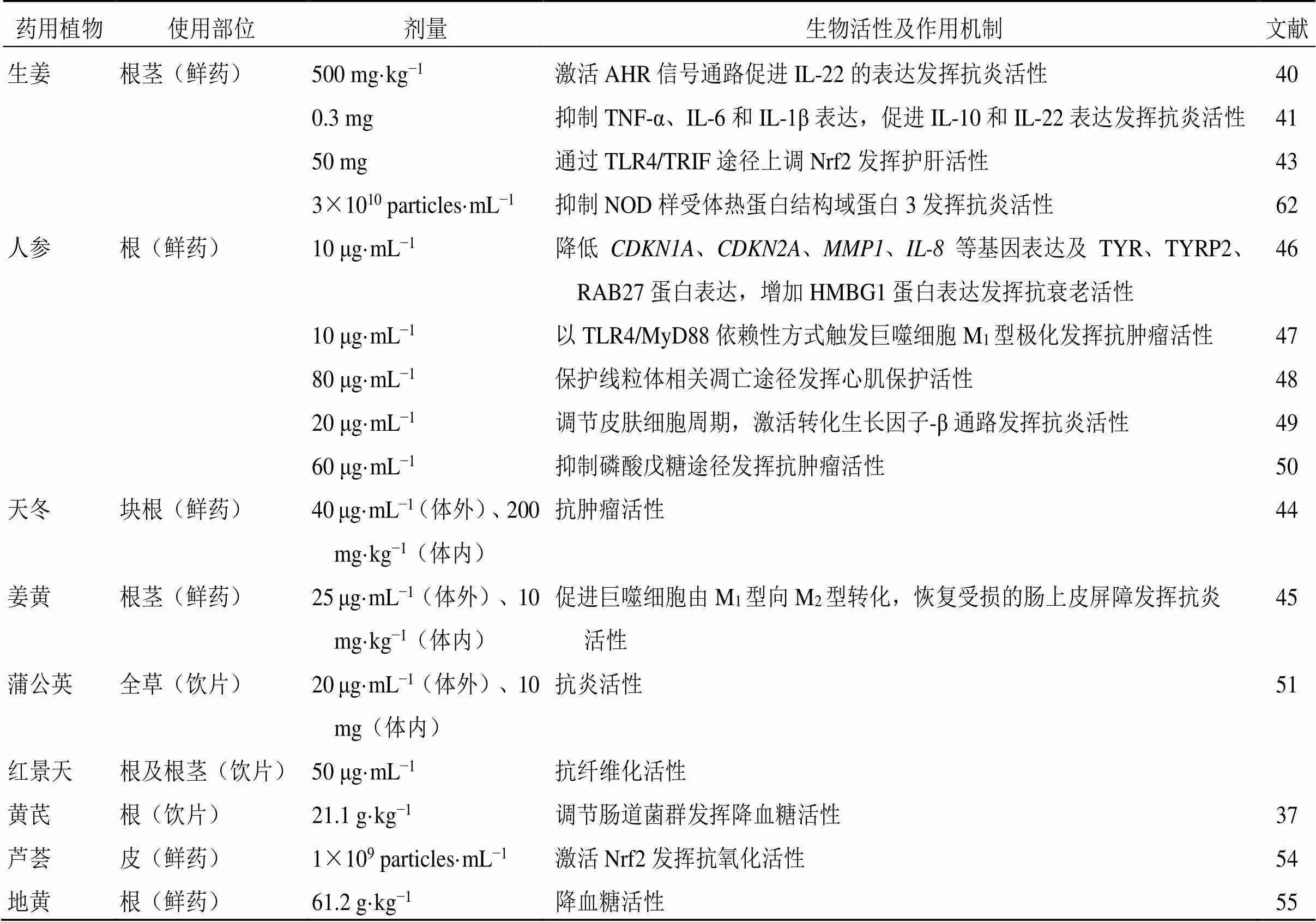
表2 MPEVs的生物活性
6 結語與展望
我國使用藥用植物治療疾病歷史悠久,藥用植物中的藥效物質通過復雜的機制發揮療效,在保障機體健康中具有重要作用。但大多數已知的藥效物質普遍存在生物利用度低等問題,尚不能完全揭示藥用植物的作用功效。而MPEVs作為細胞間通訊的重要媒介,在藥用植物發揮療效過程中扮演著重要的角色。與其他來源的EVs相比,MPEVs中包裹了其同源植物的藥效物質,對于溶解性較差的活性成分,可以極大地提高其生物利用度。此外,MPEVs除包裹的活性成分外,還可對其自身結構進一步修飾,以達到靶向目的或發揮多成分協同作用。雖然有關MPEVs的研究已經得到一定的關注,但是目前在相關研究中尚且存在一些缺陷和不足:(1)缺乏對MPEVs中發揮療效的關鍵成分的分析,明確發揮藥效的具體物質有助于進一步研究MPEVs復雜的作用機制,從而為MPEVs的藥理作用提供依據;(2)產率低,較低的產率意味著需要消耗更多的原材料,嚴重影響MPEVs的應用;(3)實驗所用MPEVs的純度要求尚未形成定論等。EVs的純度低是目前研究面臨的普遍問題,樣品純度不夠,相關活性實驗的結果將受到質疑。
我國藥用植物種類豐富,品種繁多,是創新藥物發現的寶庫。大量的研究表明,MPEVs在疾病的預防和治療方面具有相當的潛力,值得專家學者展開更加廣泛的研究。此外,MPEVs的內容物完成精準的分析以揭示其更加完整的作用機制或許成為將來的研究熱點,深入揭示其作用機制也將進一步推動其在臨床的廣泛應用。
利益沖突 所有作者均聲明不存在利益沖突
[1] Zhang M Z, Viennois E, Xu C L,. Plant derived edible nanoparticles as a new therapeutic approach against diseases [J]., 2016, 4(2): e1134415.
[2] Wu Z Y, Wang L L, Li J Y,. Extracellular vesicle-mediated communication within host-parasite interactions [J]., 2018, 9: 3066.
[3] Zarà M, Guidetti G F, Camera M,. Biology and role of extracellular vesicles (EVs) in the pathogenesis of thrombosis [J]., 2019, 20(11): 2840.
[4] Halperin W, Jensen W A. Ultrastructural changes during growth and embryogenesis in carrot cell cultures [J]., 1967, 18(3): 428-443.
[5] Johnstone R M, Adam M, Hammond J R,. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes) [J]., 1987, 262(19): 9412-9420.
[6] Mayrand D, Grenier D. Biological activities of outer membrane vesicles [J]., 1989, 35(6): 607-613.
[7] Nemati M, Singh B, Mir R A,. Plant-derived extracellular vesicles: A novel nanomedicine approach with advantages and challenges [J]., 2022, 20(1): 69.
[8] Tian T, Qiao S Y, Tannous B A. Nanotechnology-inspired extracellular vesicles theranostics for diagnosis and therapy of central nervous system diseases [J]., 2023, 15(1): 182-199.
[9] Chen C X, Wang J L, Sun M D,. Toward the next-generation phyto-nanomedicines: Cell-derived nanovesicles (CDNs) for natural product delivery [J]., 2022, 145: 112416.
[10] Théry C, Witwer K W, Aikawa E,. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): A position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines [J]., 2018, 7(1): 1535750.
[11] Kalluri R, LeBleu V S. The biology, function, and biomedical applications of exosomes [J]., 2020, 367(6478): eaau6977.
[12] Morel O, Jesel L, Freyssinet J M,. Cellular mechanisms underlying the formation of circulating microparticles [J]., 2011, 31(1): 15-26.
[13] Zhao Y, Li X L, Zhang W B,. Trends in the biological functions and medical applications of extracellular vesicles and analogues [J]., 2021, 11(8): 2114-2135.
[14] Hatsugai N, Iwasaki S, Tamura K,. A novel membrane fusion-mediated plant immunity against bacterial pathogens [J]., 2009, 23(21): 2496-2506.
[15] Cui Y, Cao W H, He Y L,. A whole-cell electron tomography model of vacuole biogenesis inroot cells [J]., 2019, 5(1): 95-105.
[16] Cui Y, Gao J Y, He Y L,. Plant extracellular vesicles [J]., 2020, 257(1): 3-12.
[17] Wang J, Ding Y, Wang J Q,. EXPO, an exocyst-positive organelle distinct from multivesicular endosomes and autophagosomes, mediates cytosol to cell wall exocytosis inand tobacco cells [J]., 2010, 22(12): 4009-4030.
[18] 趙夢, 李思敏, 張蕾, 等. 植物來源囊泡及其生物醫學應用研究進展 [J]. 藥學學報, 2021, 56(8): 2039-2047.
[19] 王蕾, 曹雪曉, 栗煥煥, 等. 中藥化學成分的分子識別與自組裝在中藥研究中的應用 [J]. 中草藥, 2020, 51(2): 516-521.
[20] 王艷宏, 趙曙宇, 張利那, 等. 中藥成分自組裝的機制及應用價值綜述 [J]. 中國藥房, 2021, 32(22): 2803-2806.
[21] 胡靜雯, 賈國香, 董亞倩, 等. 從中藥全過程視角探析納米顆粒自組裝行為及應用 [J]. 中草藥, 2022, 53(22): 7307-7316.
[22] Gandhi J, Naik M N, Mishra D K,. Proteomic profiling ofendophthalmitis derived extracellular vesicles in anmurine model [J]., 2022, 60(9): myac064.
[23] Huang Y F, Wang S M, Cai Q,. Effective methods for isolation and purification of extracellular vesicles from plants [J]., 2021, 63(12): 2020-2030.
[24] Vergauwen G, Dhondt B, van Deun J,. Confounding factors of ultrafiltration and protein analysis in extracellular vesicle research [J]., 2017, 7(1): 2704.
[25] Fortunato D, Giannoukakos S, Giménez-Capitán A,. Selective isolation of extracellular vesicles from minimally processed human plasma as a translational strategy for liquid biopsies [J]., 2022, 10(1): 57.
[26] Busatto S, Vilanilam G, Ticer T,. Tangential flow filtration for highly efficient concentration of extracellular vesicles from large volumes of fluid [J]., 2018, 7(12): 273.
[27] Sitar S, Kej?ar A, Pahovnik D,. Size characterization and quantification of exosomes by asymmetrical-flow field-flow fractionation [J]., 2015, 87(18): 9225-9233.
[28] Park J, Go E B, Oh J S,. Multiple-cycle polymeric extracellular vesicle precipitation and its evaluation by targeted mass spectrometry [J]., 2021, 22(9): 4311.
[29] Valle-Tamayo N, Pérez-González R, Chiva-Blanch G,. Enrichment of astrocyte-derived extracellular vesicles from human plasma [J]., 2022(186): e64107.
[30] Corso G, M?ger I, Lee Y,. Reproducible and scalable purification of extracellular vesicles using combined bind-elute and size exclusion chromatography [J]., 2017, 7(1): 11561.
[31] Reiter K, Aguilar P P, Wetter V,. Separation of virus-like particles and extracellular vesicles by flow-through and heparin affinity chromatography [J]., 2019, 1588: 77-84.
[32] Kosanovi? M, Milutinovi? B, Go? S,. Ion-exchange chromatography purification of extracellular vesicles [J]., 2017, 63(2): 65-71.
[33] Davies R T, Kim J, Jang S C,. Microfluidic filtration system to isolate extracellular vesicles from blood [J]., 2012, 12(24): 5202-5210.
[34] Morales-Kastresana A, Musich T A, Welsh J A,. High-fidelity detection and sorting of nanoscale vesicles in viral disease and cancer [J]., 2019, 8(1): 1597603.
[35] Wunsch B H, Smith J T, Gifford S M,. Nanoscale lateral displacement arrays for the separation of exosomes and colloids down to 20 nm [J]., 2016, 11(11): 936-940.
[36] Doyle L M, Wang M Z. Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosome isolation and analysis [J]., 2019, 8(7): 727.
[37] 高文靜. 黃芪囊泡樣納米顆粒的藥效學初步研究 [D]. 北京: 中國中醫科學院, 2021.
[38] B?ing A N, van der Pol E, Grootemaat A E,. Single-step isolation of extracellular vesicles by size-exclusion chromatography [J]., 2014, 3: 23430.
[39] Li Z F, Wang H Z, Yin H R,. Arrowtail RNA for ligand display on ginger exosome-like nanovesicles to systemic deliver siRNA for cancer suppression [J]., 2018, 8(1): 14644.
[40] Teng Y, Ren Y, Sayed M,. Plant-derived exosomal microRNAs shape the gut microbiota [J]., 2018, 24(5): 637-652.
[41] Zhang M Z, Viennois E, Prasad M,. Edible ginger-derived nanoparticles: A novel therapeutic approach for the prevention and treatment of inflammatory bowel disease and colitis-associated cancer [J]., 2016, 101: 321-340.
[42] Zhang M Z, Xiao B, Wang H,. Edible ginger-derived nano-lipids loaded with doxorubicin as a novel drug-delivery approach for colon cancer therapy [J]., 2016, 24(10): 1783-1796.
[43] Zhuang X Y, Deng Z B, Mu J Y,. Ginger-derived nanoparticles protect against alcohol-induced liver damage [J]., 2015, 4: 28713.
[44] Zhang L, He F J, Gao L N,. Engineering exosome-like nanovesicles derived fromcan inhibit the proliferation of hepatocellular carcinoma cells with better safety profile [J]., 2021, 16: 1575-1586.
[45] Gao C F, Zhou Y Y, Chen Z J,. Turmeric-derived nanovesicles as novel nanobiologics for targeted therapy of ulcerative colitis [J]., 2022, 12(12): 5596-5614.
[46] Cho E G, Choi S Y, Kim H,.-derived extracellular vesicles facilitate anti-senescence effects in human skin cells: An eco-friendly and sustainable way to use ginseng substances [J]., 2021, 10(3): 486.
[47] Cao M, Yan H J, Han X,. Ginseng-derived nanoparticles alter macrophage polarization to inhibit melanoma growth [J]., 2019, 7(1): 326.
[48] 劉恬佳, 邱智東, 邱野, 等. 人參根外泌體的提取、表征及其對多柔比星誘導的心肌損傷保護作用機制 [J]. 中草藥, 2021, 52(12): 3514-3521.
[49] 盧姝言, 楊松, 任李梅, 等. 人參外泌體促進HaCat細胞增殖和傷口愈合 [J]. 中國生物化學與分子生物學報, 2021, 37(11): 1510-1519.
[50] Yang L, Jin W Q, Tang X L,. Ginseng-derived nanoparticles inhibit lung cancer cell epithelial mesenchymal transition by repressing pentose phosphate pathway activity [J]., 2022, 12: 942020.
[51] Li X Y, Liang Z, Du J C,. Erratum to: Herbal decoctosome is a novel form of medicine [J]., 2020, 63(9): 1428.
[52] 李思敏, 何鳳軍, 秦琳茜, 等. 藥食兩用植物細胞外囊泡樣納米粒的制備和性能研究 [J]. 藥學學報, 2021, 56(8): 2086-2092.
[53] Zeng L P, Wang H Y, Shi W H,.derived nanovesicle as a functional carrier for indocyanine green encapsulation and phototherapy [J]., 2021, 19(1): 439.
[54] Kim M K, Choi Y C, Cho S H,. The antioxidant effect of small extracellular vesicles derived frompeels for wound healing [J]., 2021, 18(4): 561-571.
[55] 任永申, 梅之南, 李燕, 等. 一種地黃外泌體及其制備方法和應用: 中國, CN 110302278B [P]. 2021-12-24.
[56] Woith E, Melzig M F. Extracellular vesicles from fresh and dried plants-simultaneous purification and visualization using gel electrophoresis [J]., 2019, 20(2): 357.
[57] Winkler K, Leneweit G, Schubert R. Characterization of membrane vesicles in plant extracts [J]., 2005, 45(2): 57-65.
[58] Théry C, Zitvogel L, Amigorena S. Exosomes: Composition, biogenesis and function [J]., 2002, 2(8): 569-579.
[59] 王立志, 劉路寬, 劉晶. 外泌體分離與純化技術研究進展 [J]. 化學通報, 2021, 84(10): 1023-1030.
[60] Aimaletdinov A M, Gomzikova M O. Tracking of extracellular vesicles' biodistribution: New methods and approaches [J]., 2022, 23(19): 11312.
[61] 喬宏志, 陳熹, 陳軍, 等. 基于結構中藥學思維的中藥研究方法探討——以外用中藥為例 [J]. 南京中醫藥大學學報, 2022, 38(11): 970-975.
[62] Chen X Y, Zhou Y, Yu J J. Exosome-like nanoparticles from ginger rhizomes inhibited NLRP3 inflammasome activation [J]., 2019, 16(6): 2690-2699.
[63] Yamada Y. Nucleic acid drugs-current status, issues, and expectations for exosomes [J]., 2021, 13(19): 5002.
[64] Luo G, Cheng B C, Zhao H,.lignans suppresses the production of inflammatory mediators regulated by NF-κB, AP-1, and IRF3in lipopolysaccharide-stimulated RAW264.7 cells [J]., 2018, 23(12): 3319.
[65] Kempski J, Huber S. Role of the gut microbiome in the pathogenesis and treatment of inflammatory bowel diseases [J]., 2022, 63(10): 1022-1027.
[66] Sung H, Ferlay J, Siegel R L,. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2021, 71(3): 209-249.
[67] Wei L, Wang Z Y, Jing N C,. Frontier progress of the combination of modern medicine and traditional Chinese medicine in the treatment of hepatocellular carcinoma [J]., 2022, 17(1): 90.
[68] Xiang Y N, Guo Z M, Zhu P F,. Traditional Chinese medicine as a cancer treatment: Modern perspectives of ancient but advanced science [J]., 2019, 8(5): 1958-1975.
[69] Chun J, Cheon M, Moon B,. Anti-tumor activity of the ethyl acetate fraction fromin HepG2-xenografted nude mice [J]., 2012, 54: 538-543.
[70] Mathiyalagan R, Yang D C. Ginseng nanoparticles: A budding tool for cancer treatment [J]., 2017, 12(10): 1091-1094.
[71] 胡克新, 韓麗敏. 主要抗衰老藥物的研究進展 [J]. 生命的化學, 2021, 41(9): 1891-1899.
[72] 鐘鈺, 鄭琴, 胡鵬翼, 等. 植物精油抗衰老的藥理作用與機制的研究進展 [J]. 中草藥, 2019, 50(22): 5584-5590.
[73] Sun Z X, Hou X M, Zhang J X,. Diagnostic and therapeutic roles of extracellular vesicles in aging-related diseases [J]., 2022, 2022: 6742792.
Research progress on medicinal plant-derived extracellular vesicles as novel pharmacodynamic substances
SU Yong-hui1, 2, XU Shan-shan1, 2, WANG Huan1, LI Tai-ping1, WANG Song-song1, TIAN Qing-ping2, HAN Li-wen1
1. School of Pharmacy and Pharmaceutical Sciences, Shandong First Medical University & Shandong Academy of Medical Sciences, Jinan 250000, China 2. School of Pharmaceutical Science, Shanxi Medical University, Taiyuan 030001, China
Medicinal plant-derived extracellular vesicles (MPEVs) are nanoscale membrane vesicles loaded with functional substances such as small molecules, nucleic acids, proteins and lipids secreted by cells in particular parts of medicinal plants. Due to the presence of active substances from their homologous plants, MPEVs possess unique biological activity. As a result, the isolation and purification, identification, compositional analysis, and biological activity of MPEVs in recent years are summarized and analyzed in this review to provide reference and insight for in-depth research of MPEVs as novel pharmacological substances.
extracellular vesicles; medicinal plant-derived extracellular vesicles; biological activity; anti-tumor; anti-aging
R283;R285
A
0253 - 2670(2023)12 - 4044 - 09
10.7501/j.issn.0253-2670.2023.12.030
2023-01-16
中央本級重大增減支項目(2060302-1907-09);山東第一醫科大學學術提升計劃(2019LJ003)
蘇勇匯(1998—),碩士研究生,研究方向為細胞外囊泡藥效學及應用。Tel: 15135368492 E-mail: 2436044732@qq.com
通信作者:韓利文(1980—),博士,副研究員,從事藥物篩選及中藥質量控制研究。Tel: (0531)59567223 E-mail: hanliwen08@126.com
田青平(1966—),博士,教授,從事藥物制劑研究。Tel: (0351)3985245 E-mail: tianqp123456@163.com
[責任編輯 趙慧亮]

