乳酸上調非小細胞肺癌細胞中總膽固醇水平的機制研究
黃登亮,張耀剛,侯靜,田美媛,江源,孫莉,李志琴,童思賢,鄭凱曼,姜軍
1 青海大學附屬醫院,青海西寧 810000;2 青海大學研究生院,青海西寧 810000
肺癌是全球范圍內發病率(11.4%)僅次于乳腺癌(11.7%),但病死率(18%)最高的惡性腫瘤[1]。在我國,肺癌新增病例和死亡病例均居惡性腫瘤之首[2]。非小細胞肺癌(non-small cell lung cancer,NSCLC)約占所有肺癌的80%;大多數NSCLC 患者就診時已處于中晚期,預后較差。21 世紀以來,在NSCLC 治療方面,靶向治療和免疫治療取得了較大進展[3-6],但肺癌的診療仍需新的突破。代謝重塑是腫瘤細胞的重要特征之一,研究發現腫瘤組織中膽固醇水平升高[7],且高膽固醇含量與腫瘤細胞耐藥性有關[8],抑制膽固醇合成可以減弱肺癌細胞耐藥性[9]。膽固醇是由乙酰輔酶A 經過復雜的生化反應合成的脂質,在機體生命活動中具有重要作用;雖然膽固醇水平的調節途徑已很明確,但其影響因素仍有很大探索空間。乳酸蓄積是實體瘤的重要特點之一,腫瘤組織中乳酸濃度可高達20~ 30 mmol/L。研究顯示,乳酸可促進人NSCLC 和小鼠肺癌進展并參與調節人非小細胞肺癌細胞糖酵解和線粒體代謝[10],且能誘導內質網中Mg2+釋放進而參與急性炎癥過程中的組織損傷[11]。研究表明,乳酸通過組蛋白乳酸化或乙酰化修飾引起細胞基因表達和細胞表型變化[10,12-14],還促進Treg 細胞中PD-1 表達,但具體分子機制不明[15]。因此,乳酸可作為代謝底物、信號分子和表觀遺傳修飾因子,在細胞生物學過程中發揮重要調節作用。本研究將探索乳酸是否會通過組蛋白乳酸化修飾或其他方式調節NSCLC 細胞中膽固醇水平,擬揭示膽固醇水平新的調節機制和乳酸的功能,為肺癌治療探索新的思路。
材料與方法
1 實驗細胞 人肺支氣管上皮細胞BEAS-2B、非小細胞肺癌細胞A549 和H1299 購自中國科學院細胞庫,用含10%胎牛血清的RPMI 1640 培養基培養于37℃、5% CO2、95%濕度的培養箱中。
2 實驗試劑和儀器 RPMI 1640 培養基(Gibco,23400-021),胰蛋白酶(Gibco,27250-018),胎牛血清(Biological Industries,04-001-1ACS),乳酸(Sigma-Aldrich,L6402),辛伐他汀(Sigma-Aldrich,PHR1438-1G),草氨酸鈉(默克,o2751),qPCR 試劑SYBR Green (Roche,0491850001),乳酸化組蛋白一抗H4 (Lys8) (景杰生物,PTM-1405),Protein G Agarose Beads (Cell Signaling Techonology,#37478),逆轉錄試劑盒(北京全式金生物,AT311),總膽固醇測定試劑盒(索萊寶科技有限公司,BC1985),Light Cycler 480 Ⅱ qPCR 儀(Roche),Cytation 5 細胞成像分析系統(BioTek)。
3 外源乳酸干預培養細胞 接種細胞,待細胞匯合度達到約80%時加乳酸處理,乳酸母液濃度為1 mol/L,工作濃度有0 mmol/L、5 mmol/L、7.5 mmol/L 和10 mmol/L。提取RNA、細胞內總膽固醇含量測定和染色質免疫共沉淀的細胞樣品,分別在6 孔板、6 cm 培養皿和10 cm 培養皿中處理,處理時間均為24 h。
4 細胞總膽固醇含量測定 將細胞收集在異丙醇中(5×106個細胞使用1 mL 異丙醇),冰浴條件下超聲波破碎細胞(功率300 W,超聲2 s,間隔3 s,總時間2 min),4℃下10 000 g 離心10 min,取上清置于冰上待測。按總膽固醇測定試劑盒說明書配好標準品和工作液后,配制反應體系并充分混勻,37℃靜置 15 min,反應完成后用酶標儀測定500 nm 處吸光值,通過標準品和待測樣品的吸光值分析得到樣品中總膽固醇含量。實驗中設置復孔進行細胞計數或蛋白量測定,對膽固醇含量測定結果進行標準化。
5 qPCR 分析HMGCR、SQLE、FDPS 和GGPS1基因的mRNA 水平 取3 μg 總RNA 用于逆轉錄,逆轉錄產物稀釋5 倍后進行qPCR 分析。反應體系15 μL:Roche Fastessential 7.5 μL、逆轉錄產物2 μL、正反向引物(10 μmol/L)各0.75 μL、ddH2O 4 μL。反應程序參照試劑說明書,qPCR 引物序列見表1。
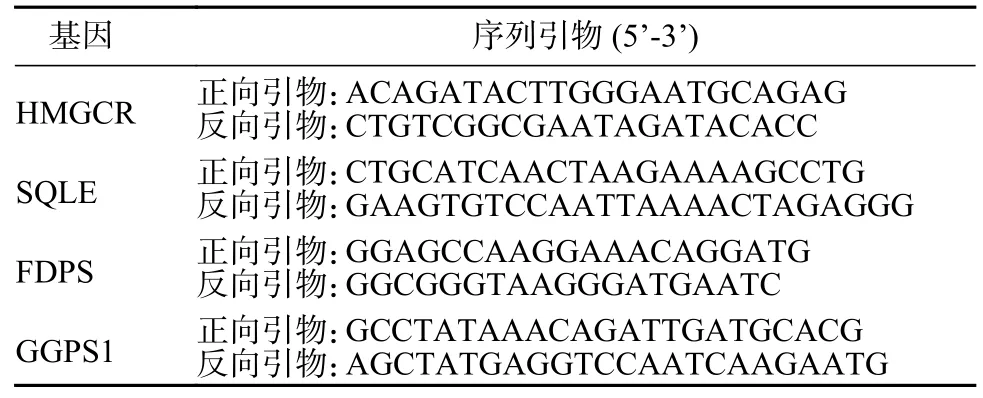
表1 HMGCR、SQLE、FDPS 和GGPS1 基因的qPCR 引物Tab.1 qPCR primers for HMGCR,SQLE,FDPS and GGPS1 genes
6 ChIP 分析HMGCR、SQLE 和GGPS1 基因啟動子區的組蛋白乳酸化水平 將對照組和乳酸處理組A549 細胞用含1%甲醛的PBS 在室溫交聯15 min,然后用0.125 mol/L 甘氨酸終止交聯;裂解細胞并用超聲破碎法斷裂基因組DNA,形成約500 bp 的片段;把基因組被打斷的細胞裂解產物分為兩份,分別加入2 μg 乳酸化組蛋白抗體和對應種屬IgG、Protein G-Agarose 凝膠,在4℃垂直混旋儀孵育過夜;用洗滌緩沖液依次洗滌Protein G-Agarose 凝膠后,將蛋白-DNA 復合體洗脫并解交聯;抽提純化DNA 后進行PCR 及瓊脂糖凝膠電泳分析。目的基因啟動子區PCR 引物見表2。

表2 HMGCR、SQLE 和GGPS1 基因啟動子的ChIP PCR 引物Tab.2 ChIP PCR primers for promoters of HMGCR,SQLE and GGPS1 genes
7 統計學方法和TCGA 數據分析 利用SPSS 19.0 進行數據統計。計量資料符合正態分布與方差齊性以±s表示,兩組間比較采用獨立樣本t檢驗,多組間比較采用單因素方差分析,進一步兩兩比較采用Tukey’s 檢驗;將TCGA 數據庫中肺鱗癌按乳酸脫氫酶A (lactate dehydrogenase A,LDHA)表達水平由低到高分為LDHA 低表達組(前40%)和LDHA 高表達組(后40%),Wilcoxon 秩和檢驗分析ACAT1、ACAT2、HMGCR、FDFT1和SQLE 在兩組間的表達差異性。檢驗水準為雙側α=0.05。
結果
1 肺鱗癌中乳酸代謝影響膽固醇合成代謝酶基因表達 TCGA 數據庫中數據集分析結果顯示,LDHA 高表達的肺鱗癌,膽固醇合成途徑中HMGCR (圖1A)、ACAT1 (圖1B)、ACAT2 (圖1C)、SQLE (圖1D)和FDFT1 (圖1E)基因mRNA 水平均上升(P<0.05)。以上結果提示,肺鱗癌中乳酸含量和膽固醇水平存在關聯。
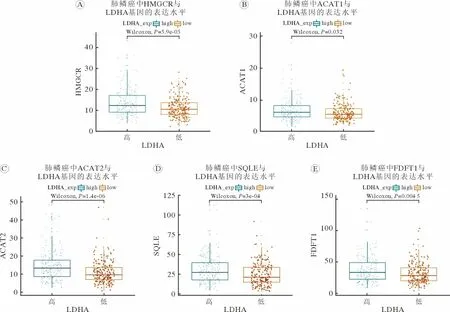
圖1 LDHA 高表達的NSCLC 中膽固醇合成代謝酶基因表達上調參與膽固醇生物合成途徑的代謝酶HMGCR (A)、ACAT1 (B)、ACAT2 (C)、SQLE (D)和FDFT1 (E)在不同LDHA 表達水平NSCLC 中的表達差異性Fig.1 Expression levels of genes involved in cholesterol biosynthesis increased in LDHA up-regulated NSCLC Expression levels of genes involved in cholesterol biosynthesis including HMGCR (A),ACAT1 (B),ACAT2 (C),SQLE (D) and FDFT1(E) in NSCLC with different LDHA expression levels
2 乳酸上調細胞內總膽固醇水平和膽固醇合成代謝酶基因轉錄 相比對照組細胞,用含10 mmol/L乳酸的培養基處理48 h后,BEAS-2B(圖2 A)、A549(圖2B)和H1299 (圖2C)細胞內總膽固醇水平升高(P<0.01)。并且,含7.5 mmol/L 乳酸的培養基處理的BEAS-2B 和A549 細胞中HMGCR (圖2D)、FDPS (圖2E)、GGPS1 (圖2F)和SQLE (圖2G)基因的mRNA 水平升高(P<0.01)。以上結果提示,乳酸可能通過激活膽固醇合成代謝酶基因轉錄而上調細胞內總膽固醇水平。
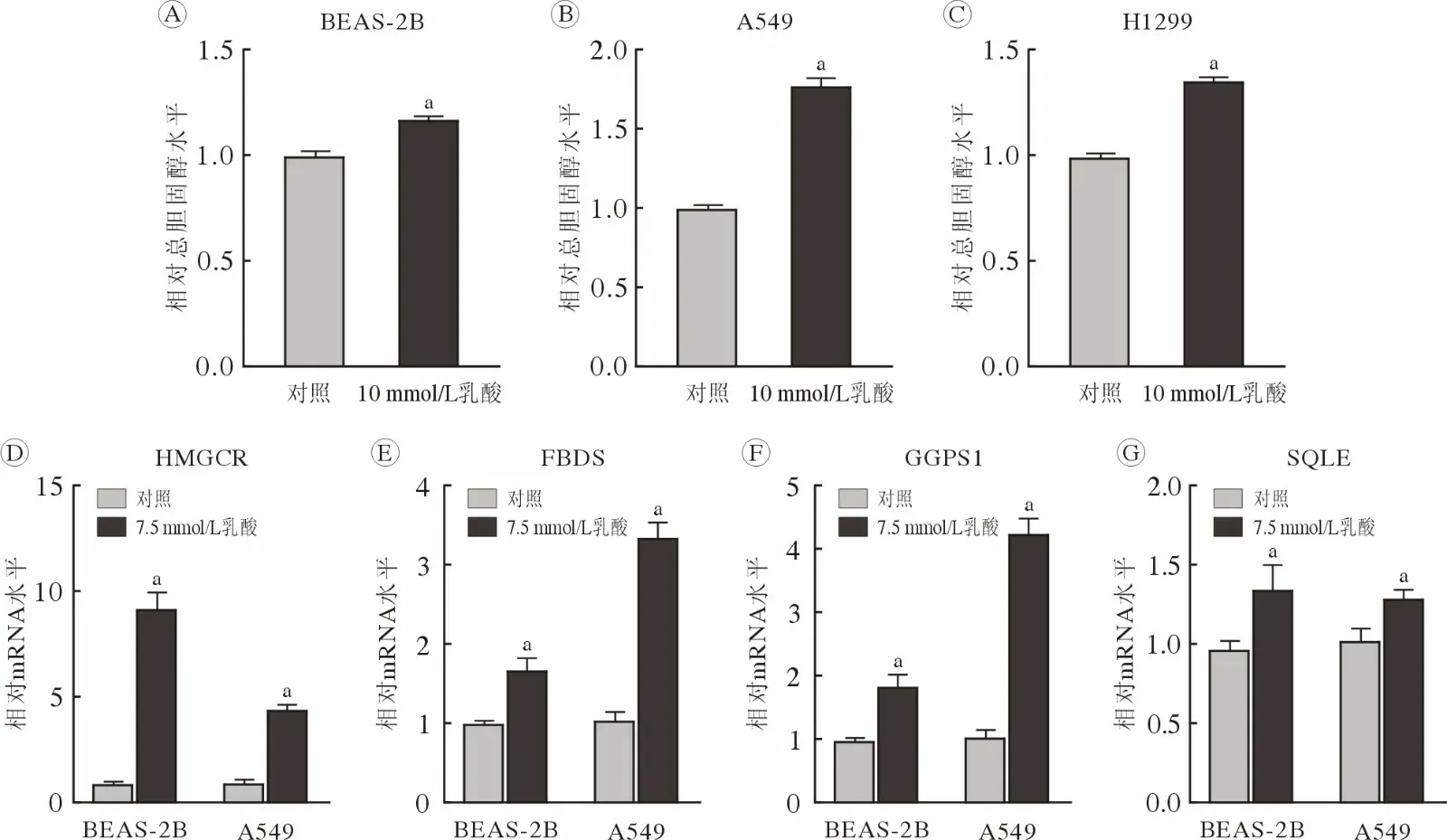
圖2 乳酸上調細胞內膽固醇水平及膽固醇合成代謝酶基因mRNA 水平乳酸處理后,BEAS-2B (A)、A549 (B)和H1299 (C)細胞內總膽固醇水平;BEAS-2B 和A549 細胞中膽固醇合成代謝酶HMGCR (D)、FDPS (E)、GGPS1 (F)、SQLE (G)基因mRNA 水平(aP<0.01,vs 對照)Fig.2 Lactate triggered an increase in intracellular cholesterol and mRNA levels of cholesterol biosynthesis-related genes The intracellular total cholesterol level in BEAS-2B (A),A549 (B) and H1299 (C) cells treated with or without lactate;mRNA levels of HMGCR (D),FDPS (E),GGPS1 (F),and SQLE (G) in BEAS-2B and A549 cells (aP<0.01,vs control)
3 乳酸對細胞內總膽固醇水平的上調作用不完全依賴于改變pH 為進一步探索乳酸是否完全依賴于降低pH 而使細胞內總膽固醇水平上調,用含7.5 mmol/L 乳酸的培養基和含鹽酸的培養基(pH與含7.5 mmol/L 乳酸的培養基相同)處理A549 細胞;結果顯示,乳酸和鹽酸處理組A549 細胞內總膽固醇水平升高(P<0.05)(圖3A),且HMGCR(圖3B)及FDFT1 (圖3C)基因的mRNA 水平也上升(P<0.01)。但與鹽酸處理組相比,乳酸處理組A549 細胞內總膽固醇水平以及HMGCR 和FDFT1的mRNA 水平上調更顯著(P<0.01),提示乳酸對細胞內總膽固醇水平及膽固醇合成代謝酶基因轉錄活性的上調作用不完全依賴于改變pH。
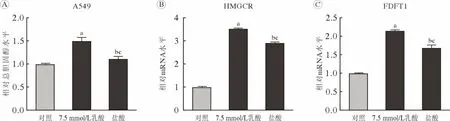
圖3 乳酸和鹽酸對A549 細胞內總膽固醇以及HMGCR 和FDFT1 基因mRNA 水平的影響正常培養的A549 細胞及乳酸和鹽酸處理的A549 細胞內總膽固醇水平(A)、HMGCR 基因mRNA 水平(B)和FDFT1 基因mRNA 水平(C)(aP<0.01,vs 對照;bP<0.05,vs 對照;cP<0.01,vs 7.5 mmol/L 乳酸)Fig.3 Influence of lactate and hydrochloric acid on intracellular total cholesterol as well as HMGCR and FDFT1 mRNA levels in A549 cells Intracellular total cholesterol level (A),mRNA levels of HMGCR (B) and FDFT1 (C) in control A549 cells and A549 cells treated with lactate or hydrochloric acid (aP<0.01,vs control;bP<0.05,vs control;cP<0.01,vs 7.5 mmol/L lactate)
4 乳酸可能通過表觀遺傳修飾或作為代謝底物上調細胞內總膽固醇水平 乳酸能夠通過組蛋白乳酸化修飾改變巨噬細胞基因表達及細胞表型,那么膽固醇合成代謝酶基因表達是否受組蛋白乳酸化修飾調節?染色質免疫共沉淀結果顯示,用含10 mmol/L 乳酸的培養基處理細胞A549 細胞后,HMGCR、SQLE 和GGPS1 啟動子區組蛋白乳酸化水平有升高趨勢(圖4A)。此外,乳酸能通過乳酸脫氫酶轉化為丙酮酸,丙酮酸可以在線粒體中生成草酰乙酸和乙酰輔酶A,兩者合成檸檬酸被轉運出線粒體進入胞質后,又裂合形成草酰乙酸和乙酰輔酶A,而胞質乙酰輔酶A 是膽固醇等脂類的合成原料;乳酸是否會通過上述代謝途徑轉化為乙酰輔酶A 而促進膽固醇合成?使用草氨酸鈉抑制乳酸脫氫酶后,A549 細胞中乳酸對總膽固醇的上調作用被逆轉(圖4B)。以上結果提示,組蛋白乳酸化修飾調節可能上調細胞內膽固醇合成代謝酶基因轉錄活性,并且乳酸也可能通過細胞內代謝轉化為乙酰輔酶A,促進膽固醇合成。

圖4 乳酸調節細胞內總膽固醇水平的可能機制A:正常培養的A549 細胞及乳酸處理的A549 細胞中HMGCR、SQLE 和GGPS1 基因啟動子區組蛋白乳酸化水平;B:正常培養的A549 細胞及乳酸和草氨酸鈉處理的A549 細胞內總膽固醇水平(aP<0.01,vs 對照;bP<0.01,vs 10 mmol/L 乳酸)Fig.4 The possible role of lactate in regulating intracellular total cholesterolHistone lactylation within HMGCR,SQLE and GGPS1 promoters in A549 cells treated with or without lactate (A);Intracellular total cholesterol in A549 cells with the indicated treatment (B) (aP<0.01,vs control;bP<0.01,vs 10 mmol/L lactate)
討論
在我國,肺癌新增病例和死亡病例均居惡性腫瘤之首,NSCLC 約占所有肺癌病例的80%,而乳酸和膽固醇在NSCLC 中代謝異常并參與疾病進展;本研究發現乳酸能夠上調NSCLC 細胞內總膽固醇水平。TCGA 數據分析結果顯示,LDHA 高表達的NSCLC中,參與膽固醇合成的代謝酶基因HMGCR、ACAT1、ACAT2、SQLE 和FDFT1 mRNA 水平上調(圖1),提示乳酸與膽固醇合成存在關聯。與正常培養的BEAS-2B、A549 和H1299細胞系相比,用乳酸處理的BEAS-2B、A549 和H1299 細胞中總膽固醇水平升高(圖2A~ 圖2C),且BEAS-2B 和A549 細胞中膽固醇合成代謝酶基因HMGCR、FDPS、GGPS1 和SQLE (圖2D~圖2G) mRNA 水平升高,提示乳酸通過促進膽固醇合成代謝酶基因表達而上調NSCLC 細胞內總膽固醇水平。
有研究報道乳酸通過降低pH 引起SREBP2 活化而上調膽固醇合成代謝酶基因轉錄和膽固醇水平[16],而本研究結果顯示低pH 可引起膽固醇水平升高,用鹽酸模擬乳酸引起的低pH 對膽固醇水平的調節作用較乳酸弱(圖3),說明乳酸還通過不依賴于改變pH 的途徑上調細胞內膽固醇水平。染色質免疫共沉淀結果顯示,乳酸處理組A549 細胞中HMGCR、SQLE 和GGPS1 基因啟動子區組蛋白乳酸化水平有升高趨勢(圖4A),但此結果不能確定組蛋白乳酸化修飾是否為乳酸上調膽固醇合成代謝酶基因的直接因素;HDAC1 和HDAC3 具有去乳酸化修飾功能[17],后續研究將用乳酸處理過表達HDAC1 和HDAC3 的A549 細胞,在抑制組蛋白乳酸化修飾的條件下,充分研究組蛋白乳酸化修飾對膽固醇合成代謝酶基因表達的影響。此外,乳酸經乳酸脫氫酶轉化為丙酮酸后在線粒體內合成檸檬酸,線粒體檸檬酸被轉運到細胞之后裂解生成乙酰輔酶A[14],而細胞質乙酰輔酶A 是膽固醇合成的原料;因此,乳酸也可能通過細胞內代謝轉化為乙酰輔酶A 而參與膽固醇合成。本研究中,用草氨酸鈉抑制乳酸脫氫酶可以減弱外源乳酸對A549 細胞內總膽固醇水平的上調作用(圖4B),說明草氨酸鈉可能通過阻斷乳酸轉化為乙酰輔酶A 的代謝過程而使細胞內總膽固醇水平降低。
綜上所述,本研究表明乳酸能夠上調NSCLC細胞內總膽固醇水平,并經初步探索發現,乳酸可能通過促進膽固醇合成代謝酶基因表達和轉化為膽固醇合成底物乙酰輔酶A 兩條途徑上調細胞內膽固醇水平,揭示了細胞內膽固醇水平新的調節機制。NSCLC 中膽固醇含量升高[7],且高膽固醇含量能增強A549、H1650、H1299 等NSCLC 細胞系對EGFR 抑制劑的耐藥性[9];他汀類等阻斷細胞內膽固醇合成藥物已被用于NSCLC 等腫瘤的治療臨床試驗和治療[18-19]。本研究揭示的乳酸上調細胞內膽固醇水平的調節過程,有望提供新的抗腫瘤藥物靶點,其靶向藥物可能提高現有膽固醇合成阻滯劑對NSCLC 的療效。
作者貢獻姜軍:課題構思;江源、侯靜:TCGA 數據分析;張耀剛、田美媛:染色質免疫共沉淀;孫莉、李志琴:定量PCR;童思賢、鄭凱曼:膽固醇測定;黃登亮:匯總數據并撰寫初稿。
利益沖突所有作者同意文章發表,并聲明不存在利益沖突。
數據共享聲明不進行數據共享。

