臨床濃度的依托咪酯對脊髓腹角神經元GABA和甘氨酸電流的作用
甄 騁,靳 娜,楊鑫宇,李 妍,儲婉玉,張環環,徐愛萍,鄭 超
(皖南醫學院 1.神經生物學研究室;2.細胞電生理研究室;3.心理生理學研究室,安徽 蕪湖 241002)
依托咪酯(Etomidate,ET)是一種臨床上廣泛使用的全身麻醉藥。目前,ET全麻作用中樞機制的相關研究均提示增強γ-氨基丁酸(γ-aminobutyric acid,GABA)能系統在ET抑制神經元興奮性的作用中占據主導地位[1]。甘氨酸(Glycine,Gly)和GABA是中樞神經系統中主要的兩種抑制性神經遞質。GABA在中樞神經系統中分布廣泛,Gly則主要在脊髓和腦干中發揮作用[2]。大量的脊髓中間神經元通過釋放GABA支配脊髓運動神經元[3]。在脊髓水平上,促離子型GABA受體能夠調節運動神經元的興奮性[4],而Gly受體也發揮一定程度的協同作用[5]。本研究采用脊髓腹角神經元急性分離聯合穿孔膜片鉗實驗記錄技術,研究臨床濃度ET對Gly電流和GABA電流的幅度及動力學指標的影響,從而為指導臨床麻醉用藥提供科學依據。
1 材料和方法
1.1 實驗動物 本研究采用1~2周齡的新生Sprague-Dawley(SD)乳大鼠,雌雄不拘,由合肥市廬江縣白湖博源實驗用品銷售部提供。動物合格證號碼SCXK(魯):2019-0003。本研究的所有操作過程遵循皖南醫學院實驗動物飼養和使用的規章條例。
1.2 實驗溶液及藥品 參考前期實驗相關工作[6-8],配制人工腦脊液(ACSF)配方(mmol/L):124.0 NaCl、24.0 NaHCO3、5.0 KCl、1.2 KH2PO4、2.4 CaCl2、1.3 MgSO4、10.0 Glucose,通入混合氧(95%O2+5%CO2)使溶液pH為7.35~7.45,置于4℃冰箱保存備用;標準細胞外液(SS)配方(mmol/L):10.0 Glucose、10.0 HEPES、150.0 NaCl、5.0 KCl、1.0 MgCl2、2.0 CaCl2,用Tris-base調節pH至7.4,置于4℃冰箱保存備用;電極液配方(mmol/L):0.5 EGTA、120.0 K-gluconate、20.0 KCl、2.0 MgCl2、20.0 HEPES、2.0 Na2-ATP、0.5 Na-GTP,用KOH調節pH至7.26,置于-20℃冰箱保存備用;ACSF、SS和電極液均用去離子水(Pure Flex,ELGA Lab Water,UK)配制。細胞膜穿孔藥Amphotericin B(AB)配制:使用二甲基亞砜(DMSO)配制40 mg/mL母液濃度,實驗中使用濃度為200 μg/mL(與電極液混合后使用)。其他實驗藥品母液的配制:ET 0.03 mol/L,GABA 0.1 mol/L,Gly 0.1 mol/L。其中,ET溶解于DMSO,GABA和Gly溶解于去離子水,ET置于4℃冰箱保存備用,其他藥品置于-20℃冰箱保存備用。實驗中ET的使用濃度為3.0 μmol/L,相當于臨床濃度[9];GABA和Gly的使用濃度分別為0.1 mmol/L和30.0 μmol/L[6,10-11]。
1.3 脊髓腹角神經元的分離 將實驗動物麻醉后,分離出含腰骶膨大的脊髓,固定于浴碟內并注入冰水混合的ACSF,使用震蕩切片機切取厚度為300~500 μm的切片3~6片,轉移至室溫ACSF中孵育約35 min。之后,在33℃水浴鍋中使用木瓜蛋白酶(Papain,0.18 g/30 mL ACSF)溶液對脊髓切片酶解消化19~23 min,完成后緩沖約45 min,以上全過程不間斷向溶液中輸入混合氧。隨后,截取切片腹角一側,轉移至盛有預先通入氧氣的SS的培養皿中,機械吹打分離出單個神經元,用倒置顯微鏡(Leica DMI 3000B,Germany)觀察,選擇附著在培養皿底部的狀態良好的神經元進行后續實驗。
1.4 穿孔膜片鉗記錄 將培養皿中待記錄的脊髓腹角神經元移至顯微鏡視野中央,放置好給藥管。穿孔膜片鉗實驗應用電阻為5~10 MΩ的玻璃記錄電極(Sutter Instrument,Inc.,USA),由電極拉制儀(PC-10,NARISHIGE,Japan)拉制而成,注入電極液后借助微操縱儀(MP-225,Sutter Instrument,Inc.,USA)將電極尖端移至皿內液面下。用生物電信號放大器(MultiClamp 700B,Axon Instrument,Inc.,USA)對失調電位進行補償,使用微操縱儀控制電極靠近目標神經元至尖端與神經元接觸,下移電極至阻值上升約2 MΩ,給予負壓使電極電阻值逐漸上升至GΩ級。待細胞膜在穿孔藥作用下自動形成穿孔膜片鉗記錄模式。使用快速給藥系統(SF-77B,Warner Instrument Corporation,USA)進行溶液輸送和更換。
1.5 數據記錄形式 本實驗記錄的電生理數據經由生物電信號放大器和數模轉換器(Digidata 1550A,Axon Instrument,Inc.,USA)存入電腦,使用圖像采集軟件(LAS V3.8,Leica,Germany)截取顯微鏡下所見的神經元,運用Clampfit 10.6、Origin 5.0和SPSS 18.0軟件進行數據記錄、統計分析和圖像制作。實驗中記錄的上升時間(rise time,RT)指誘導出的電流的上升支從峰電流的10%升至90%所用的時間,衰減時間(decay time,DT)指電流的下降支從峰電流的90%降至10%所用的時間。
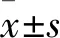
2 結果
2.1 分離的脊髓腹角神經元的形態 采用脊髓切片酶消化聯合腹角神經元急性分離法,利用圖像采集軟件拍攝,觀察到分離的神經元胞體大而透亮,具有多種形態以及多而完整的突起(圖1)。

A.橢圓形的神經元;B.梭形的神經元;C.三角形的神經元在鉗制時的狀態。圖中標尺為50 μm。
2.2 臨床濃度的ET對脊髓腹角神經元GABA電流幅度的作用 3.0 μmol/L的ET自身不能在脊髓腹角神經元上誘發出電流(圖2A)。但應用3.0 μmol/L的ET對記錄的神經元預處理2 min后,GABA(0.1 mmol/L)峰電流幅度增大至對照電流的(147.67±25.26)%,穩態電流幅度增大至對照電流的(171.26±23.27)%(P<0.01,圖2B、C)。

A.單獨應用臨床濃度的ET不能誘發電流;圖中箭頭指示峰電流(Peak)和穩態電流(Steady-state)的位置。B.典型記錄圖顯示ET對GABA峰電流和穩態電流具有可逆的增大作用;C.ET預處理2 min對GABA峰電流和穩態電流幅度影響的統計圖(n=4,FPeak=38.555,PPeak<0.001;FSteady-state=218.308,PSteady-state<0.001)。與GABA相比,**P<0.01;與GABA+ET相比,##P<0.01。
2.3 臨床濃度的ET對脊髓腹角神經元Gly電流幅度的影響 使用3.0 μmol/L的ET預處理2 min后,Gly(30.0 μmol/L)峰電流幅度增大至對照電流的(128.37±6.93)%,穩態電流幅度增大至對照電流的(119.41±4.82)%(P<0.01,圖3A、B)。

A.典型記錄圖顯示ET對Gly峰電流和穩態電流有可逆的增大作用;B.ET預處理2 min對Gly峰電流和穩態電流幅度影響的統計圖(n=4,FPeak=13.651,PPeak=0.006;FSteady-state=27.127,PSteady-state=0.001)。與Gly相比,**P<0.01;與Gly+ET相比,##P<0.01。
2.4 ET對GABA電流動力學指標的影響 將單用0.1 mmol/L GABA得到的電流曲線和使用3.0 μmol/L的ET預處理2 min后的GABA電流曲線重疊,能夠發現ET預處理2 min使GABA電流的RT縮短而DT延長:GABA電流的RT減小至對照電流的(58.35±6.10)%(P<0.01,圖4A、B),而DT則增大至對照電流的(162.26±14.58)%(P<0.01,圖4A、C)。

A.ET預處理前(灰色)、后(黑色)的GABA電流;B.ET對GABA電流上升時間影響的統計圖;C.ET對GABA電流衰減時間影響的統計圖(n=5,FRT=151.145,PRT<0.001;FDT=78.875,PDT<0.001)。與GABA相比,**P<0.01;與GABA+ET相比,##P<0.01。
2.5 ET對Gly電流動力學指標的影響 將使用3.0 μmol/L ET預處理前、后的Gly(30.0 μmol/L)電流曲線重疊,發現ET預處理2 min后使得Gly電流的RT縮短而DT延長:RT減小至對照電流的(72.53±6.19)%(P<0.01,圖5A、B),DT增大至對照電流的(113.68±7.47)%(P<0.01,圖5A、C)。

A.Gly電流(灰色)和ET預處理后的Gly電流(黑色)的比較;B.ET對Gly電流上升時間影響的統計圖;C.ET對Gly電流衰減時間影響的統計圖(n=5,FRT=29.015,PRT<0.001;FDT=10.185,PDT=0.006)。與GABA相比,**P<0.01;與GABA+ET相比,##P<0.01。
3 討論
脊髓是人體運動控制的初級中樞,運動神經元是全身麻醉藥發揮作用的主要靶點。有研究表明ET能夠以濃度依賴的方式抑制脊髓腹角神經元的自發放電[8],而ET在脊髓水平通過調制抑制性氨基酸受體發揮麻醉制動作用的研究則少有報道。目前,關于ET的作用主要聚焦于GABA能系統的研究[12],而對于ET的麻醉制動作用是否牽涉到Gly能系統尚不明確[13]。本研究結果表明ET對脊髓腹角神經元上的GABA和Gly誘發電流的峰電流成分、穩態電流成分、上升時間和衰減時間均有不同程度的影響,說明ET能夠通過影響GABA和Gly能系統發揮麻醉作用。
目前,類似于具有麻醉效果的酒精能夠同時影響N型乙酰膽堿受體(nAChR)介導電流的幅度和動力學特征[14],而ET能夠影響GABA和Gly受體介導峰電流和穩態電流的幅度,也影響其動力學指標。有研究表明,在大鼠脊髓背角神經元上ET能夠通過模擬GABA激活GABAA受體并調節該受體的功能,從而增強兩者結合后產生的效應[15]。ET與GABAA受體結合可能對受體的結構產生了影響,影響了受體與激動劑之間的親和力,導致動力學指標的改變[16]。
綜上所述,臨床濃度的ET在新生SD大鼠脊髓腹角神經元上,對GABA和Gly電流的峰電流成分、穩態電流成分均有增大作用。同時,ET對GABA和Gly電流的上升時間和衰減時間存在差異性作用。本研究結果表明GABA和Gly系統皆參與ET的麻醉制動作用,進一步揭示了ET麻醉作用的脊髓中樞機制,也為指導臨床上ET的科學合理使用,提供了新的研究基礎和理論依據。
有研究表明,神經系統發育成熟后,GABA能神經元會與發育時期存在功能上的轉變[17],因此,ET對于成年大鼠脊髓腹角神經元上GABA和Gly電流的作用與本研究結果是否一致,不同發育階段是否對ET的麻醉效果和機制產生影響?仍有待進一步探究。而GABA能系統和Gly能系統的交互作用是否參與ET的麻醉作用,從而實現ET在脊髓水平麻醉作用的調控,也需開展更深入的研究。

