ET-1、MMP-9、HB-EGF水平變化對ACS患者PCI術后預后的預測價值*
唐慶業,陳世雄,陳清華,張興建
儋州市人民醫院心血管內科,海南儋州 571700
急性冠狀動脈綜合征(ACS)是臨床常見心血管類疾病,由急性心肌缺血引起,根據心電圖表現可將其分為急性ST段和急性非ST段抬高型心肌梗死[1]。絕大多數ACS患者是冠狀動脈粥樣硬化斑塊不穩定的結果,極少數由動脈炎、外傷、血栓栓塞、心臟介入治療所致[2]。研究表明,ACS多見于老年男性,部分患者表現為胸痛、呼吸困難,有時會出現心律失常,嚴重者可因發生心力衰竭致死[3-4]。調查顯示,全球每年約700多萬人被診斷為ACS,發病人群呈年輕化趨勢[5]。近年來冠狀動脈粥樣硬化心臟病的介入治療技術突飛猛進,經皮冠狀動脈介入治療術(PCI)已成為治療ACS的常用手段,有利于降低患者病死亡率,但患者術后仍會出現支架內狹窄情況,影響預后[6]。內皮素-1(ET-1)是血管收縮調節因子,ET-1過量釋放可誘發血管內皮功能障礙[7]。基質金屬蛋白酶9(MMP-9)屬內肽,在氣道炎癥、血管生成中起重要作用,與ACS患者PCI術后支架內再狹窄的發生密切相關[8]。肝素結合性表皮生長因子(HB-EGF)可促進血管平滑肌增生、遷移,與心血管疾病患者PCI術后發生支架內在狹窄密切相關[9]。但目前關于ET-1、MMP-9、HB-EGF水平變化對預測ACS患者PCI術后預后情況的報道較少。本研究旨在探討ET-1、MMP-9、HB-EGF水平變化對ACS患者PCI術后預后的預測價值,現報道如下。
1 資料與方法
1.1一般資料 選取2020年5月至2021年5月本院收治并進行PCI術的150例ACS患者為研究對象。納入標準:(1)符合《急性冠狀動脈綜合征:理論與實踐最前沿》[10]中ACS的診斷標準,患者有持續性胸痛無緩解、出汗、心悸、心律失常,心電圖表現為ST段抬高或T波低水平;(2)3個月內無心臟外科、溶栓治療,符合并接受PCI治療。排除標準:(1)存在肝、腎功能異常并合并嚴重的心力衰竭、心肌疾病、自身免疫性疾病者;(2)存在急性嚴重感染及冠狀動脈旁路移植史者;(3)存在惡性腫瘤者。入選的150例患者中男82例,女68例;年齡55~70歲,平均(60.32±5.31)歲;體重指數20~26 kg/m2,平均(23.76±1.38)kg/m2;合并高血壓98例,糖尿病91例,高脂血癥80例,吸煙史88例,心絞痛史143例;單支血管病變39例,雙支血管病變51例,三支血管病變60例。本研究經醫學倫理委員會批準。所有患者均同意參與本研究。
1.2方法 采取所有患者空腹靜脈血5 mL,以3 000 r/min離心后取上清置于-80 ℃待測。ET-1檢測采用上海邦景ET-1 ELISA試劑盒,MMP-9檢測使用瑞番生物MMP9 ELISA檢測試劑盒,HB-EGF檢測采用臻科生物HB-EGF ELISA試劑盒。采用邁瑞全自動生化分析儀 BS-280檢測患者甘油三酯、總膽固醇、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C),采用超聲心動圖機測定其左室射血分數(LVEF)。
1.3隨訪 PCI術后對患者進行6個月隨訪,隨訪時間截至2022年4月或患者死亡。根據患者預后情況將其分為預后良好組和預后不良組。預后良好為患者在隨訪期間未發生心血管不良事件,預后不良為在隨訪期間患者發生心血管不良事件,包括心源性死亡、急性心肌梗死、頑固性心絞痛、靶血管再重建等。
1.4觀察指標 比較預后良好組、預后不良組患者性別、年齡、體重指數、合并癥、LVEF等指標,以及ET-1、MMP-9、HB-EGF水平。分析預后不良與血管病變支數、LVEF、ET-1、MMP-9、HB-EGF的相關性,ACS患者PCI術后預后不良因素。
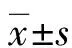
2 結 果
2.1預后情況 150例患者中,119例預后良好,占79.33%,31例預后不良,占20.67%,其中心源性死亡3例,急性心肌梗死15例,頑固性心絞痛9例,靶血管再重建4例。
2.2預后良好組、預后不良組臨床資料比較 預后不良組三支血管病變占比高于預后良好組(P<0.05),LVEF低于預后良好組(P<0.05)。見表1。
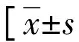
表1 預后良好組、預后不良組臨床資料比較或n(%)]
2.3預后良好組、預后不良組ET-1、MMP-9、HB-EGF水平比較 PCI術后,預后不良組ET-1、MMP-9、HB-EGF水平均高于預后良好組(P<0.05)。見表2。
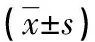
表2 預后良好組、預后不良組ET-1、MMP-9、HB-EGF水平比較
2.4預后不良與各指標的相關性分析 血管病變支數、ET-1、MMP-9、HB-EGF與預后不良呈正相關(r=0.675、0.495、0.586、0.628,P=0.001、0.022、0.016、0.013)。
2.5ACS患者PCI術后預后不良的Logistic回歸分析 多支血管病變數,以及ET-1、MMP-9、HB-EGF水平高是ACS患者PCI術后預后不良的危險因素(P<0.05)。見表3。

表3 ACS患者PCI術后預后不良的Logistic回歸分析
2.6ET-1、MMP-9、HB-EGF對ACS患者PCI術后預后的預測價值 ET-1、MMP-9、HB-EGF聯合檢測對ACS患者PCI術后6個月內預后的曲線下面積(AUC)為0.955,高于ET-1、MMP-9、HB-EGF單項檢測(P<0.05)。見表4。

表4 ET-1、MMP-9、HB-EGF對ACS患者PCI術后預后的預測價值
3 討 論
ACS是冠狀動脈在各種病變基礎上突然發生狹窄、痙攣,最終導致心肌缺血的一系列綜合征,該病常見原因為冠狀動脈內斑塊不穩定、破裂引起部分或者全部心肌缺血,嚴重者可發生猝死[11]。PCI作為治療ACS的常用手段,可降低患者病死率,但PCI本身會造成血管內皮損傷,還可發生支架內再狹窄,影響患者預后[12]。本研究中,150例PCI術后ACS患者隨訪時間內發生預后不良31例,預后良好119例,說明ACS患者行PCI治療效果良好,但患者術后出現心血管不良事件仍較多。
本研究結果顯示,PCI術后預后不良組ET-1、MMP-9水平均高于預后良好組,與預后不良呈正相關,二者均是ACS患者PCI術后預后不良的危險因素,提示ET-1、MMP-9可作為預測ACS患者PCI術后預后的指標。正常情況下,人體血清ET-1水平較低,但當機體出現心肌缺血缺氧時,受損血管內皮會釋放大量ET-1,最終導致心肌嚴重供血不足。ET-1也是目前公認的評價內皮細胞功能損傷的重要指標[13]。賀少輝等[14]研究顯示,ET-1在心肌梗死預后不良患者中的水平較高,ET-1可誘發動脈粥樣硬化,高ET-1能促進脂質斑塊形成,引起血栓,與預后不良呈正相關。尹銳等[15]研究認為,ACS患者經PCI治療后可有效恢復冠狀動脈血流及心肌灌注,但ACS患者血小板易發生聚集,PCI術后10%~26%患者可發生心血管不良事件。由于ACS患者行PCI治療容易引起血管內皮損傷,血管損傷可引起炎癥反應、血栓,導致MMP-9水平升高,最終引起血管在重建的預后不良情況。MMP-9是一種與缺血性腦卒中關系密切的水解酶,在血管、新生血管形成中起重要作用,研究顯示,MMP-9水平越高的缺血性腦卒中患者,其病死及重大傷殘率越大[16-17]。王蕊等[18]研究發現,MMP-9參與炎癥反應,而PCI治療可導致患者早期出現炎癥,經PCI治療后ACS患者MMP-9水平短期可出現升高。王全河等[19]研究顯示,冠心病患者PCI術后出現再狹窄的概率較高,術后支架內再狹窄患者MMP-9水平較高,MMP-9也是患者發生支架內再狹窄的危險因素。上述研究結果均與本研究結果相似。
HB-EGF屬炎癥因子,其生物功能廣泛,涉及心臟發育、心肌修復、切口愈合、腫瘤形成等過程,同時也可促進血管內膜增生、血管重建,加重動脈損傷。本研究結果顯示,HB-EGF水平是ACS患者PCI術后預后不良的危險因素,預后不良組患者HB-EGF水平高于預后良好組,提示HB-EGF可作為預測ACS患者PCI術后預后的指標。HB-EGF水平升高可促進PCI治療損傷的血管平滑肌細胞遷移,增加支架內再狹窄發生、預后不良風險。李高宇[20]研究表示,冠心病PCI術后發生支架內再狹窄患者HB-EGF水平升高,這是引起術后預后不良的原因之一。此外,本研究結果還顯示,血管病變支數與ACS患者PCI術后預后不良呈正相關,是患者預后不良的危險因素。鄭梅等[21]研究表示,多支血管病變患者重建概率非常低,可增加患者并發癥,預后較差,與本研究結果一致。
本研究還發現,ET-1、MMP-9、HB-EGF預測ACS患者PCI術后預后的AUC分別為0.819、0.889、0.825,而ET-1、MMP-9、HB-EGF聯合檢測ACS患者PCI術后預后的預測價值更高,AUC為0.955,高于單項預測(P<0.05)。但由于本研究樣本量較小,同時未對心源性死亡、急性心肌梗死、頑固性心絞痛、靶血管再重建等預后不良患者進行研究,結論難免存在偏倚,仍需臨床進行大樣本、多中心的研究加以驗證。
綜上所述,PCI術后預后不良ACS患者ET-1、MMP-9、HB-EGF呈高表達水平,上述指標聯合檢測對ACS患者PCI術后預后具有一定預測價值。

