miR-409-3p在肝癌HepG2細胞中的表達及其在細胞增殖中的作用機制
王長青 陳玲 徐萍 朱曉娟 劉政
摘要:目的本研究旨在明確miR-409-3p在肝癌細胞系中的表達及其意義,并探討可能的分子機制。方法利用實時熒光定量PCR的方法檢測miR-409-3p在正常肝細胞LO2,以及HepG2、BEL-7402、SMMC-7721、MHCC-97H四種肝癌細胞中的表達差異。陽離子脂質體法將miR-409-3p mimics及microRNA mimics control瞬時轉染至肝癌細胞株HepG2中,利用CCK8法、平板克隆、流式細胞術檢測miR-409-3p對體外癌細胞增殖、細胞周期及凋亡的影響。Western Blot檢測過表達miR-409-3p的HepG2細胞中c-Met蛋白的表達變化,熒光素酶報告系統鑒定靶向關系。計量資料兩組間比較采用成組t檢驗,多組間比較采用單因素方差分析,進一步兩兩比較采用SNK法。結果基于TCGA肝癌microRNA表達譜數據,肝癌組織中miR-409-3p的表達水平顯著低于癌旁組織(t=7.752,P<0.05)。與在LO2中的表達水平相比,miR-409-3p在HepG2、SMMC-7721、MHCC-97H、BEL-7402中的表達水平均明顯降低(F=31.043,P<0.05)。與miR-con組相比,轉染miR-409-3p mimics后的HepG2細胞中miR-409-3p的表達水平上升(t=-8.836,P<0.05),說明干擾有效。CCK8實驗結果顯示,與miR-con組相比,轉染miR-409-3p mimics后的HepG2細胞增殖能力在48、72、96 h明顯減弱,差異均具有統計學意義(t值分別為2.876、3.359、3.707,P值均<0.05)。平板克隆形成實驗顯示,miR-409-3p mimics組的細胞克隆形成率明顯低于miR-con組(t=2.846,P=0.047)。流式細胞術結果顯示,與miR-con組相比,過表達miR-409-3p后導致HepG2細胞G2期細胞數增多,差異具有統計學意義(t=-3.763,P<0.05);而凋亡率無明顯統計學差異(t=0.714,P=0.515)。熒光素酶報告系統鑒定結果顯示c-Met為miR-409-3p的靶基因(t=4.970,P=0.007)。與miR-con組相比,轉染miR-409-3p mimics的HepG2細胞中,c-Met蛋白表達水平下降(t=-8.509,P=0.001)。結論miR-409-3p通過抑制c-Met蛋白表達,進而調控下游信號通路引起細胞周期G2期阻滯,從而抑制肝癌HepG2細胞的增殖。關鍵詞:癌, 肝細胞; 微RNAs; 原癌基因蛋白質c-met; 細胞增殖
Expression of miR-409-3p in hepatoma HepG2 cells and its mechanism in cell proliferation
WANG Changqing CHEN Ling XU Ping ZHU Xiaojuan LIU Zheng(1. Department of Gastroenterology, Yancheng First Peoples Hospital, Yancheng, Jiangsu 224008, China; 2. Department of Gastroenterology, Nanjing Pukou Peoples Hospital, Nanjing 211899, China; 3. Medical Center for Digestive Diseases, The Second Affiliated Hospital of Nanjing Medical University, Nanjing 210011, China)
Corresponding author:LIU Zheng, liuzheng117@126.com (ORCID:0000-0002-2195-4538)
Abstract:ObjectiveTo investigate the expression and significance of miR-409-3p in hepatoma carcinoma cell lines and possible molecular mechanism. MethodsQuantitative real-time PCR was used to measure the expression of miR-409-3p in normal LO2 hepatocytes and four hepatoma cell line (HepG2, BEL-7402, SMMC-7721, and MHCC-97H). Hepatoma HepG2 cells were transiently transfected with miR-409-3p mimics and microRNA mimics control using the cationic liposome method, and then CCK8, plate colony formation assay, and flow cytometry were used to observe the effect of miR-409-3p on the proliferation, cell cycle, and apoptosis of hepatoma cells in vitro. Western blot was used to measure the change in the expression of c-Met protein in HepG2 cells with overexpression? of miR-409-3p, and luciferase reporter gene assay was used to identify targeting relationship. The independent-samples t test was used for comparison between two groups, and a one-way analysis of variance was used for comparison between multiple groups, followed by the SNK test. ResultsBased on the TCGA microRNA expression profile data of liver cancer, the expression level of miR-409-3p in liver cancer tissue was significantly lower than that in adjacent tissue (t=7.752, P<0.05). Compared with the LO2 cells, the HepG2, SMMC-7721, MHCC-97H, and BEL-7402 cells had a significant reduction in the expression level of miR-409-3p (F=31.043, P<0.05). Compared with the miR-con group, the HepG2 cells transfected with miR-409-3p mimics had a significant increase in the expression level of miR-409-3p (t=-8.836, P<0.05), suggesting that the interference was effective. CCK8 assay showed that compared with the miR-con group, the HepG2 cells transfected with miR-409-3p mimics had a significant reduction in proliferative capacity at 48, 72, and 96 hours (t=2.876, 3.359, and 3.707, all P<0.05). Plate colony formation assay showed that the miR-409-3p mimics group had a significantly lower plating efficiency than the miR-con group (t=2.846, P=0.047). Flow cytometry showed that compared with the miR-con group, overexpression of miR-409-3p resulted in the increased number of HepG2 cells in G2 phase (t=-3.763, P<0.05), while there was no significant difference in apoptosis rate (t=0.714, P=0.515). Luciferase reporter gene assay showed that c-Met was a target gene of miR-409-3p (t=4.970, P=0.007). Compared with the miR-con group, the HepG2 cells transfected with miR-409-3p mimics had a significant reduction in the expression of c-Met protein (t=-8.509, P=0.001). ConclusionBy inhibiting the protein expression of c-Met, miR-409-3p regulates downstream signaling pathways to induce cell cycle arrest in G2 phase and thus inhibits the proliferation of hepatoma HepG2 cells.
Key words:Carcinoma, Hepatocellular; MicroRNAs; Proto-Oncogene Proteins c-met; Cell Proliferation
肝細胞癌(HCC)的發生及發展包括一系列復雜的因素及步驟,涉及多個信號通路,探索HCC發生發展的分子機制,將有助于尋找其早期診斷的生物標志物及特異性的靶向藥物[1]。c-Met作為一種原癌基因于20世紀80年代被發現,其所編碼的c-Met蛋白是受體酪氨酸激酶家族成員[2]。研究[3]表明,在多種腫瘤中c-Met呈過表達,如肝癌、胃癌、結直腸癌、胰腺癌、肺癌、前列腺癌及乳腺癌等。本課題組前期以c-Met為研究對象,通過相關靶向治療方式抑制肝癌細胞的生長[4-5]。近年來相關研究[6-7]陸續揭示,miR-409-3p可通過下調c-Met信號通路發揮其抑癌基因作用。迄今為止,HCC中有關miR-409-3p對c-Met調控的相關研究未見報道。因此本實驗旨在研究miR-409-3p在HCC發生發展中的作用及其與c-Met相關的分子機制,期待從分子水平進一步探討HCC發生發展的機制,并以此為HCC的臨床診斷及靶向治療提供理論基礎。
1材料與方法1.1材料與試劑
1.1.1細胞株人正常肝細胞株LO2以及肝癌細胞株HepG2、BEL-7402、SMMC-7721、MHCC-97H均來自本實驗室保存。
1.1.2主要試劑和儀器RPMI 1640培養基、DMEM培養基、Opti-MEM培養基購自美國Gibco公司;胎牛血清(FBS)、胰酶購自美國Hyclone公司;總RNA提取試劑Trizol、Lipofectamine 2000購自美國Invitrogen公司;PrimeScript RT reagent Kit、SYBR Premix Ex Taq購自日本TaKaRa公司;hsa-miR-409-3p和U6引物由上海Invitrogen公司合成;CCK-8試劑盒購自日本同仁公司;吉姆薩工作液、RIPA蛋白裂解液購自上海碧云天生物技術有限公司;細胞周期分析試劑盒購自蘇州躍亞生物技術有限公司;Annexin V-EGFP凋亡檢測試劑盒、BCA蛋白含量檢測試劑盒購自南京凱基生物科技有限公司;蛋白Marker購自美國Thermo Scientific公司;ECL顯色劑、β-actin及c-Met抗體、羊抗兔二抗購自美國SAB公司;野生型( wild type,WT)和突變型( mutant,MUT) 熒光素酶報告載體由南京科佰生物科技有限公司構建;StepOnePlus實時熒光定量PCR儀購自美國Life Technologies公司;Clinibio 128c型自動酶標分析儀購自澳大利亞ASYS公司;流式細胞儀購自美國Becton Dickinson公司;聚偏二氟乙烯膜(PVDF膜)購自美國Millpore公司;電泳儀及轉膜儀購自美國Bio-Rad公司。
1.2實驗方法
1.2.1數據組基因數據來源:TCGA數據集(TCGAcohort)來源于TCGA數據庫(https://tcga-data.nci.Nih.gov/tega/),挑選出具有相應癌旁組織microRNA測序數據的肝癌組織microRNA測序數據進行分析,通過配對t檢驗對miR-409-3P在肝癌和癌旁中的表達進行差異驗證。
1.2.2細胞轉染及實驗分組LO2、HepG2、SMMC-7721、MHCC-97H、BEL-7402經培養后用于后續試驗。收集對數生長期肝癌HepG2細胞,胰蛋白酶消化,調整細胞濃度為1×105/mL,接種于96孔板(100 μL/孔),采用陽離子脂質體法分別將miR-409-3p mimics(miR-409-3p mimics組)、microRNA mimics control (miR-con組)轉染至HepG2細胞,嚴格按照Lipofectamine 2000轉染試劑說明書進行操作。
1.2.3實時熒光定量(qRT-PCR)檢測細胞中miR-409-3p表達水平采用Trizol法提取細胞總RNA并測定RNA濃度,按照逆轉錄試劑盒將RNA反轉錄為cDNA。以cDNA為模板進行qRT-PCR反應。以U6為內參,檢測各模板的Ct值。以Folds=2-ΔΔCt表示目的RNA在實驗組與對照組中表達的相對倍比關系。實驗重復3次,計算平均值。
1.2.4CCK8細胞增殖實驗收集各組對數生長期HepG2細胞接種于96孔板,每孔加入2×103個細胞,調整培養液至每孔體積100 μL,每組3個復孔,同時設僅加培養基的空白對照。分別培養24、48、72、96 h后每孔加入CCK8試劑10 μL于培養箱中孵育2 h。以空白孔為對照,酶標儀設置波長450 nm測定各孔吸光度值(OD值),各組取3個復孔平均值,以相對應的平均OD值表示細胞增殖能力的大小,繪制細胞增殖曲線。
1.2.5平板克隆形成實驗取對數生長期的各組轉染細胞,按每孔300個細胞接種至6孔板中,每組接種3個復孔,調整培養基體積為2 mL/孔后培養2周。當6孔板中出現肉眼可見的克隆時終止培養并洗滌干燥。每孔加入4%多聚甲醛1 mL固定細胞15~30 min,棄去固定液,加入適量吉姆薩工作液染色30 min后洗去染色液,空氣干燥。將6孔板倒置并疊加一張帶網格的透明薄片,顯微鏡下計數≥5個細胞的細胞團即為一個克隆數。平板克隆形成率=克隆數/接種細胞數×100%。
1.2.6流式細胞術檢測細胞周期及凋亡收集各組HepG2細胞,0.25%胰酶消化(1×106個細胞)離心,細胞沉淀轉移至流式管內,按照細胞周期檢測試劑盒方法進行操作,用300目尼龍篩網過濾混合液后上機檢測。收集流式管中1~5×105個細胞再次離心,棄去上清,按照細胞凋亡檢測試劑盒方法進行操作,輕輕混勻后上機檢測。
1.2.7蛋白免疫印跡(Western Blot)檢測c-Met蛋白表達取對數生長期HepG2細胞,加入適量含PMSF的裂解液,冰上裂解30 min,4 ℃條件下12 000 r/min離心30 min,吸取上清液并測蛋白濃度,取30 g蛋白樣品進行SDS-PAGE電泳反應,轉膜、封閉,孵育一抗(1∶1 000),4 ℃搖床內孵育過夜,TBST洗膜,加入二抗(1∶2 000),ECL顯影,使用軟件進行灰度掃描,以相應蛋白與β-actin的灰度比值作為蛋白的相對含量。
1.2.8熒光素酶報告基因檢測miR-409-3p的靶基因
構建含有3UTR端結合位點的WT c-Met熒光素酶報告載體,同時構建突變以后不含3UTR端結合位點的MUT c-Met熒光素酶報告載體,將WT c-Met、MUT c-Met分別同miR-409-3p mimics、microRNA mimics control轉染到肝癌細胞HepG2中,48 h后,用熒光素酶活性檢測試劑盒測定細胞熒光素酶活性變化。
1.3統計學方法采用SPSS 20.0統計軟件進行數據分析。計量資料以x±s表示,兩組間比較采用成組t檢驗,多組間比較采用單因素方差分析,進一步兩兩比較采用SNK法。P<0.05為差異有統計學意義。
2結果
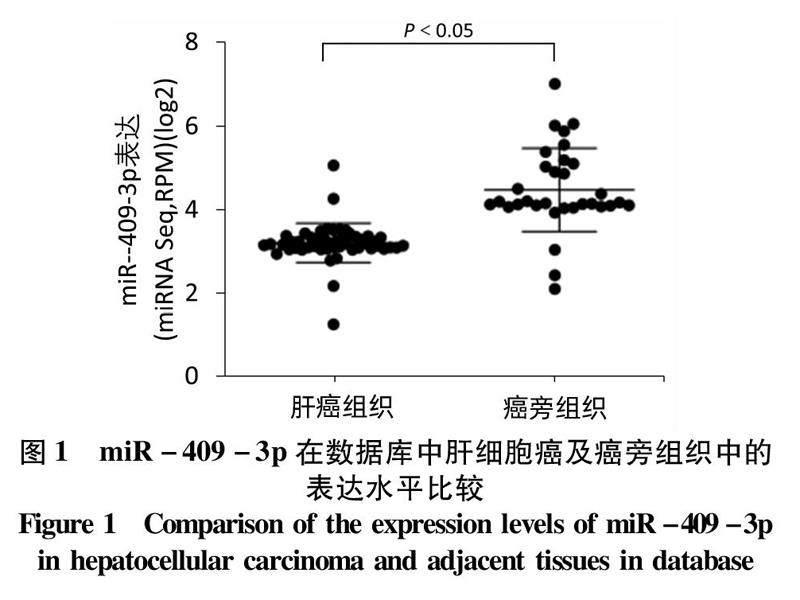
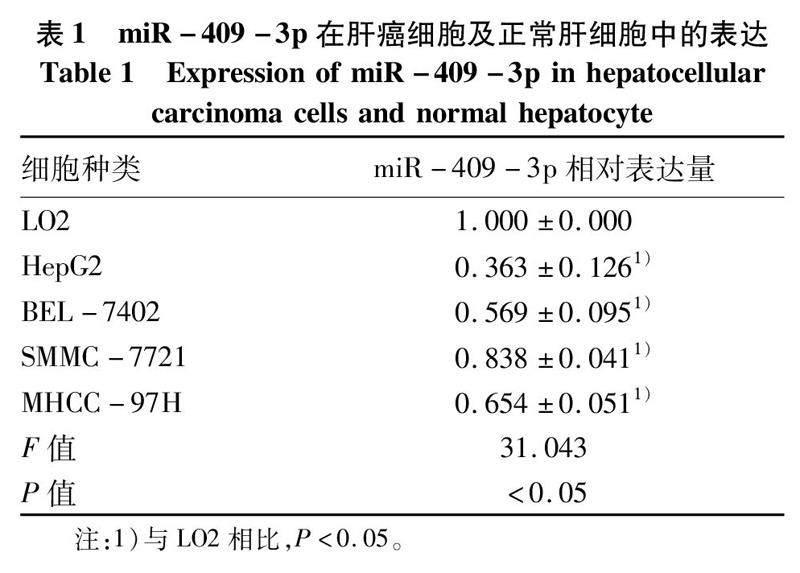
2.1miR-409-3p在肝癌中表達下調基于TCGA肝癌microRNA表達譜數據,分析肝癌及癌旁組織(53對)中miR-409-3p的表達水平發現,肝癌組織中miR-409-3p的表達顯著低于其在癌旁組織中的表達(t=7.752,P<0.05)(圖1)。qRT-PCR結果發現:以正常肝上皮細胞LO2為對照,miR-409-3p在4種肝癌細胞株中的表達水平均明顯低于LO2(P值均<0.05)(表1)。
2.2miR-409-3p mimics轉染后抑制HepG2細胞的增殖
2.2.1qRT-PCR鑒定miR-409-3p的表達采用熒光定量RT-PCR檢測轉染miR-409-3p mimics及miR-con兩組HepG2細胞中miR-409-3p的表達水平,結果顯示,miR-409-3p在mimics組中的表達水平明顯高于miR-con組(8.522±1.474 vs 1.000±0.000,t=-8.836,P<0.05)。
2.2.2CCK8細胞增殖及平板克隆形成實驗隨著培養時間的推移,與miR-con組相比,miR-409-3p mimics組的增殖速率逐漸下降,兩組在48、72及96 h比較差異均有統計學意義(P值均<0.05)(表2,圖2)。此外,對兩組轉染細胞進行平板克隆形成實驗(圖3)。結果顯示,連續培養14 d后,miR-con組和miR-409-3p mimics組的克隆形成率分別為0.650±0.076和0.470±0.079,miR-409-3p mimics組的細胞克隆形成率明顯低于miR-con組(t=2.846,P=0.047)。
2.2.3miR-409-3p mimics轉染對HepG2細胞周期的影響流式細胞儀分析結果顯示,與miR-con組相比,miR-409-3p mimics組細胞G2期百分比明顯增多(P<0.05)(圖4,表3)。結果表明,過表達miR-409-3p可以誘導肝癌HepG2細胞G2期阻滯。
2.2.4miR-409-3p mimics轉染對HepG2細胞凋亡的影響流式細胞儀分析結果顯示,miR con組的凋亡率為9.47%±2.26%,miR-409-3p mimics組的凋亡率為8.30%±1.71%(圖5),與miR-con組相比,miR-409-3p mimics組細胞凋亡無明顯差異(t=0.714,P=0.515)。
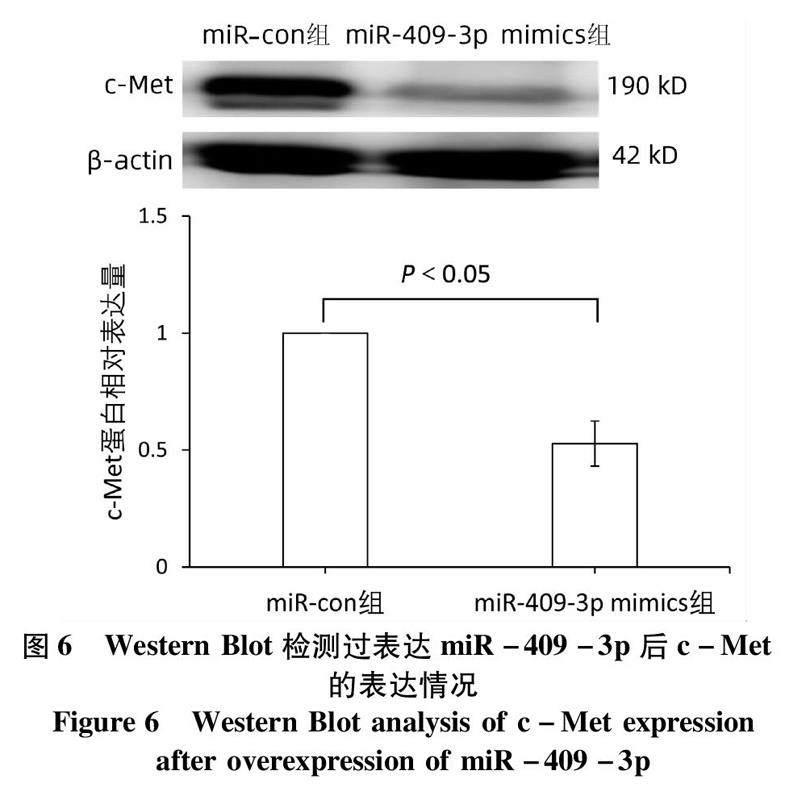
2.3miR-409-3p 抑制肝癌HepG2細胞中c-Met蛋白的表達利用生物信息學軟件預測發現miR-409-3p同c-Met的3UTR端有互補結合位點,熒光素酶報告系統鑒定結果顯示c-met為miR-409-3p的靶基因(表4)。與miR-con組相比,HepG2細胞轉染miR-409-3p mimics后,細胞中c-Met蛋白的表達下調(t=-8.509,P=0.001)(圖6)。
3討論
HCC占原發性肝癌的75%~85%,僅美國2020年約3萬人死于HCC[8-9]。全球范圍內,HCC的臨床轉歸不盡如人意,這主要歸因于缺乏早期診斷的可靠指標、治療抵抗、腫瘤的復發及轉移等。目前,針對HCC高危人群所采取的每6~12個月行甲胎蛋白(AFP)聯合B超檢查最為常用。但是,達到HCC診斷標準的高水平血清AFP(>400 ng/mL)僅出現于少部分HCC患者。除此之外,即使是間隔3個月的B超監測仍無助于小肝癌診斷率的提高[10-11]。一定程度上,AFP與B超的聯合應用不僅無益于診斷率的提高,而且會引發對假陽性的懷疑[12]。因此,迫切需要研究新的分子生物標志物來幫助臨床醫師早期診斷及判斷預后,并依此設計新的治療策略及方案來提高HCC的臨床預后。近年來miRNA的深入研究為這一良好愿景實現的可能提供了巨大的希望[13-14]。
miRNA為非編碼RNA家族成員,可調控編碼蛋白質的信使RNA的穩定性及翻譯過程,但其本身并不翻譯成為蛋白質[15]。miRNA既可為致癌基因,亦可為抑癌基因,且與多種類型的人類癌癥相關[16]。大量的證據[17]表明,miRNA的異常表達與調控細胞凋亡、增殖、細胞周期及轉移的相關基因的表達有緊密的關系,可導致HCC的發生及發展。因此,有必要探索其在腫瘤發展中所扮演的重要作用。近年來,有關miR-409-3p與癌癥的關系不斷引起人們的關注,研究發現其在肺癌[18]、胃癌[19]、宮頸癌[20]、結腸癌[21]、乳腺癌[22]等腫瘤中發揮抑癌作用,但在HCC發生及發展中的作用需要進一步的研究加以闡明。因此,作者通過對TCGA數據庫中肝癌組織和癌旁組織miR-409-3p表達水平的測序數據進行分析,并且分析了miR-409-3p在不同肝癌細胞系及正常肝細胞中的表達差異,結果顯示其在肝癌中的表達水平較正常肝細胞低。功能學實驗表明,轉染miR-409-3p mimics可抑制肝癌HepG2細胞增殖。上述結果證明,miR-409-3p在肝癌HepG2細胞中發揮抑癌基因作用。
大量的證據證明,miRNA在功能上通過介導上述蛋白質的表達參與控制細胞周期的調控。在鼠類肝癌細胞系中,周期蛋白D2和E2已被鑒定為miR-26a的直接靶基因;而在人肝細胞癌細胞中,miR-195可調控周期蛋白D1、CDK6和E2F3的表達。因此,miR-26a或miR-195的低表達驅使G1期向S期轉換[23-24]。同樣地,miR-503通過下調周期蛋白D3和E2F3的表達抑制G1期向S期轉換[25]。更重要的是,在HCC細胞中miR-221可負性調控周期蛋白依賴性激酶抑制因子(cyclin dependent kinase inhibitor,CDKⅠ)CDKN1B/p27和CDKN1C/p57的表達[26]。此外,miRNA可以通過抑制某些間接參與細胞周期蛋白的表達從而調控G1期向S期轉換。在HCC細胞中,某些miRNA同樣可以抑制G2期向M期轉換,從而發揮抑癌基因作用。例如,Liu等[27]研究發現miR-517a和miR-517c的異常表達阻滯G2期向M期轉換,發揮抑制HCC細胞增殖的作用。本研究發現,轉染miR-409-3p mimics后肝癌細胞HepG2的G2期細胞增多,阻滯G2期向M期轉換,從而抑制細胞的增殖。上述結果進一步說明,miR-409-3p通過調控細胞周期的轉換影響肝癌HepG2細胞的增殖。
肝細胞生長因子受體,即c-Met,是一種致癌性的受體蛋白酪氨酸激酶,在40%~70%的HCC患者中呈高表達[28-29]。據報道,HCC中c-Met的表達可被miR-206[30]、miR-101-3p[31]和miR-128-3p[32]負性調控。在不同腫瘤中,miR-409-3p亦可通過調控c-Met的表達發揮抑癌基因作用。Xu等[6]研究表明,miR-409-3p通過靶向調控c-Met抑制膀胱癌細胞的遷移和侵襲;同樣,Wan等[7]研究發現,miR-409-3p通過靶向調控c-Met發揮抑制人肺癌的作用。Huynh等[33]研究發現,采用c-Met抑制劑——Foretinib處理HCC細胞后,細胞周期蛋白B表達減少,導致G2/M期阻滯,從而抑制HCC細胞增殖及集落形成。本研究發現,轉染miR-409-3p mimics后肝癌細胞HepG2中c-Met蛋白表達降低。上述結果進一步說明,miR-409-3p通過調控c-Met的表達,進一步影響下游信號通路,通過對細胞周期分布的影響抑制肝癌HepG2細胞的增殖。
然而,本實驗仍有一些不足之處。首先,本實驗未研究肝癌組織與正常肝組織中miR-409-3p表達差異,僅通過數據庫加以分析,因此,后續實驗需要收集一定數量的配對組織標本進一步明確miR-409-3p的臨床意義。其次,本試驗所選取的4種肝癌細胞系中,miR-409-3p的表達均顯著低于正常肝細胞系,在肝癌細胞系中轉染miR-409-3p 抑制劑后未出現miR-409-3p的差異性低表達,因此無法進行miR-409-3p inhibitor組的體外試驗。
總之,本研究表明miR-409-3p在肝癌細胞系中呈低表達,且可以通過調控c-Met蛋白的表達抑制肝癌HepG2細胞的增殖。此miR-409-3p/c-Met軸為探索HCC的發病機制提供了一個新的見解,且為HCC的干預和治療提供了一個更廣闊的視角。但其詳盡的作用機制及臨床應用價值仍需要進一步更為深入的研究。
利益沖突聲明:本文不存在任何利益沖突。作者貢獻聲明:王長青負責課題設計,實驗操作,資料分析,撰寫論文;陳玲、徐萍參與實驗操作,收集分析數據,修改論文;朱曉娟、劉政負責擬定研究思路,指導撰寫文章并最后定稿。
參考文獻:
[1]RUIZ-MANRIQUEZ LM, CARRASCO-MORALES O, SANCHEZ Z EA, et al. MicroRNA-mediated regulation of key signaling pathways in hepatocellular carcinoma: A mechanistic insight[J]. Front Genet, 2022, 13: 910733. DOI: 10.3389/fgene.2022.910733.
[2]COOPER CS, PARK M, BLAIR DG, et al. Molecular cloning of a new transforming gene from a chemically transformed human cell line[J]. Nature, 1984, 311(5981): 29-33. DOI: 10.1038/311029a0.
[3]FAIELLA A, RICCARDI F, CARTEN G, et al. The emerging role of c-Met in carcinogenesis and clinical implications as a possible therapeutic target[J]. J Oncol, 2022, 2022: 5179182. DOI: 10.1155/2022/5179182.
[4]CHEN L, SHI Y, ZHU X, et al. IL-10 secreted by cancer-associated macrophages regulates proliferation and invasion in gastric cancer cells via c-Met/STAT3 signaling[J]. Oncol Rep, 2019, 42(2): 595-604. DOI: 10.3892/or.2019.7206.
[5]MA Y, ZHANG M, WANG J, et al. High-affinity human anti-c-Met IgG conjugated to oxaliplatin as targeted chemotherapy for hepatocellular carcinoma[J]. Front Oncol, 2019, 9: 717. DOI: 10.3389/fonc.2019.00717.
[6]XU X, CHEN H, LIN Y, et al. MicroRNA-409-3p inhibits migration and invasion of bladder cancer cells via targeting c-Met[J]. Mol Cells, 2013, 36(1): 62-68. DOI: 10.1007/s10059-013-0044-7.
[7]WAN L, ZHU L, XU J, et al. MicroRNA-409-3p functions as a tumor suppressor in human lung adenocarcinoma by targeting c-Met[J]. Cell Physiol Biochem, 2014, 34(4): 1273-1290. DOI: 10.1159/000366337.
[8]General Office of National Health Commission. Standard for diagnosis and treatment of primary liver cancer (2022 edition)[J]. J Clin Hepatol, 2022, 38(2): 288-303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.國家衛生健康委辦公廳. 原發性肝癌診療指南(2022年版)[J]. 臨床肝膽病雜志, 2022, 38(2): 288-303. DOI: 10.3969/j.issn.1001-5256.2022.02.009.
[9]SIEGEL RL, MILLER KD, GODING SAUER A, et al. Colorectal cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(3): 145-164. DOI: 10.3322/caac.21601.
[10]FORNER A, LLOVET JM, BRUIX J. Hepatocellular carcinoma[J]. Lancet, 2012, 379(9822): 1245-1255. DOI: 10.1016/S0140-6736(11)61347-0.
[11]RAY K. Liver cancer: The promise of new approaches in the management of hepatocellular carcinoma--adding to the toolbox?[J]. Nat Rev Gastroenterol Hepatol, 2013, 10(4): 195. DOI: 10.1038/nrgastro.2013.52.
[12]TRINCHET JC, CHAFFAUT C, BOURCIER V, et al. Ultrasonographic surveillance of hepatocellular carcinoma in cirrhosis: a randomized trial comparing 3- and 6-month periodicities[J]. Hepatology, 2011, 54(6): 1987-1997. DOI: 10.1002/hep.24545.
[13]ZHOU Q, SHAO JG. Research progress of miRNA in HBV-related hepatocellular carcinoma[J]. J Nantong Univ(Med Sci) , 2022, 42(3): 257-261. DOI: 10.16424/j.cnki.cn32- 1807/r.2022.03.013.周倩, 邵建國. MiRNA在HBV相關肝癌中的研究進展[J]. 南通大學學報(醫學版), 2022, 42(3): 257-261. DOI: 10.16424/j.cnki.cn32-1807/r.2022.03.013.
[14]XIE HJ, RASHED N, NING Y, et al. Current status of research on circulating microRNAs as diagnostic markers for hepatocellular carcinoma [J]. J Clin Hepatol, 2021, 37(2): 448-451. DOI: 10.3969/j.issn.1001-5256.2021.02.042.謝惠君, Rashed Nasot, 寧勇, 等. 循環miRNA作為肝細胞癌標志物的研究現狀[J]. 臨床肝膽病雜志, 2021, 37(2): 448-451. DOI: 10.3969/j.issn.1001-5256.2021.02.042.
[15]HUSSEN BM, HIDAYAT HJ, SALIHI A, et al. MicroRNA: A signature for cancer progression[J]. Biomed Pharmacother, 2021, 138: 111528. DOI: 10.1016/j.biopha.2021.111528.
[16]PIEROULI K, PAPAKONSTANTINOU E, PAPAGEORGIOU L, et al. Long non-coding RNAs and microRNAs as regulators of stress in cancer (Review)[J]. Mol Med Rep, 2022, 26(6): 361. DOI: 10.3892/mmr.2022.12878.
[17]HUANG S, HE X. The role of microRNAs in liver cancer progression[J]. Br J Cancer, 2011, 104(2): 235-240. DOI: 10.1038/sj.bjc.6606010.
[18]LIU S, LI B, XU J, et al. SOD1 Promotes cell proliferation and metastasis in non-small cell lung cancer via an miR-409-3p/SOD1/SETDB1 epigenetic regulatory feedforward loop[J]. Front Cell Dev Biol, 2020, 8: 213. DOI: 10.3389/fcell.2020.00213.
[19]WANG Y, ZHANG J, CHEN X, et al. Circ_0001023 promotes proliferation and metastasis of gastric cancer cells thro ugh? miR-409-3p/PHF10 axis[J]. Onco Targets Ther, 2020, 13: 4533-4544. DOI: 10.2147/OTT.S244358.
[20]CUI X, CHEN J, ZHENG Y, et al. Circ_0000745 promotes the progression of cervical cancer by regulating miR-409-3p/ATF1 axis[J]. Cancer Biother Radiopharm, 2022, 37(9): 766-778. DOI: 10.1089/cbr.2019.3392.
[21]CHEN J, WANG R, LU E, et al. LINC00630 as a miR-409-3p sponge promotes apoptosis and glycolysis of colon carcinoma cells via regulating HK2[J]. Am J Transl Res, 2022, 14(2): 863-875.
[22]YANG S, ZOU C, LI Y, et al. Knockdown circTRIM28 enhances tamoxifen sensitivity via the miR-409-3p/HMGA2 axis in breast cancer[J]. Reprod Biol Endocrinol, 2022, 20(1): 146. DOI: 10.1186/s12958-022-01011-3.
[23]KOTA J, CHIVUKULA RR, ODONNELL KA, et al. Therapeutic microRNA delivery suppresses tumorigenesis in a murine liver cancer model[J]. Cell, 2009, 137(6): 1005-1017. DOI: 10.1016/j.cell.2009.04.021.
[24]XU T, ZHU Y, XIONG Y, et al. MicroRNA-195 suppresses tumorigenicity and regulates G1/S transition of human hepatocellular carcinoma cells[J]. Hepatology, 2009, 50(1): 113-121. DOI: 10.1002/hep.22919.
[25]XIAO F, ZHANG W, CHEN L, et al. MicroRNA-503 inhibits the G1/S transition by downregulating cyclin D3 and E2F3 in hepatocellular carcinoma[J]. J Transl Med, 2013, 11: 195. DOI: 10.1186/1479-5876-11-195.
[26]FORNARI F, GRAMANTIERI L, FERRACIN M, et al. MiR-221 controls CDKN1C/p57 and CDKN1B/p27 expression in human hepatocellular carcinoma[J]. Oncogene, 2008, 27(43): 5651-5661. DOI: 10.1038/onc.2008.178.
[27]LIU RF, XU X, HUANG J, et al. Down-regulation of miR-517a and miR-517c promotes proliferation of hepatocellular carcinoma cells via targeting Pyk2[J]. Cancer Lett, 2013, 329(2): 164-173. DOI: 10.1016/j.canlet.2012.10.027.
[28]UEKI T, FUJIMOTO J, SUZUKI T, et al. Expression of hepatocyte growth factor and its receptor, the c-met proto-oncogene, in hepatocellular carcinoma[J]. Hepatology, 1997, 25(3): 619-623. DOI: 10.1002/hep.510250321.
[29]GIORDANO S, COLUMBANO A. Met as a therapeutic target in HCC: facts and hopes[J]. J Hepatol, 2014, 60(2): 442-452. DOI: 10.1016/j.jhep.2013.09.009.
[30]WANG Y, TAI Q, ZHANG J, et al. MiRNA-206 inhibits hepatocellular carcinoma cell proliferation and migration but promotes apoptosis by modulating cMET expression[J]. Acta Biochim Biophys Sin (Shanghai), 2019, 51(3): 243-253. DOI: 10.1093/abbs/gmy119.
[31]LIU Y, TAN J, OU S, et al. MicroRNA-101-3p suppresses proliferation and migration in hepatocellular carcinoma by targeting the HGF/c-Met pathway[J]. Invest New Drugs, 2020, 38(1): 60-69. DOI: 10.1007/s10637-019-00766-8.
[32]XU X, JIANG W, HAN P, et al. MicroRNA-128-3p Mediates Lenvatinib Resistance of Hepatocellular Carcinoma Cells by Downregulating c-Met[J]. J Hepatocell Carcinoma, 2022, 9: 113-126. DOI: 10.2147/JHC.S349369.
[33]HUYNH H, ONG R, SOO KC. Foretinib demonstrates anti-tumor activity and improves overall survival in preclinical models of hepatocellular carcinoma[J]. Angiogenesis, 2012, 15(1): 59-70. DOI: 10.1007/s10456-011-9243-z.
收稿日期:2022-11-05;錄用日期:2023-02-27
本文編輯:王瑩
引證本文:WANG CQ, CHEN L, XU P,? et al. Expression of miR-409-3p in hepatoma HepG2 cells and its mechanism in cell proliferation[J]. J Clin Hepatol, 2023, 39(8): 1895-1902.

